吉西他滨联合紫杉醇方案与长春瑞滨单药方案治疗蒽环类耐药的转移性乳腺癌的临床观察
张 杰, 徐 可, 王少龙
(成都医学院第一附属医院, 成都 610500)
•临床研究•
吉西他滨联合紫杉醇方案与长春瑞滨单药方案治疗蒽环类耐药的转移性乳腺癌的临床观察
张 杰, 徐 可, 王少龙△
(成都医学院第一附属医院, 成都 610500)
目的:评价吉西他滨联合紫杉醇方案与单药长春瑞滨方案在治疗蒽环类耐药的转移性乳腺癌患者中的疗效及不良反应。方法: 2009年10月至2012年12月,我科收治的符合治疗条件的晚期乳腺癌患者共126例,随机分为吉西他滨联合紫杉醇组(GT组)及单药长春瑞滨组(NVB组),观察有效率(RR)、疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)及不良反应。采用χ2检验比较各组治疗有效率、疾病控制率及不良反应,采用Kaplan-Meier法计算生存率,采用Log-rank检验进行生存率的比较。结果: GT组较NVB组在RR及OS方面有优势(P=0.033;P=0.013),在DCR、PFS方面差异无统计学意义(P=0.440;P=0.159),在不良反应方面有较多的中重度白细胞减少(P=0.025)、轻度恶心呕吐(P=0.035)、便秘(P=0.030)、肌肉关节疼痛(P=0.000)及疲乏无力(P=0.003)。结论: 对于身体状况较好的患者,使用吉西他滨联合紫杉醇方案较单药长春瑞滨方案有助于提高患者的RR及OS,但需注意不良反应的监测及相应的处理。
吉西他滨联合紫杉醇;长春瑞滨;蒽环类耐药;转移性乳腺癌
乳腺癌是我国女性常见的恶性肿瘤。近年来,随着常规体检的普及,化疗、分子靶向治疗及内分泌治疗的逐步规范,使得乳腺癌病死率逐年下降,但发病率迅速攀升[1-2]。而在临床工作中我们观察到,对蒽环类化疗药物耐药的转移性乳腺癌患者的治疗效果并不理想。此类患者的后继治疗中,吉西他滨联合紫杉醇(GT方案)[3]及单药长春瑞滨方案(NVB方案)[4]均为复发或转移乳腺癌的可选治疗方案,有研究报道GT方案在有效率(response rate, RR)、疾病进展时间(time to progression, TTP)及中位生存期(median survival time, MST)等指标上均优于单药紫杉醇[3]。而且,在患者生活质量的提高上,GT方案较单药紫杉醇[5]或不继续治疗观察[6]均有优势。但是,因为并无相关的随机对照试验,所以GT方案与NVB方案对于晚期乳腺癌患者的治疗作用及不良反应方面的优劣尚不清楚。对于此类患者而言,哪种化疗方案可作为优选方案选择?为了对这个问题作出解释,本研究中我们将此类患者随机分为2组,分别使用GT方案及NVB方案化疗,观察其疗效及不良反应等指标,现报告如下。
1 资料与方法
1.1 临床资料
自2009年10月至2012年12月,我科收治的符合治疗条件的晚期乳腺癌患者共126例,采用随机数字表法随机分为GT组及NVB组进行治疗,分组资料见表1,两组间差异均无统计学意义(P值均>0.05)。
所有入组患者均需符合以下条件:女性;体能状况评分可耐受化疗,即卡氏评分>70分(karnofsky performance status,KPS);有明确及完整的病理学诊断依据;无可能的化疗禁忌,如心功能不全、肝肾功不全、既往化疗后骨髓功能不佳或全身其他系统疾病可能无法耐受化疗者均需排除;既往治疗后(指确诊乳腺癌后所接受的治疗方案,包括可能的手术、放化疗及内分泌治疗等)出现可评估的内脏转移(局部复发、区域淋巴结转移、单纯骨转移或颅内转移不能入组);既往治疗过程中曾接受过一种包含蒽环类药物的辅助化疗方案(如此方案中含有紫杉类药物则需停用紫杉醇后的6个月内未出现疾病进展);雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及表皮生长因子受体(human epidermal growth factor receptor- 2, HER- 2)均为阴性的患者;ER、PR受体阴性,HER-2阳性患者不愿或无法接受曲妥珠单抗治疗者;ER、PR受体阳性,HER- 2阴性患者接受内分泌治疗(至少两种内分泌治疗方案)无效后;签署知情同意书,文化水平可理解治疗计划并能按计划配合治疗、随访工作的完成。
1.3 治疗方案及用药
GT方案:紫杉醇135 mg/m2,第1天;吉西他滨1 000 mg/m2静滴,第1、8天(吉西他滨在紫杉醇之后使用),每21天重复(如因白细胞降低等并发症推迟治疗,推迟时间不能超过14天)。NVB单药方案:25 mg/m2,第一天,每周一次(如因不良反应导致治疗推迟,推迟时间不能超过7天)。两种方案均用药至病情进展或患者出现严重不良反应而终止化疗。建议所有患者行深静脉置管以减轻静脉炎可能。治疗期间常规使用止吐药物、保护肝脏、心脏药物。骨转移患者常规使用双磷酸盐。
所有患者治疗前均行基线评估,治疗期间按计划进行复查,收集疗效及不良反应相关数据。待患者病情进展后进入随访观察期。
1.4 评估指标及安排
1.4.1 基线评估 心电图、超声心动图、胸腹部CT增强扫描、头部MRI、骨扫描、血常规、肝肾功电解质、肿瘤标记物癌胚抗原。
1.4.2 治疗期间评估 每周复查血常规、每四周复查肝肾功电解质及心电图、每八周复查胸腹部CT增强扫描及头部MRI、每六个月复查骨扫描(如有必要)。进展后进入随访期。
1.4.3 疗效评价指标 按照实体瘤疗效评价标准(response evaluation criteria in solid tumors, RESIST 1.1版)进行评估,治疗期间的疗效评价分为:完全缓解(complete response, CR)、部分缓解(partial response, PR)、稳定(stable disease, SD)及进展(progressive disease, PD)。判定为CR或PR的患者需在判定4周后进行确认评估。
至今为止,GEVIs已成功在实验室培养皿中的神经元细胞和从昆虫到小鼠的许多种动物的完整大脑中,记录了单个动作电位。这一技术最有前景之处在于它有可能实现记录膜电位除了剧烈电位变化之外的、微小的阈下变化,以此反映出神经元细胞从周围细胞中接收到的讯息。科恩说:“电压成像让人们看到体内神经元的输入信号,这在以前如同是天方夜谭。”
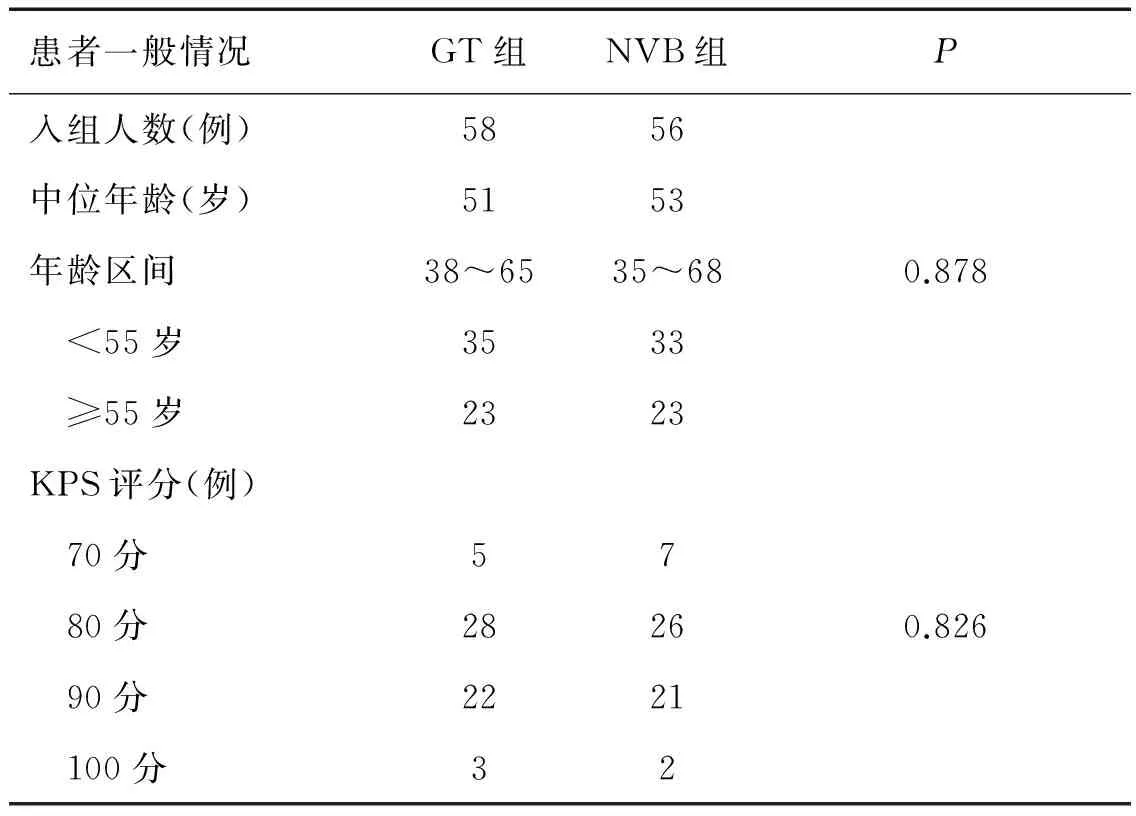
表1 两组患者的临床资料
(转下表)
(接上表)
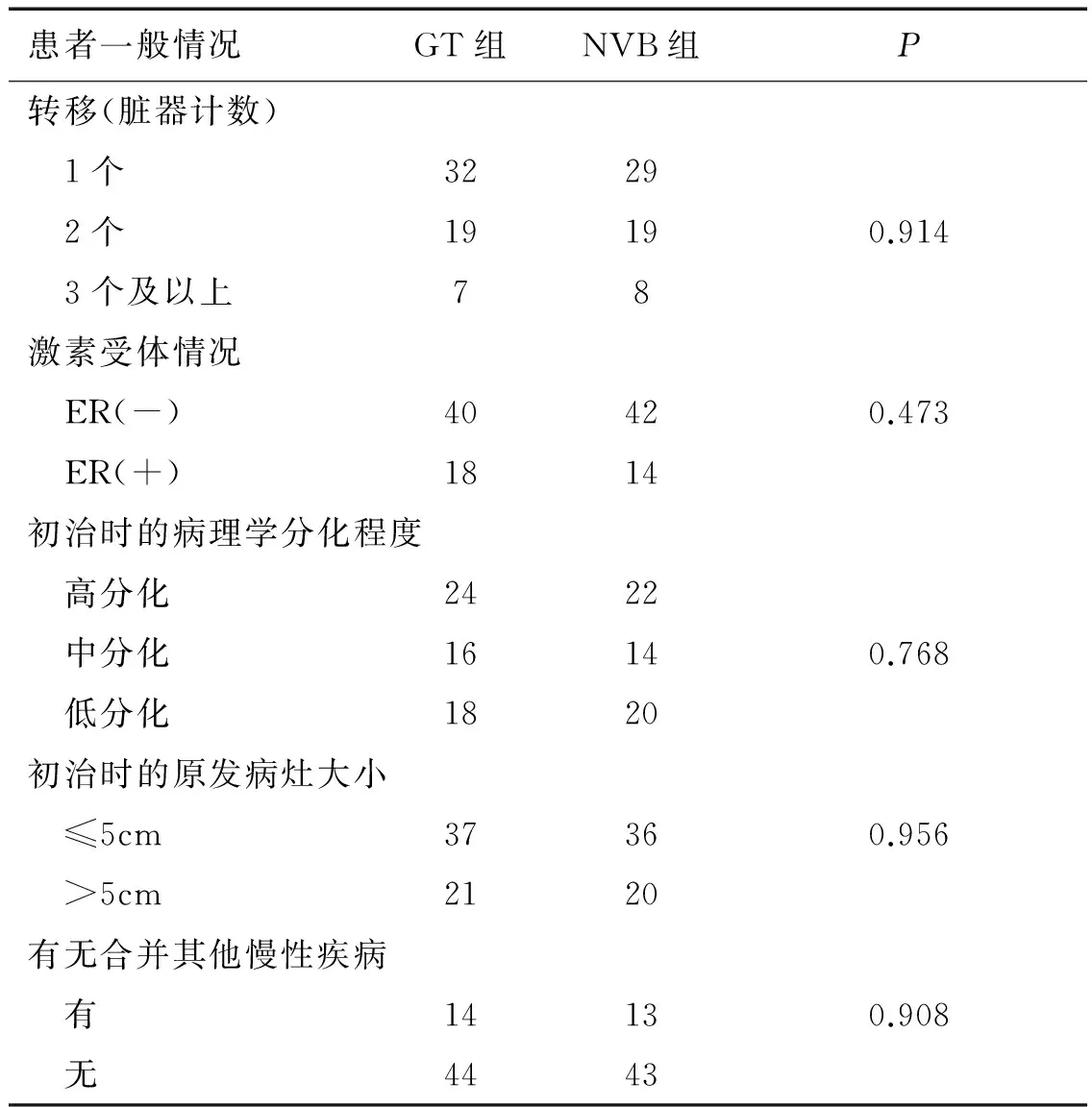
患者一般情况GT组NVB组P转移(脏器计数) 1个3229 2个19190.914 3个及以上78激素受体情况 ER(-)40420.473 ER(+)1814初治时的病理学分化程度 高分化2422 中分化16140.768 低分化1820初治时的原发病灶大小 ≤5cm37360.956 >5cm2120有无合并其他慢性疾病 有14130.908 无4443
1.4.4 不良反应的评价标准 按照常见不良反应事件评价标准(common terminology criteria for adverse events, CTCAE 4.0)对出现的常见治疗相关不良反应进行分级。如出现Ⅲ、Ⅳ度不良反应,本周期化疗暂停,给予积极对症处理后观察患者恢复情况,如能按时进行下周期治疗的患者,化疗药物减量至75%,治疗后如仍出现Ⅲ、Ⅳ度不良反应则考虑出组。
1.4.5 观察指标 有效率(response rate, RR):CR、PR患者占该组所有患者的比例。疾病控制率(disease control rate, DCR):CR、PR及SD患者占该组所有患者的比例。无进展生存期(progression-free survival, PFS):从随机入组接受治疗至患者肿瘤进展或死亡的时间。总生存期(overall survival, OS):自患者入组接受治疗开始至最终死亡的时间。不良反应(按出现的严重程度分级记录)。
1.5 随访安排
所有患者出组后均进入随访期,指派专人负责随访工作,所有患者均采用电话随访或返院复查的方式进行,随访终止时间为2015年5月1日,GT组失访2例,NVB组3例,失访的患者计为死亡,死亡时间以末次随访时间为准。
1.6 统计方法
使用SPSS 17.0软件进行统计分析。采用χ2检验比较各组治疗有效率、疾病控制率及不良反应,采用Kaplan-Meier法计算两组各自的生存率,采用Log-rank检验进行两组间生存率的比较。检验效能α=0.05,P<0.05为差异有统计学意义。
2 结 果
126例患者随机入组接受治疗,GT方案治疗组及NVB治疗组各63例,因进展后患者自行接受其他抗肿瘤治疗导致GT方案组出组5例,NVB治疗组7例。最终,GT组共58例、NVB组共56例完成治疗及随访。GT组平均化疗周期数为6.10±2.284个周期,NVB组化疗的平均时长为5.55±1.536个月。
2.1 近期疗效:有效率(RR)及疾病控制率(DCR)
GT组CR 1例,PR 29例,SD 17例,PD 11例;NVB组CR 0例,PR 17例,SD 24例,PD 15例。两组患者的RR有统计学差异(51.72%与30.36%,χ2=4.523,P=0.033),GT组较优,两组间的DCR无明显统计学差异(81.03%与73.21%,χ2=0.595,P=0.440)。
2.2 近期疗效:无进展生存期(PFS)
平均PFS:GT组为6.193月(5.590~6.796月),NVB组为5.663月(5.248~6.077月)。中位PFS:GT组为5.0月(4.328~5.672月),NVB组为6.0月(5.591~6.409月)。总体评价:χ2=1.986,P=0.159。差别无统计学意义,见图1。
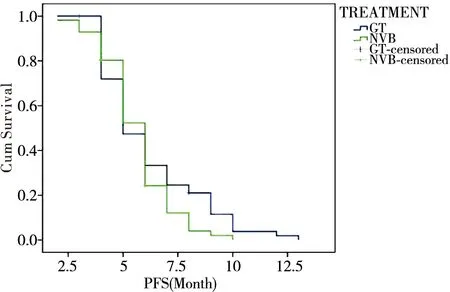
图1 两组间PFS的比较
2.3 远期疗效:总生存期(OS)
平均OS:GT组为16.116月(14.346~17.885月),NVB组为13.340月(12.422~14.257月)。中位OS:GT方案组为14.0月(12.964~15.036月),NVB组为14.0月(13.035~14.965月)。总体评价:χ2=6.107,P=0.013。差别有统计学意义,GT组较优,见图2。
2.4 不良反应
患者在治疗过程中出现的不良反应按严重程度分级后以最重的分级记录。在血液学毒性中,GT方案相比NVB方案可导致更多的Ⅲ、Ⅳ级白细胞减少(67.24% vs. 44.64%,χ2=5.027,P=0.025)。而Ⅰ、Ⅱ度白细胞降低则是NVB方案较多(50% vs. 29.31%,χ2=4.275,P=0.039)。在消化道不良反应方面,GT方案相比NVB方案可导致更多的Ⅰ、Ⅱ度恶心呕吐(53.45% vs. 32.14%,χ2=4.444,P=0.035)及Ⅰ、Ⅱ度便秘(36.21% vs. 16.07%,χ2=4.728,P=0.030)。在全身反应方面,GT方案相比NVB方案相比可导致更多的肌肉关节疼痛(50% vs. 3.57%,χ2=28.720,P=0.000)及疲乏无力(67.24% vs. 37.50%,χ2=8.951,P=0.003)。此外,GT方案组中有8例患者因为出现严重不良反应导致治疗终止,而NVB治疗组有4例(数据未列出,13.79% vs. 7.14%,P>0.05)。具体数据见表3。
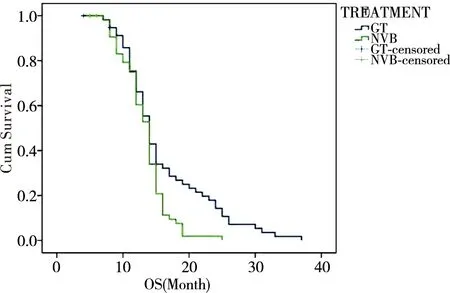
图2 两组间OS的比较
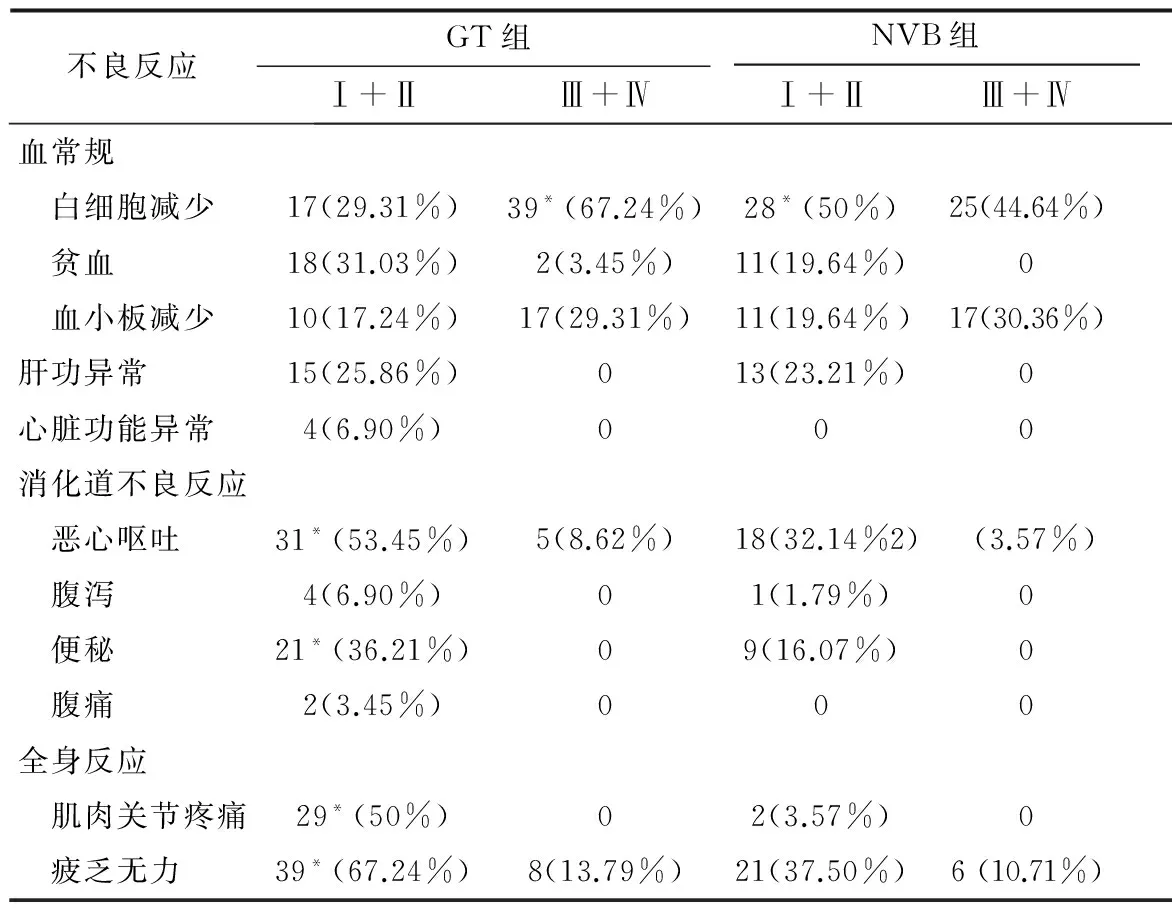
表3 两组患者不良反应的比较 [例(%)]
注:* 表示两组间相应级别的数据对比有统计学差异。
3 讨 论
乳腺癌是女性常见的恶性肿瘤,随着治疗手段的增加及治疗的规范,越来越多的患者可以长期存活。但仍有部分患者因治疗效果不佳出现远处转移而导致死亡。对于既往曾接受过化疗的患者而言,蒽环类药物是常用药物[7-8]。在接受蒽环类药物治疗后的乳腺癌患者中,如出现复发,可供选择的化疗方案并不多,其中,吉西他滨单药方案[9]与联合化疗方案[3, 10-12]及长春瑞滨单药治疗方案均为可选择的有效方案。但是,在遇到类似患者时,选择哪种方案可能使患者获益更多却并不明确。长春瑞滨的抗肿瘤机制与吉西他滨及紫杉醇不同,所以本研究的重点并非并是观察这两种方案在治疗过程中是否有效,而在于对特定人群使用何种方案可能使患者获益更多。
我们发现,GT方案及单药NVB方案在有效率上存在差异,差异有统计学意义,GT方案优于NVB方案,但在疾病控制率上却没有明显差异,说明GT方案较NVB方案CR、PR的患者较多,而NVB方案SD的患者较多,这可能与使用联合治疗方案对于患者的治疗作用可能更强有关,但也可能存在其他因素,因为目前并无明确的循证医学证据证实对于复发或转移的患者联合化疗方案一定优于单药治疗方案。
对于无进展生存期而言,我们的结论是两方案没有明显差异,但我们观察到两组的平均PFS与中位PFS间的趋势并不相符,GT组的平均PFS较长,而NVB组的中位PFS较长,这主要是因为GT组中有少数患者有较长的PFS所致。而对于总生存期而言,整体比较的结果是GT方案较优,在中位OS结果近似的情况下,GT组的平均OS较长,这主要是因为GT组有部分患者的生存时间较长,有患者能存活超过2年,这与Jones 等人的报道[13]相符。这可能与经过积极治疗达到CR或PR对疾病有一定的控制作用有关。
在不良反应方面,我们观察到GT方案较NVB方案有更多的的不良反应,特别是在中重度白细胞降低,轻度恶心呕吐、便秘(可能与GT方案组使用较多的止吐药物有关)及全身不适等方面,但对于一般情况较好的患者而言,经过积极对症处理后大部分患者可继续接受治疗,因治疗不良反应出组的患者数两组间对比并无统计学差异。
本研究还存在不足之处,其一是入选的患者例数较少,这主要与本研究入组条件较为苛刻及单一研究机构的患者数有限有关,我科仍在继续收集病例,以期增加入组患者的例数进而进行多因素分析以期校正可能的混杂因素。其二是是对于HER-2情况是否影响化疗方案的选择在本研究中并未涉及。其三是有少部分患者在接受本研究治疗计划后出现进展,但仍有较好的身体条件及体能状态评分,不过却未继续调整方案治疗,此类患者是否可能在后继调整方案后的治疗中获益尚不明确,仍需进一步深入研究。
综上,本研究讨论了蒽环类药物耐药后转移性乳腺癌患者可行的化疗方案的选择,结果提示对于身体状况良好的既往使用蒽环类药物后耐药的患者,吉西他滨联合紫杉醇方案较单药长春瑞滨方案而言是优选的姑息治疗方案,可以提高此类患者的总生存期,但对于可能出现的严重不良反应需要重视,做好相应的预防及处理。
[1] Bourdeanu L, Luu T. Targeted therapies in breast cancer: implications for advanced oncology practice [J]. J Adv Pract Oncol, 2014, 5(4):246-260.
[2] Kelly CM, Buzdar AU. Using multiple targeted therapies in oncology: considerations for use, and progress to date in breast cancer [J]. Drugs, 2013, 73(6):505-515.
[3] Albain KS, Nag SM, Calderillo-Ruiz G, et al. Gemcitabine plus Paclitaxel versus Paclitaxel monotherapy in patients with metastatic breast cancer and prior anthracycline treatment [J]. J Clin Oncol, 2008, 26(24):3950-3957.
[4] Zelek L, Barthier S, Riofrio M, et al. Weekly vinorelbine is an effective palliative regimen after failure with anthracyclines and taxanes in metastatic breast carcinoma [J]. Cancer, 2001, 92(9):2267-2272.
[5] Moinpour CM, Donaldson GW, Liepa AM, et al. Evaluating health-related quality-of-life therapeutic effectiveness in a clinical trial with extensive nonignorable missing data and heterogeneous response: results from a phase Ⅲ randomized trial of gemcitabine plus paclitaxel versus paclitaxel monotherapy in patients with metastatic breast cancer [J]. Qual Life Res, 2012, 21(5):765-775.
[6] Park YH, Jung KH, Im SA, et al. Phase Ⅲ, multicenter, randomized trial of maintenance chemotherapy versus observation in patients with metastatic breast cancer after achieving disease control with six cycles of gemcitabine plus paclitaxel as first-line chemotherapy: KCSG-BR07- 02 [J]. J Clin Oncol, 2013, 31(14):1732-1739.
[7] Langley RE, Carmichael J, Jones AL, et al. Phase Ⅲ trial of epirubicin plus paclitaxel compared with epirubicin plus cyclophosphamide as first-line chemotherapy for metastatic breast cancer: United Kingdom National Cancer Research Institute trial AB01 [J]. J Clin Oncol, 2005, 23(33):8322-8330.
[8] Nabholtz JM, Falkson C, Campos D, et al. Docetaxel and doxorubicin compared with doxorubicin and cyclophosphamide as first-line chemotherapy for metastatic breast cancer: results of a randomized, multicenter, phase Ⅲ trial [J]. J Clin Oncol, 2003, 21(6):968-975.
[9] Seidman AD. Gemcitabine as single-agent therapy in the management of advanced breast cancer [J]. Oncology, 2001, 15(2 Suppl 3):11-14.
[10]O′Shaughnessy J, Schwartzberg L, Danso MA, et al. Phase Ⅲ study of iniparib plus gemcitabine and carboplatin versus gemcitabine and carboplatin in patients with metastatic triple-negative breast cancer [J]. J Clin Oncol, 2014, 32(34):3840-3847.
[11]Xu B, Jiang Z, Kim SB, et al. Biweekly gemcitabine-paclitaxel, gemcitabine-carboplatin, or gemcitabine-cisplatin as first-line treatment in metastatic breast cancer after anthracycline failure: a phase II randomized selection trial [J]. Breast cancer, 2011, 18(3):203-212.
[12]Hu XC, Zhang J, Xu BH, et al. Cisplatin plus gemcitabine versus paclitaxel plus gemcitabine as first-line therapy for metastatic triple-negative breast cancer (CBCSG006): a randomised, open-label, multicentre, phase 3 trial [J]. Lancet Oncol, 2015, 16(4):436-446.
[13]Jones J, Takeda A, Tan SC, et al. Gemcitabine for the treatment of metastatic breast cancer [J]. Health Technol Assess, 2009, 13 Suppl 2:1-7.
Gemcitabine plus Paclitaxel Regimen and Vinorelbine Single Agent Regimen for Anthracycline-resistant Metastatic Breast Cancer
Zhang Jie, Xu Ke, Wang Shaolong△
(DepartmentofOncology,TheFirstAffiliatedHospitalofChengduMedicalCollege,Chengdu610500,Sichuan,China)
Objective: To evaluate the difference in curative effect and adverse events between gemcitabine plus paclitaxel regimen and vinorelbine single agent regimen in treating anthracycline-resistant metastatic breast cancer patients. Methods: From Oct. 2009 to Dec.2012, 126 cases of metastatic breast cancer who met the criterion we established for this study were collected and randomized into gemcitabine plus paclitaxel group (GT group) and vinorelbine group (NVB group). The observation end points included response rate (RR), disease control rate (DCR), progression-free survival (PFS), overall survival (OS) and adverse events. Chi-square test was used to compare the RR, DCR and adverse events in both groups and Kaplan-Meier method was used to estimate the survival rate in both arms. Log-rank test was used to compare the survival rate of each group. Results: GT group,compared with NVB group, had better results in RR and OS and the differences were statistically significant (P=0.033;P=0.013). The results in DCR and PFS, however, had no statistically significant difference (P=0.440;P=0.159). GT group had more grade 3~4 adverse events of leucopenia (P=0.025), more grade 1~2 adverse events of nausea and vomiting (P=0.035), constipation (P=0.030), myalgia or arthralgia (P=0.000) and fatigue (P=0.003). Conclusion: Compared to NVB regimen, GT regimen may increase the RR and OS in patients of better physical condition but we should pay more attention to the adverse events.
Gemcitabine plus Paclitaxel; Vinorelbine; Anthracycline-resistant; Metastatic Breast Cancer
2015- 09- 08
2016- 01- 25
张 杰(1982-),男,新疆奎屯人,硕士,主治医师,主要研究方向:恶性肿瘤的化疗及多药耐药。
△王少龙,主任医师,E-mail: wangslzlk@126.com
R373.9;R730.53
A
10.3969/j.issn.1674- 0904.2016.01.003

