药学干预改善胃癌患者生活质量的初步研究*
刘 洋, 尤振宇△, 苏晓辉, 刘渤娜, 刘学飞
(1.解放军第202医院 肿瘤介入科, 沈阳 110003; 2.辽宁省肿瘤医院 胃外科, 沈阳 110003)
药学干预改善胃癌患者生活质量的初步研究*
刘 洋1, 尤振宇1△, 苏晓辉2, 刘渤娜1, 刘学飞1
(1.解放军第202医院 肿瘤介入科, 沈阳 110003; 2.辽宁省肿瘤医院 胃外科, 沈阳 110003)
目的:观察药学干预对在接受化疗期间的胃癌患者的生活质量的影响。方法: 解放军第202医院2012年3月至2014年3月期间收治的178例胃癌术后患者,随机分为接受静脉化疗和药学干预的干预组(n=89)和仅接受静脉化疗的对照组(n=89)。针对术后化疗所引起的胃肠道症状,临床药师根据患者对药物的反应情况进行药学干预。药学干预内容为与临床医生沟通,将对症治疗方案优化并且对临床用药进行指导。观察两组患者在治疗期间的消化道反应及两组患者生活质量。结果: 干预组患者在化疗前3个周期对止吐药物的完全缓解率分别为53.9%, 61.8%和64.0%,对照组为32.6%, 43.8%和46.1%,两组差异有统计学意义(P=0.004,P=0.016,P=0.016)。干预组的急性和迟发性恶心症状明显低于对照组(P=0.032,P=0.029);干预组的急性和迟发性呕吐程度明显低于对照组(P=0.020;P=0.031)。生活质量评分:干预组总健康状况评分高于对照组(P=0.022),而食欲丧失、恶心和呕吐的症状评分低于对照组(P=0.021,P=0.018)。结论: 以临床药师主导的药学干预可降低胃癌患者在辅助化疗期间恶心、呕吐发生率,可改善患者生活质量。
药学干预; 胃癌; 化疗; 生活质量
胃癌是消化系统常见的恶性肿瘤,手术、化疗仍是治疗胃癌的主要方式。由于患病带来的心理压力及化疗药物的副反应,患者的生活质量常常下降。为提高患者生活质量,进一步降低化疗的毒性反应,临床药师参与了支持治疗方案的制订,对化疗期间的胃癌患者进行了药学干预。本研究观察了药学干预改善消化道副反应和生活质量的效果。
1 资料与方法
1.1 一般资料
本研究入选患者为2012年3月至2014年3月期间于我院就诊的178名胃癌术后患者。男性116 例、女性62 例,年龄41 ~ 76 岁,平均年龄(54.67±7.01)岁。患者均有明确的病理诊断。化疗前根据术后病理及入院后影像学检查,对患者进行分期,其中临床Ⅲ期105例,Ⅳ期73例。腺癌164例,印戒细胞癌14例。
入选患者均满足一般状况较好,无术后合并症,无脑转移,KPS评分70到100,血常规基本正常、心脏功能和肝肾功能基本正常。 均具备较好的沟通能力、阅读能力,能够完成问卷调查。本研究获得医院伦理委员会批准,入组患者及其家属均知情同意并签署知情同意书。应用随机软件Sequence Detection SystemV. 2.3 ( SDS2.3) 将患者分为干预组(接受化疗期间接受药学干预)和对照组(接受化疗期间不接受相应干预)。两组的基线临床病理资料差异无统计学意义(P>0.05),见表1。

表1 178例胃癌患者的治疗方案和临床病理特征
(转右表)
(接左表)
Variable(变量)Interventiongroup(干预组)(n=89)Controlgroup(对照组)(n=89)PChemotherapyprotocols(化疗方案)0.227 ECF3542 CapecitabineCom-binedwithOxali-platin(卡培他滨结合奥沙利铂)5447
Intervention group: receiving chemotherapy, pharmaceutical intervention; Control group: receiving chemotherapy(干预组:接受化疗和药学干预; 对照组:接受化疗)
1.2 化疗及药学干预方法
患者采用的化疗方案包括表阿霉素+顺铂+5-氟尿嘧啶(ECF)或卡培他滨联合奥沙利铂。在治疗中采用足量全程用药。对化疗过程中出现的生活质量下降,如:躯体功能、社交能力、睡眠障碍等,采取如下措施干预:1.专题健康教育。以专题讲座形式或医患谈心方式,每周2~4次对患者进行胃癌专题健康教育活动( 主管医师及责任护士也参加)。健康教育的内容包括胃癌防治保健知识、化疗中可能出现的对生活质量影响、积极健康思维导向等。2.临床药师参与的药物治疗。对睡眠障碍,便秘等,采用相应的药物治疗,如睡眠障碍应用阿普唑仑,便秘应用乳果糖等。干预组与对照组所用的止吐药物的种类、剂量、使用方法均无差异,具体如下:①对ECF方案采用昂丹司琼(8mg,静滴,d1-2)、地塞米松(6mg,口服,d1-3)和阿瑞匹坦(125 mg,口服,d1;80 mg,口服,d2-3);②对卡培他滨结合奥沙利铂方案,地塞米松(12mg,口服,d1-3)和昂丹司琼(8mg,静滴,d1-3)。对照组不进行药学干预,临床医师凭经验对患者进行治疗:对ECF方案,应用药物仍为昂丹司琼、地塞米松及阿瑞匹坦,但凭自己经验应用其中一种或几种组合;对卡培他滨结合奥沙利铂方案,应用药物仍为昂丹司琼、地塞米松,但同样凭经验应用其中一种或两种。而对干预组的患者治疗时,临床药师负责讲解化疗药物毒副反应和预防策略,对症治疗的止吐药物、用法用量、药学干预咨询、调整方案的意义。临床药师还要根据患者对化疗治疗用药的反应,及时针对性地提出调整方案,经与临床医师沟通后执行。为防止止吐药物引起便秘,采取如下方法处理:(1)指导患者的饮食和活动,多饮水和吃含纤维多的食物如蔬菜、水果。鼓励患者增加活动量,促进肠蠕动。(2)腹部按摩:沿着结肠走行方向按摩。通过深呼吸锻炼腹肌,增加排便动力。(3)药物防治:缓泻剂,以润滑肠道,如香油或液体石蜡油;使用开塞露、甘油栓塞肛。(4)用药无效时,用温盐水低压灌肠。
1.3 效果评定办法
1.3.1 完全缓解率 在辅助化疗开始5天内无呕吐为完全缓解(CR),非完全缓解包括部分缓解(PR)和无效(NC)。呕吐分为0 ~ Ⅳ级。0 级: 无呕吐; Ⅰ级: 呕吐1 ~ 2 次/d;Ⅱ级: 呕吐3 ~5 次/d; Ⅲ ~Ⅳ级: 呕吐超过5 次/d。0 级为CR,Ⅰ级PR,Ⅱ ~Ⅳ级为 NC[1]。观察时限三个周期化疗。
1.3.2 评定恶心程度和呕吐程度 化疗后24小时内发生的恶心呕吐为急性恶心、急性呕吐。延迟性恶心、呕吐指化疗24小时后发生的恶心、呕吐[2]。使用评分计算方法[3],对恶心和呕吐分别进行计分:依照EORTC QLQ-C30 表中的第14、15条,对患者出现的恶心呕吐每周期打分1次,得到前三个周期的得分后,再分别将前三个周期内发生恶心/呕吐的得分加在一起,再除以3(化疗周期数)即得恶心程度积分和呕吐程度积分(粗分)。然后再转化成标准化分=[ (RS-1)/R]×100(R是该条目的得分全距)[3]。分别计算出两组病人的急性恶心、延迟性恶心、急性呕吐、延迟性呕吐标准化分的中位数,并进行对比。
1.3.3 生活质量评分采用EORTC QLQ-C30生活质量测评量表 E0RTC QLQ—C30(V3.0)的分为功能领域、症状领域、总体健康状况及单一条目几部分,功能领域评分计算方法: SS=[1一(RS一1)/R]×100;症状领域和总体健康状况领域:SS=[(RS一1)/R]×100(R是各领域或条目的得分全距)[3]。在化疗前和第3周期结束1周后对患者生活质量进行评分,对两组的评分差值比较,即两组间生活质量变化[4]。
1.4 统计学方法
采用SPSS19.0统计分析软件软件包统计分析。计数资料应用卡方检验;两组间比较符合正态分布的计量资料应用t检验;生活质量评分应用非参数检验。分别比较干预组与对照组之间两组间临床病理特征、两组间呕吐的完全缓解率、恶心呕吐的严重程度和程度、两组间基线至化疗结束生活质量改善绝对值变化,并对总健康状况评分行多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 治疗情况
178例患者均完成3个周期或以上的足量化疗。止吐用药包括5-HT3受体拮抗剂(昂丹司琼),并联用糖皮质激素(地塞米松) ,神经激肽(N K)21 受体拮抗剂(阿瑞匹坦)。
2.2 呕吐的完全缓解率
在化疗的前3个周期,干预组止吐药物的完全缓解率(53.9%,61.8%,64.0%)与对照组(32.6%,43.8%,46.1%)相比较,两组差异有统计学意义(P=0.004,P=0.016,P=0.016)。见表2。
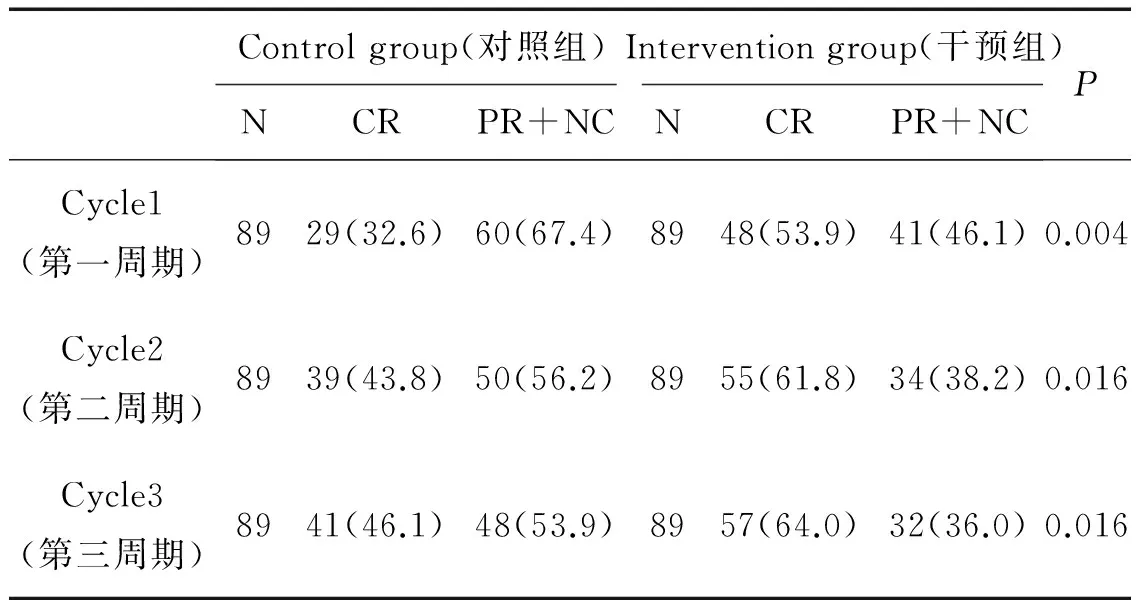
表2 两组患者呕吐完全缓解率(%)
2.3 恶心程度和呕吐程度
干预组患者急性恶心和延迟性恶心的标准化分的中位数(Median)分别为4.1和4.8,对照组为7.6和8.8,差异具有统计学意义(P<0.05);干预组患者急性呕吐和延迟性呕吐程度标准化分的中位数为0.5和0.3,对照组为2.2和1.8,差异具有统计学意义(P<0.05)。见表3。

表3 两组间恶心呕吐的严重程度
2.4 生活质量
应用EORTC QLQ-C30生活质量测评量表测评治疗前后评分变化。在化疗前和第3周期化疗结束后进行测评,测评后治疗前后计算差值。经干预后干预组的食欲丧失评分和恶心、呕吐评分均低于对照组,差异有统计学意义(P=0.018,P=0.032)。干预组患者情绪功能评分和总健康状况评分均高于对照组,差异有统计学意义(P=0.038;P=0.022)。见表4。
表4 两组间基线至化疗结束生活质量改善绝对值变化
Table 4 Absolute change of quality of life from baseline to the end of chemotherapy

Item(条目)Controlgroup(对照组)Interventiongroup(干预组)Median(中位数)Quartiles(四分位数)Median(中位数)Quartiles(四分位数)PDY12.70;46.816.213.6;44.70.752PA1.2-12.1;34.61.6-9.6;38.50.544FA10.20;33.313.60;33.30.862SL3.20;18.46.40;28.40.462AL18.40;41.00-12.6;33.30.021NV21.610.2;52.611.20;33.30.018CO23.80;38.418.90;33.30.204DI0-7.8;13.60-14.8,20.90.532PF-12.2-14.8;9.6-10.6-18.5;15.60.196RF10.4-21.8;26.49.6-19.6;28.20.256CF3.8-33.3;18.21.8-27.4;25.30.282EF-12.2-30.6;-4.8-8.4-22.4;-5.60.038SF5.2-12.6,29.22.6-11.5;34.30.562FI4.64.4;15.65.85.85;17.20.336GH-6.3-20.8;7.83.6-10.6;18.60.022
DY: dyspnea(呼吸困难), PA: pain(疼痛), FA: fatigue(疲劳), SL: sleeplessness(失眠), AL: appetite loss(食欲不振), NV: nausea/vomiting(恶心/呕吐), CO: constipation(便秘), DI: diarrhea(腹泻), PF: physical functions(躯体功能), RF: role functions(角色功能), CF: cognitive functions(认知功能), EF: emotion functions(情绪功能), SF: social functions(社会功能), FI: financial impact(经济困难), GH: global health(总体健康状况)。
3 讨 论
胃癌患者在化疗过程中常常伴随着严重的药物不良反应。针对化疗不良反应的治疗引起临床治疗的高度重视。但是,化疗药物所导致的毒副反应发生率仍然很高。既往大多只依靠临床医师的经验进行镇吐治疗,但临床效果却常常达不到患者的期望程度。药学干预在临床中能提高药物使用的合理性、提高治疗效果,同时降低治疗成本,提高患者生活质量。由于患者在治疗和康复过程中,时间长、痛苦大、费用高、并发症多,患者易根据自我判断或听信他人传言而降低依从性[5],而临床教育可以提高患者对疾病的认识,增加患者对治疗过程中出现各种情况的认知,从而消除误解。另外,临床药师对药物的作用、患者感受的及时沟通,会提醒临床医师对药物的及时调整,从而更及时改善症状,增强患者战胜疾病信心,提高生活质量。
药师指导临床用药在预防和治疗呕吐方面能起到提高作用。临床医师在预防呕吐用药时,对指南执行不彻底与化疗相关毒副反应控制不佳相关联[6-8]。Mertens[9]的研究认为,当临床医师发现对患者毒副反应治疗不足并调整用药后,患者的恶心、呕吐症状可明显改善。以上例证说明了药学干预减少了化疗导致的延迟性呕吐。在本研究前三个周期中,对照组对止吐药物的完全反应率均低于干预组 (P<0.05)。Caracuel[10]对102患者化疗药引起的恶心和呕吐的研究结果表明:药学干预组的延迟性呕吐完全缓解率比对照组患者高(分别为84.4%和69.6%)。虽然本研究的结果(三个周期分别为53.9%,61.8%,64.0%)中,干预组完全缓解率均低于Caracuel等的研究结果,但均显著高于对照组(32.6%,43.8%,46.1%)。本研究中对照组出现急性和延迟性恶心、呕吐的比例均高于干预组(P<0.05)。孙志丹等[11]报道药学干预组出现Ⅰ度、Ⅱ度和Ⅲ度恶心呕吐的发生率分别为43.6%,20.5%,5.1%,低于对照组;本研究结果与这一结论一致。
药学干预可对接受化疗的患者生活质量产生影响。Liekweg[12]对98例乳腺癌和卵巢癌患者进行药学干预研究,结果患者对止吐药反应率、生活质量和满意度均增加了。本研究前三个周期中,干预组的完全缓解率均显著高于对照组(P=0.004,P=0.016,P=0.016)(表2)且干预组患者急性恶心和延迟性恶心的标准化分的中位数以及急性呕吐和延迟性呕吐与对照组相比,差异均具有统计学意义(P<0.05) (表3)。在生活质量方面,经干预后干预组的食欲丧失评分和恶心、呕吐评分均显著低于对照组(P=0.018,P=0.032)。干预组患者情绪功能评分和总健康状况评分均显著高于对照组(P=0.038;P=0.022)(表4)。以上研究结果与Liekweg的研究一致。另有研究表明,如果药学干预在早期施予,不仅可以减少药物副作用,还能降低患者不依从,减少药物相互作用,减少药物错用等[13]。由于化疗是治疗晚期胃癌的主要手段之一,如果因副作用较大导致患者不接受化疗。则患者会失去一种主要的治疗方法。因此,药学干预在降低副作用同时,也在延长患者对化疗的耐受时间。而且,在施予药学干预时,早期进行干预是减少药物副作用,提高患者生活质量的好时机。
综上所述,药学干预在减轻化疗药物毒性作用和提高生活质量方面,具有积极作用。临床药师是医院内重要的资源之一,在患者住院期间,充分地发挥这一资源作用,有利于增强对化疗的耐受,以充分发挥化疗对胃癌患者的治疗作用。
[1] 左彩莹.沙利度胺联合盐酸托烷司琼对转移性乳腺癌GP 方案化疗所致恶心呕吐的疗效观察[J]. 中国临床研究,2014,27(12): 1491-1493.
[2] 中国抗癌协会癌症康复与姑息治疗专业委员会,中国临床肿瘤学会抗肿瘤药物安全管理专家委员会.肿瘤治疗相关呕吐防治指南(2014 版)[J].临床肿瘤学杂志, 2014,19(3): 263-273.
[3] 万崇华, 陈明清, 张灿珍,等. 癌症患者生命质量测定量表EORTC QLQ-C30 中文版评介 [J]. 实用肿瘤杂志, 2005,20(4): 353-355.
[4] 王丽娟,刘 威. 心理干预对胃癌患者焦虑抑郁症状影响的Meta分析[J]. 中国全科医学, 2013,16(7): 808-810.
[5] 詹笑春,林 娟. 肿瘤患者遵医行为影响因素分析及对策[J]. 齐鲁护理杂志, 2011,17(7): 50-51.
[6] Ellebaek E, Herrstedt J. Optimizing antiemetic therapy in multiple-day and multiple cycles of chemotherapy[J]. Curr Opin Support Palliat Care.,2008,2(1):28-34.
[7] Molassiotis A, Saunders MP, Valle J, et al. A prospective observational study of chemotherapy-related nausea and vomiting in routine practice in a UK cancer centre[J].Support Care Canc, 2008,16(2):201-208.
[8] Aapro MS, Schmoll HJ, Jahn F, et al. Review of the efficacy of aprepitant for the prevention of chemotherapy-induced nausea and vomiting in a range of tumor types[J]. Cancer treatment reviews, 2013,39(1):113-117.
[9] Mertens WC, Higby DJ, Brown D, et al. Improving the care of patients with regard to chemotherapy-induced nausea and emesis: the effect of feedback to clinicians on adherence to antiemetic prescribing guidelines[J]. J Clin Oncol, 2003;21(7):1373-1378.
[10]Caracuel F, Banos U, Herrera MD, et al. Influence of pharmaceutical care on the delayed emesis associated with chemotherapy[J]. Int J Clin Pharm,2014, 36(2):287-290.
[11]孙志丹,高 博,许世伟. 奥沙利铂联合卡培他滨用于结直肠癌的药学监护[J]. 中国医院药学杂志.2014,34(14):1224-1226.
[12]Liekweg A, Westfeld M, Braun M, et al. Pharmaceutical care for patients with breast and ovarian cancer[J]. Support Care Cancer,2012,20(11):2669-2677.
[13]Wong SF, Bounthavong M, Nguyen C, et al. Implementation and preliminary outcomes of a comprehensive oral chemotherapy management clinic[J]. Am J Health Syst Pharm.,2014,71(11):960-965.
Effects of Pharmaceutical Intervention on Quality of Life in Gastric Cancer Patients*
Liu Yang1, You Zhenyu1△, Su Xiaohui2, et al
(1.DepartmentofOncology, 202HospitalofthePLA,Shenyang110003,Liaoning,China;2.DepartmentofGastricSurgery,LiaoningProvincialTumourHospital,Shenyang110003,Liaoning,China)
Objective: To observe the effects of pharmaceutical intervention on quality of life in gastric cancer patients undergoing chemotherapy. Methods: One hundred and seventy-eight postoperative gastric cancer patients receiving chemotherapy in our institution between March 2012 and March 2014 were assigned into two groups randomly: intervention group(n=89;receiving chemotherapy plus pharmaceutical intervention) and control group(n=89;receiving chemotherapy only). The clinical pharmacists carried out pharmaceutical interventions according to the reaction of the medicines for the treatment of gastrointestinal symptoms during chemotherapy. The pharmacentical intervation included the communication with clinical doctors, optimizing the treatment plan and instruction for clinical medication. The gastrointestinal reactions during chemotherapy and the quality of life in two groups were observed. Results: The complete relief rates of the intervention group to the antemetics were 53.9%, 61.8% and 64.0% in the first three cycle; those of the control group were 32.6%, 43.8% and 46.1%,respectively. The difference was statistically significant between the two groups(P=0.004,P=0.016,P=0.016). The symptoms assessment of acute and delayed nausea in the intervention group were statistically lower than those in the control group(P=0.032,P=0.029). The symptoms assessment of acute and delayed vomiting in the intervention group were statistically lower than those in the control group(P=0.020,P=0.031). Quality of life evaluation showed that global health status score in the intervention group was higher than that in the control group(P=0.022), while the symptom scores in terms of loss of appetite and vomiting/nausea were lower than those in the control group (P=0.021,P=0.018). Conclusion: Pharmaceutical interventions can not only alleviate symptoms including nausea and vomiting but also improve the quality of life for gastric cancer patients who receive chemotherapy.
Pharmaceutical Intervention; Gastric Cancer; Chemotherapy; Quality of Life
2015- 05- 26
2015- 11- 16
*辽宁省科学技术计划项目(编号2013225089)
刘 洋(1971-),男,博士,主治医师,主要研究方向:肿瘤临床治疗研究。
△尤振宇,副主任医师,E-mail:yzy202nyk@163.com
R732.3;R730.9
A
10.3969/j.issn.1674- 0904.2016.01.006
•临床经验与技术交流•

