西妥昔单抗联合适形调强放疗和化疗治疗鼻咽癌的临床分析
罗杨坤, 杨桄权, 郎锦义
(四川省肿瘤医院放疗中心, 成都 610041)
西妥昔单抗联合适形调强放疗和化疗治疗鼻咽癌的临床分析
罗杨坤, 杨桄权, 郎锦义△
(四川省肿瘤医院放疗中心, 成都 610041)
目的:分析西妥昔单抗联合适形调强放疗和化疗治疗鼻咽癌的临床疗效,毒性反应和预后因素。方法: 纳入2006年3月至2011年3月在我院初治,无远处转移的Ⅱ~Ⅳ期鼻咽癌共72例。西妥昔单抗初始剂量为400 mg/m2,之后为每周250 mg/m2。所有患者接受适形调强放疗,接受诱导和/或同步化疗。结果: 中位随访60.5月(5~110月)。全组患者3年、5年无局部区域复发生存率(local regional recurrence-free survival,LRRFS)、无远处转移生存率(distant metastasis free-survival ,DMFS)、无进展生存率(progression-free survival,PFS);总生存率(overall survival,OS)分别为86.1%,75.4%;79.2%,67.9%;77.8%,66.7%和88.9%,76.7%。Ⅱ~Ⅲ期和Ⅳ期患者的5年PFS及OS分别为83.3%,97.1% 和51.7%,58.3%。4例患者出现局部区域复发,共有17例患者出现远处转移。死亡14例患者中8例死于单纯远处转移。单因素分析显示肿瘤分期为PFS和OS的预后因素(P=0.0146,P=0.0021)。分别有62.5%和4.2%患者发生3和4级口腔粘膜炎。14例患者出现颞叶损伤。结论: 西妥昔单抗联合IMRT加化疗治疗鼻咽癌的临床疗效较好,毒性反应可耐受。值得扩大样本量以及开展前瞻性随机对照试验进一步研究。
鼻咽癌; 西妥昔单抗; 适形调强放疗; 临床疗效; 预后因素
放疗是鼻咽癌(nasopharyngeal carcinoma,NPC)治疗的主要手段。早期NPC单纯放疗的5年总生存率约90%[1]。局部晚期鼻咽癌的标准治疗是同步放化疗[2]。适形调强放疗(intensity-modulated radiotherapy,IMRT)为基础的放化疗方案[3-6]显示出较高的局部控制率,但总生存率尤其是远处转移的控制仍不理想。因此减少远处转移并提高总生存率需要更有效的综合治疗方案。表皮因子受体(epidermal growth factor receptor,EGFR)在80%的局部晚期鼻咽癌患者中过表达并提示预后较差[7]。西妥昔单抗是一种免疫球蛋白IgG1 的人源化嵌合EGFR单抗,作用于EGFR链接域的细胞膜外区。复发转移或初治鼻咽癌的研究显示西妥昔单抗联合放化疗取得了良好的临床疗效[8-9]。但也有头颈部癌研究显示加入西妥昔单抗并不提高长期控制率[10-11]。而西妥昔单抗加放化疗明显增加3~4级口腔粘膜炎发生率。所以,付出增加副作用的代价,加入西妥昔单抗提高疗效尚不明确。本研究回顾我院72例鼻咽癌患者接受西妥昔单抗联合放化疗治疗的临床资料,分析其疗效,毒性反应以及预后因素。
1 材料与方法
1.1 临床资料
纳入2006年3月至2011年3月在我院初治的,无远处转移的Ⅱ~Ⅳ期鼻咽癌共72例患者。治疗前辅助检查包括:血常规及生化,鼻咽纤维镜,头颈部MRI,胸部CT或胸片,腹盆B超,骨扫描。所有患者均经病理学证实。分期根据AJCC2010版确定。患者临床特点总结于表1。

表1 鼻咽癌患者的临床资料(n=72例)
(转右表)
(接左表)
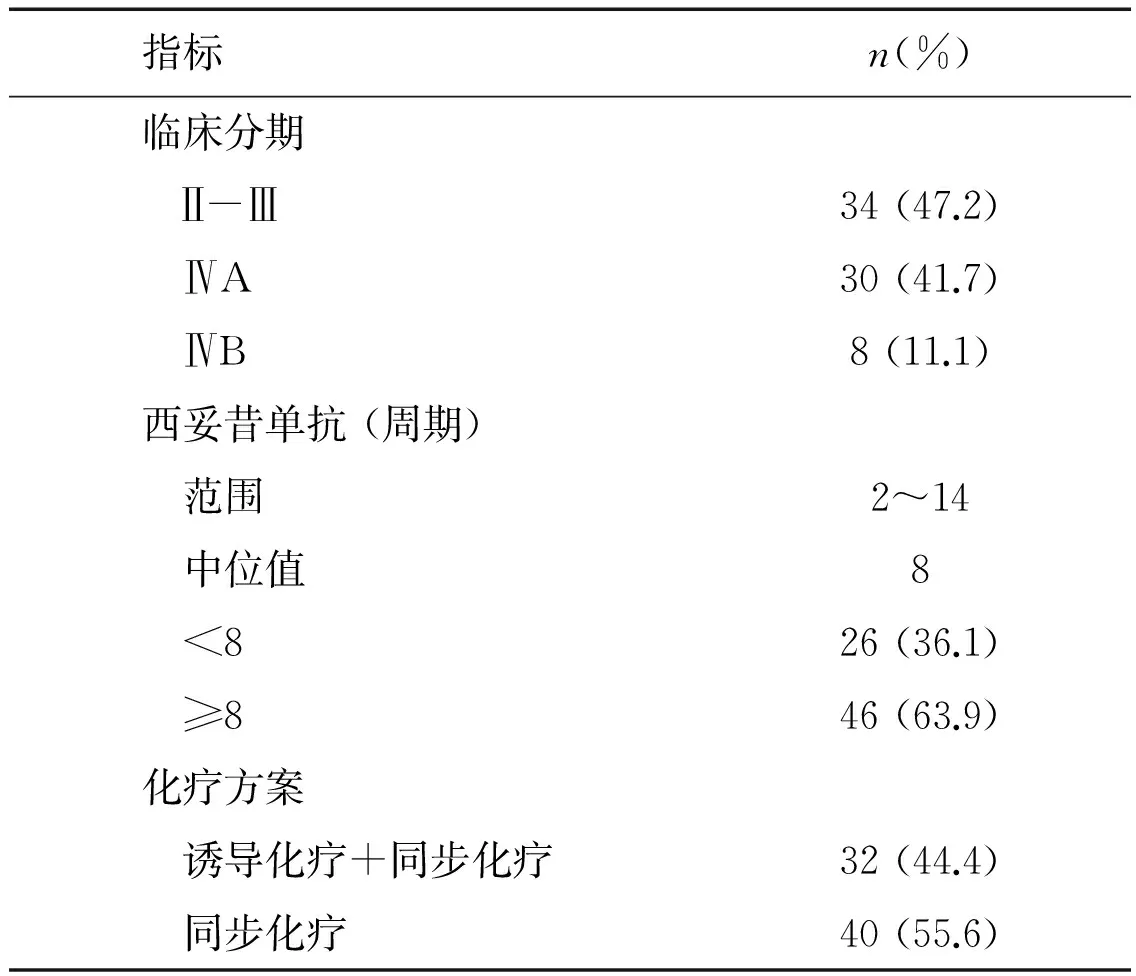
指标n(%)临床分期 Ⅱ-Ⅲ34(47.2) ⅣA30(41.7) ⅣB8(11.1)西妥昔单抗(周期) 范围2~14 中位值8 <826(36.1) ≥846(63.9)化疗方案 诱导化疗+同步化疗32(44.4) 同步化疗40(55.6)
1.2 治疗方案
1.2.1 放疗 所有患者均接受适形调强放疗。GTVnx及阳性淋巴结GTVL/R勾画以CT和或MRI为基础。高危亚临床靶区(CTV1)包括GTVnx外扩5~10mm范围以及高危区域。低危亚临床靶区(CTV2)包括可能侵犯的区域:整个鼻咽部,上颌窦,翼腭窝,后组筛窦,咽旁间隙,颅底,斜坡前1/3,蝶窦底部,海绵窦等。CTVln包括淋巴结引流区域(双侧咽后淋巴结及Ⅱ,Ⅲ,VA区)。剂量:GTVnx:66~76Gy;GTVL/R: 60~70Gy;CTV1: 60~66Gy;CTV2: 54~60Gy;CTVln: 50~54Gy,采用同步加量的方法。下颈淋巴结引流区采用60Co或者6 MV X线照射,剂量46~50Gy。照射30~33次,每天1次,每周5次。
1.2.2 化疗及西妥昔单抗治疗 化疗包括诱导+同步化疗或同步化疗。所有患者均接受顺铂为基础的化疗方案,均未接受辅助化疗。诱导化疗方案包括1~2周期的TP方案 (多西他赛 60 mg/m2/d, d1,顺铂30mg/m2·d-1,d1- 3)或PF方案(顺铂30mg/m2·d-1,d1- 3+5-fu 750mg/m2·d-1, d1- 5)。同步化疗行2~3周期化疗,方案包括单铂方案(顺铂80mg/m2,d 1, 3周1疗程)、TP及PF方案,TP及PF方案同诱导化疗方案。西妥昔单抗初始剂量为400mg/m2,于放疗或者诱导化疗开始使用。之后剂量为每周250mg/m2。全组患者接受中位值为8周期的西妥昔单抗的治疗(2~14周期)。治疗过程中密切监测血象,白细胞<3.0×109/L时使用粒细胞集落刺激因子。血小板<20×109/L时予血小板输注并予以白细胞介素11 或促血小板生成素药物治疗。当中性粒细胞值≤ 0.5×109/l时,放疗及化疗推迟并给予粒细胞集落刺激因子治疗。当出现粒细胞减少性发热时候,使用抗生素。治疗中丙氨酸转氨酶恢复后才开始继续化疗。对于发生过4级血液毒性的患者,下周期化疗剂量减少25%。当出现4级口腔黏膜炎时放疗和西妥昔单抗治疗暂停,当降低1级毒性后才恢复放疗和西妥昔单抗治疗。对于出现4级痤疮样皮疹患者,西妥昔单抗停止并不再继续使用。对于2~3级的痤疮样皮疹则使用芦荟液洗漱,类固醇软膏或抗组胺药物处理。
1.3 随访及统计学方法
治疗毒性采用[National Cancer Institute Common toxicity criteria (NCI-CTC)]3.0版,放疗相关毒性采用[Radiation Therapy Oncology Group(RTOG)]标准。所有患者治疗中每周进行评估。治疗结束后进行随访:放疗后1月,放疗后2年内每3个月,放疗后3~5年每6个月,之后每年随访1次。随访内容包括鼻咽纤维镜,腹部B超,胸片,血常规及生化;CT或MRI,骨扫描。局部复发由鼻咽纤维镜及活检证实,区域复发由细针穿刺病理证实或者MRI证实复发。远处转移由临床症状,体检和影像学方法证实。采用SPSS 16.0进行统计分析。生存率均从治疗第一天开始计算。Kaplan-Meier法计算局部无复发生存率(local regional recurrence-free survival,LRRFS),远处转移生存率(distant metastasis-free survival,DMFS), 无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)。单因素分析采用log-rank test。P<0.05为差异具有统计学意义。
2 结 果
2.1 生存情况
中位随访60.5月(5~110月),全组患者3年,5年LRRFS,DMFS,PFS,OS分别为86.1%,75.4%;79.2%,67.9%;77.8%,66.7%和88.9%,76.7%(图1)。肿瘤临床分期为Ⅱ~Ⅲ和Ⅳ期的5年PFS为83.3%和51.7%;5年OS分别为97.1%和58.3%(图2;表2)。全组共有19例失败,包括15例单纯远处转移,1例单纯局部复发,1例局部合并区域复发,1例局部复发合并远处转移,1例区域复发合并远处转移。14例患者死亡,1例死于鼻咽部大出血,2例死于未知内科疾病,1例死于脑梗塞合并内科疾病,1例死于局部复发,1例死于局部复发合并远处转移,共有8例死于远处转移。
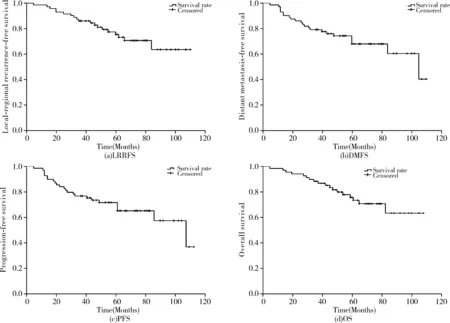
图1 72例鼻咽癌患者的LRRFS(a);DMFS(b);PFS(c);OS(d)

图2 Ⅱ~Ⅲ期和Ⅳ期患者的PFS曲线和OS曲线
2.2 预后因素
将年龄、性别、T分期、N分期、临床分期、西妥昔单抗使用周期数、化疗方案等采用log-rank test进行单因素分析,显示临床分期是PFS和OS的预后因素(HR=3.04, 95%CI 1.25~7.41,P=0.0146;HR=10.36, 95%CI 2.34~45.83,P=0.0021)。详见表2。
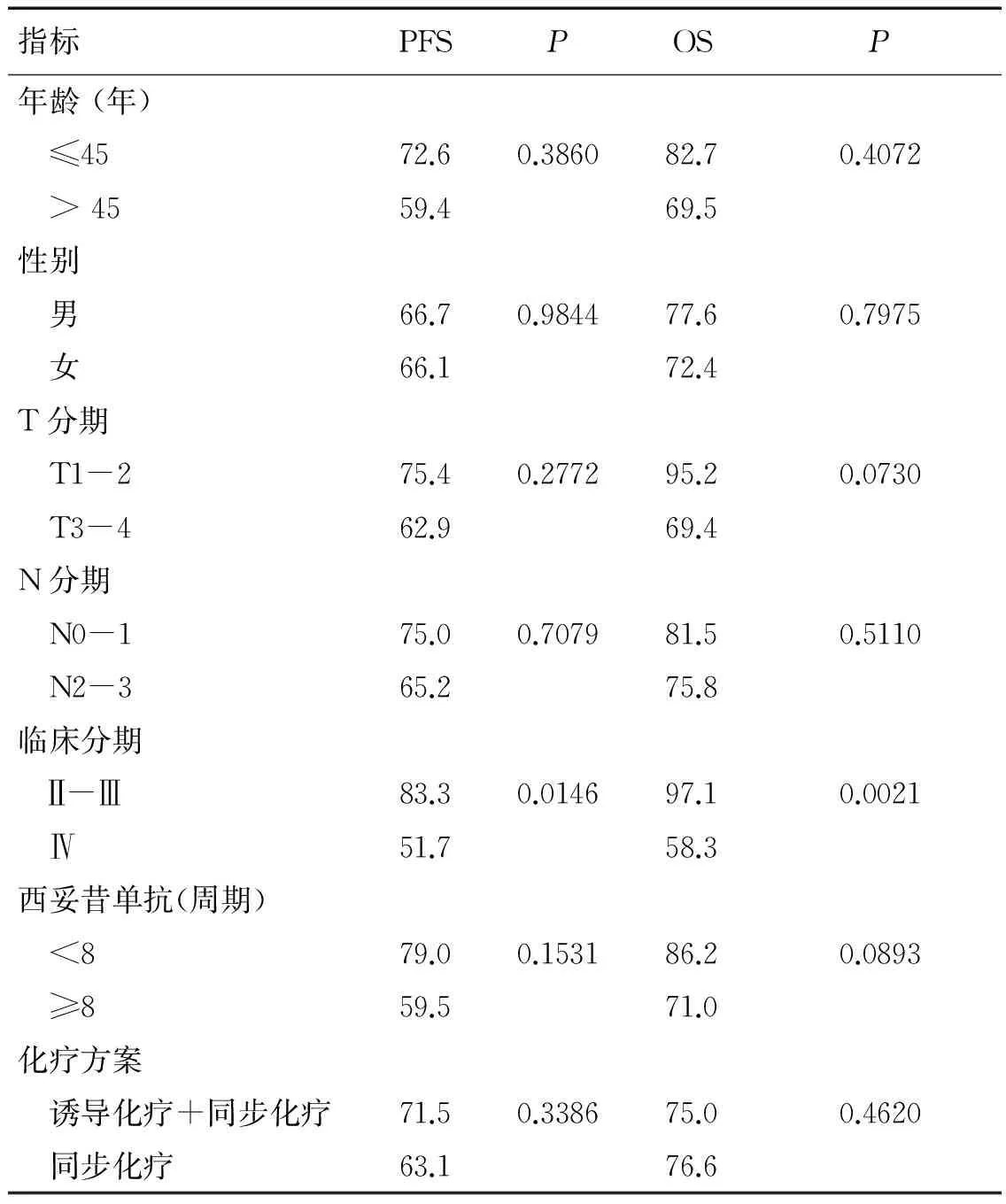
表2 72例鼻咽癌PFS和OS的单因素分析
2.3 毒性反应
64例患者出现不同程度的痤疮样皮疹,12例出现3级反应,2例出现4级反应。1~2级口腔黏膜炎发生率为33.3%,3及4级分别为62.5%和4.2%。4级急性毒性还包括白细胞减少症(9.7%);皮炎(2.8%)。其他3级反应包括血小板减少症(13.9%),口干(9.7%),吞咽困难(43.1%)等。以上急性毒性反应经积极处理均可控可逆。无5级毒性反应发生。口干为最常见的晚期毒性反应,19.4%患者出现1级口干,2.7%患者出现2级口干。5.6%患者出现1级吞咽困难。14例患者出现颞叶损伤,T2期1例,T3期5例,T4期8例。分别有8例和2例患者出现1和2级记忆力减退,1例患者出现情绪改变。治疗相关急性毒性见表3。

表3 治疗急性毒性反应(%)
3 讨 论
EGFR属于细胞表面HER/Eerb受体酪氨酸激酶家族,配体为表皮生长因子,转化生长因子等,与其结合磷酸化后激活信号通路如PI3K/AKT,MAPK、STAT等,调节细胞生长、死亡、永生化等多种细胞生理过程。EGFR在80%的局部晚期鼻咽癌患者中过表达,是重要的预后因子[7]。西妥昔单抗是免疫球蛋白IgG1 的人源化嵌合单抗,竞争性抑制EGFR 与其配体的结合,阻断受体相关酶磷酸化,阻断下游信号通路活化,如抑制细胞生长、诱导凋亡、产生G1期阻滞等达到抗肿瘤目的[12-13]。既往研究显示西妥昔单抗能提高局部晚期头颈部鳞癌的生存率并具有较好的耐受性[8,14-15]。2006年美国FDA批准西妥昔单抗联合放疗治疗局部晚期或转移性头颈部鳞癌[16]。但既往研究多集中于头颈部鳞癌,以鼻咽癌根治性治疗为目的的研究较少。本研究回顾性分析了初治鼻咽癌接受西妥昔单抗联合根治性放化疗的疗效,结果显示全组患者3年LRRFS,DMFS,PFS,OS分别为86.1%,79.2%,77.8%和88.9%;5年LRRFS,DMFS,PFS,OS分别为75.4%,67.9%,66.7%和76.7%。Niu等[17]研究显示3年PFS, DMFS, OS分别为70.5%, 83.6%, 90.9%。ENCORE试验[9]显示5年OS, 无病生存率(disease-free survival,DFS),无复发生存率(relapse-free survival,RFS), 和DMFS分别为82.1%, 69.0%, 74.9% 和 75.2%。尽管无法直接比较,但以上结果可以看出,本研究3年生存指标与Niu等[17]研究相似,而DMFS和OS比ENCORE试验略低,这可能与本研究纳入病例分期偏晚相关。ENCORE试验纳入Ⅲ,ⅣA,ⅣB期分别为71%,22%,9%;本研究中Ⅲ,ⅣA,ⅣB期为43%,41.7%,11.1%。T3~4期为70.8%,N2~3期为83.3%。共有15例出现单纯远处转移,占失败模式的78.9%。死亡14例患者中有8例死于单纯远处转移。该结果显示远处转移仍是主要失败模式,与目前多数IMRT联合化疗的研究结果类似[3-6,18]。IMRT联合化疗已经可以获得较高的局部区域控制率,西妥昔单抗的加入能否改变这种失败模式,尚需要扩大样本以及开展前瞻性随机对照试验进一步研究。
Niu等[17]研究显示是否达到CR是PFS的预后因素,临床分期和西妥昔周期数与PFS有相关趋势。接受≥7周期与<7周期西妥昔单抗的3年PFS分别为79.1%和 31.2 %。而本研究显示接受≥8周期与<8周期西妥昔单抗的5年PFS分别为59.5%和79.0(P=0.1531),5年OS分别为71.0%和86.2%(P=0.0893);尽管差异不具有统计学意义,但该趋势与Niu等[17]研究结果相反。这可能与均是回顾性研究,样本量较小,选择性偏倚相关。但一项[10]以西妥昔单抗为维持辅助治疗的研究结果显示12个周期的西妥昔维持治疗在治疗后第二年后并未显示出提高疗效,单用西妥昔单抗不足以杀灭微转移灶。此外,长疗程西妥昔单抗的使用是否导致患者免疫力下降,机体抗肿瘤效应减弱也可能是原因。ENCORE试验[9]显示临床分期在OS和RFS中无显著性差异,提示不论分期西妥昔单抗均能获得较好疗效。而本研究结果显示临床分期为PFS和OS的预后因素(P=0.0146;P=0.0021)。鼻咽癌临床分期定义为Ⅲ到Ⅳ期包含数种T和N的组合,在诱导或辅助化疗尚未取得明确地位以至于需要寻找可能获益的亚分组的情况下,西妥昔单抗在局部晚期鼻咽癌中的使用尚需大样本,前瞻性,随机对照临床试验以明确其获益人群。
痤疮样皮疹是西妥昔单抗常见的副作用。使用西妥昔单抗3周期后比较明显,在疗程第4~5周达到顶峰,结束4周后逐渐消退。本研究显示任何程度的痤疮样皮疹毒性总发生率为88.9%。但大多为1~2级(69.4%),3级为16.7%,有2例(2.8%)出现4级毒性反应。与既往研究结果类似[19-20]。口腔黏膜炎是最常见的放疗急性毒性反应。本研究结果显示3级及4级口腔黏膜炎的发生率分别为为62.5%及4.2%。较头颈部鳞癌研究结果的发生率高[20-22],而与同样以中国人群,鼻咽癌为研究对象的研究结果相似[18,23]。鼻咽癌放疗靶区设置由于解剖位置的原因,其射野包括较大部分口腔粘膜受到照射,导致口腔黏膜炎发生率较高。因此,寻找有效防治黏膜炎的治疗方法就尤为重要。Koukourakis等[24]使用西妥昔单抗联合同期放化疗加用阿米福汀,仅16.2%患者出现≥3 级口腔黏膜炎。Lang等[25]使用康复新液预防治疗鼻咽癌放化疗所致口腔黏膜炎的3期临床试验结果显示康复新能显著减少口腔粘膜炎发生率和程度,延迟重度粘膜炎出现时间。伴随着西妥昔单抗在临床上的使用,寻找更有效的减轻毒性反应的治疗方法是今后的研究课题。
本研究结果显示14例患者(19.4%)出现颞叶损伤,T2、T3和T4期发生损伤的例数分别为1、5和8例。Niu等[17]研究显示颞叶坏死发生率为21.2%,并与T分期相关。ENCORE试验[9]结果显示放射性脑病的发生率为10%。本研究以T3、T4期为发生颞叶损伤的主要人群与Niu等研究类似。由于鼻咽临近颅底,本研究中T晚期患者居多,颞叶不可避免受到较高剂量照射;以及2.2~2.3Gy分次照射剂量。这些因素都可能导致颞叶损伤率较高。因此,对于T分期偏晚的鼻咽癌,西妥昔单抗联合放化疗的脑损伤防治值得进一步研究。
本研究具有以下缺点,包括回顾性研究的本质以及较小的样本量。医疗数据以及影像资料的问题导致一些具有潜在可能的预后因素如治疗后消退情况,肿瘤亚结构侵犯情况,化疗药物等未被纳入研究,均会影响本研究的结果。因此,本研究结果需要进一步研究确定并需要考虑到这些可能的影响因素。
综上,本研究结果显示西妥昔单抗联合IMRT加化疗治疗鼻咽癌的临床疗效较好,毒性反应可耐受。值得扩大样本量以及开展前瞻性随机对照试验进一步研究。另外减轻西妥昔单抗联合放化疗的毒性反应的研究也应该重视。
[1] Lee AWM, Sze WM, Au JSK, et al. Treatment results for nasopharyngeal carcinoma in the modern era: the Hong Kong experience[J]. Int J Radiat Oncol Biol Phys, 2005,61(4):1107-1116.
[2] Chan AT,Leung SF,Ngan RK,et al.Overall survival after concurrent cisplatin-radiotherapy compared with radiotherapy alone in locoregionally advanced nasopharyngeal carcinoma[J].J Natl Cancer Inst,2005,97(7):536-539.
[3] Kam MK, Teo PM. Treatment of nasopharyngeal carcinoma with intensity-modulated radiotherapy: the Hong Kong experience[J]. Int J Radiat Oncol Biol Phys,2004,60(5):1440-1450.
[4] Lee N, Harris J, Garden AS,et al. Intensity modulated radiation therapy with or without chemotherapy for nasopharyngeal carcinoma: radiation therapy oncology group phase Ⅱ trial 0225[J]. J Clin Oncol,2009,27(22):3684-3690.
[5] Chen L, Hu CS, Chen XZ, et al. Concurrent chemoradiotherapy plus adjuvant chemotherapy versus concurrent chemoradiotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma: a phase 3 multicentre randomised controlled trial[J]. Lancet Oncol,2012,13(2):163-171.
[6] Fountzilas G, Ciuleanu E, Bobos M,et al.Induction chemotherapy followed by concomitant radiotherapy and weekly cisplatin versus the same concomitant chemoradiotherapy in patients with nasopharyngeal carcinoma: a randomized phase Ⅱ study conducted by the Hellenic Cooperative Oncology Group (HeCOG) with biomarker evaluation[J]. Ann Oncol,2012,23(2):427-435.
[7] Bentzen SM, Atasoy BM, Daley FM ,et al. Epidermal growth factor receptor expression in pretreatment biopsies from head and neck squamous cell carcinoma as a predictive factor for a benefit from accelerated radiation therapy in a randomized controlled trial[J].J Clin Oncol,2005,23(24):5560-5567.
[8] Chan AT, Hsu MM, Goh BC ,et al.Multicenter, phase Ⅱ study of cetuximab in combination with carboplatin in patients with recurrent or metastatic nasopharyngeal carcinoma[J].J Clin Oncol,2005,23(15):3568-3576.
[9] Chen C, Zhao C, Gao L,et al. Long-term result of a multicenter clinical study of cetuximab combined with intensity modulated radiotherapy (IMRT) plus concurrent chemotherapy in locoregionally advanced nasopharyngeal carcinoma (NPC) [J]. J Clin Oncol,2015,33:suppl;abstr e17020.
[10]MesíaR,RuedaA,VeraR,et al.Adjuvant therapy with cetuximab for locally advanced squamous cell carcinoma of the oropharynx:results from a radomized,phase Ⅱ prospective trail[J]. Ann Oncol,2013,24(2):448-453.
[11]Ang KK,Zhang Q,Rosenthal DI,et al.Randomized phase Ⅲ trial of concurrent accelerated radiation plus cisplatin with or without cetuximab for stage Ⅲ to Ⅳ head and neck carcinoma: RTOG 0522[J]. J Clin Oncol,2014,32(27):2940-2950.
[12]Sung FL,Poon TC,Hui EP,et al.Antitumor effect and enhancement of eytotoxic drug activity by cetuximab in nasopharyngeal carcinoma cells[J].In Vivo,2005,19( 1): 237-245.
[13]Huang SM, Bock JM, Harari PM.Epidermal growth factor receptor blockade with C225 modulates proliferation, apoptosis, and radiosensitivity in squamous cell carcinomas of the head and neck[J].Cancer Res,1999,598:1935-1940.
[14]Bonner JA, Harari PM, Giralt J,et al.Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck[J]. N Engl J Med,2006,354(6):567-578.
[15]Bonner JA, Harari PM, Giralt J,et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab induced rash and survival[J]. Lancet Oncol,2010,11(1):21-28.
[16]Mehra R,Cohen RB,Burtness BA.The role of cetuximab for the treatment of squamous cell carcinoma of the head and neck[J].Clin Adv Hematol Oncol,2008,6( 10): 742-750.
[17]Niu X,Hu C,Kong L.Experience with combination of cetuximab plus intensity-modulated radiotherapy with or without chemotherapy for locoregionally advanced nasopharyngeal carcinoma[J]. J Cancer Res Clin Oncol,2013,139(6):1063-1071.
[18]Sun X, Su S, Chen C, et al. Long-term outcomes of intensity-modulated radiotherapy for 868 patients with nasopharyngeal carcinoma: an analysis of survival and treatment toxicities[J]. Radiother Oncol,2014,110(3):398-403.
[19]Burtness B, Goldwasser MA, Flood W,et al. Eastern Cooperative Oncology Group. Phase Ⅲ randomized trial of cisplatin plus placebo compared with cisplatin plus cetuximab in metastatic/ recurrent head and neck cancer: an Eastern Cooperative Oncology Group study[J].J Clin Oncol,2005,23(34):8646-8654.
[20]Pfister DG, Su YB, Kraus DH,et al. Concurrent cetuximab, cisplatin, and concomitant boost radiotherapy for locoregionally advanced, squamous cell head and neck cancer: a pilot phase Ⅱ study of a new combined-modality paradigm[J]. J Clin Oncol,2006,24(7):1072-1078.
[21]Argiris A, Heron DE, Smith RP,et al. Induction docetaxel, cisplatin, and cetuximab followed by concurrent radiotherapy, cisplatin, and cetuximab and maintenance cetuximab in patients with locally advanced head and neck cancer[J]. J Clin Oncol,2010,28(36):5294-5300.
[22]Koutcher LD, Wolden S, Lee N. Severe radiation dermatitis in patients with locally advanced head and neck cancer treated with concurrent radiation and cetuximab[J].Am J Clin Oncol,2009,32(5):472-476.
[23]Feng HX,Guo SP,Li GR,et al.Toxicity of concurrent chemoradiotherapy with cetuximab for locoregionally advanced nasopharyngeal carcinoma[J]. Med Oncol,2014, 31(9):170.
[24]Koukourakis MI,Tsoutsou PG,Karpouzis A,et al. Radiochemotherapy with cetuximab,cisplatin,and amifostine for locally advanced head and neck cancer:a feasibility study [J].Int J Radiat Oncol Biol Phys,2010,77(1):9-15.
[25]Lang JY, Feng M, Luo Y,et al. The phase Ⅲ clinical study about the effect of Kangfuxin Solution (Chinese herbal medicine compound preparation) on the radiation induced oral and upper gastrointestinal mucositis in nasopharyngeal carcinoma patients. J Clin Oncol,2015,33:suppl;abstr 6057.
Clinical Outcomes and Prognostic Factors of Cetuximab plus Intensity-modulated Radiotherapy (IMRT) with Chemotherapy for Nasopharyngeal Carcinoma
Luo Yangkun, Yang Guangquan, Lang Jinyi△
(Department of Radiation Oncology, Sichuan Cancer Hospital, Chengdu 610041, Sichuan, China)
Objective: To evaluate the clinical outcomes, toxicities and prognostic factors of cetuximab plus intensity-modulated radiotherapy (IMRT) with chemotherapy for nasopharyngeal carcinoma(NPC). Methods: From March 2006 to March 2011, 72 patients with stage Ⅱ~ Ⅳ NPC without distant metastasis were included in our study. Cetuximab was administered at an initial dose of 400 mg/m2followed by weekly doses of 250 mg/m2. All patients received IMRT plus induction and/or concurrent chemotherapy. Results: With a median follow-up of 60.5 months(5~110 months), the 3,5-year locoregional recurrence-free survival (LRRFS), distant metastasis free survival(DMFS), progression-free survival (PFS) and overall survival(OS) were 86.1%,75.4%;79.2%,67.9%;77.8%,66.7% and 88.9%,76.7%,respectively. The 5-year PFS and OS were 83.3% and 97.1% for stage Ⅱ~Ⅲ patients compared with 51.7% and 58.3% for stage Ⅳ patients. Four patients experienced locoregional failure and distant metastasis occurred in 17 patients.Fourteen patients died,among them, 8 died of distant metastasis. Tumor stage was a significant prognostic factor for PFS and OS(P=0.0146;P=0.0021). Grade 3 and 4 oral mucositis were found in 62.5% and 4.2% patients, respectively. Temporal lobe injure was observed in 14 patients. Conclusion: Cetuximab plus IMRT with chemotherapy for NPC is effective and the adverse events are acceptable. Prospective randomized controlled trials with larger sample size are expected in the future.
Nasopharyngeal Carcinoma; Cetuximab; Intensity-modulated Radiotherapy; Clinical Outcome; Prognostic Factors
2015- 11- 24
2016- 02- 06
罗杨坤(1979-),四川南充人,硕士,主治医师,从事肿瘤放疗。
△郎锦义,教授,博士研究生导师,E-mail:langjy610@163.com
R739.63;R730.5
A
10.3969/j.issn.1674- 0904.2016.01.004

