过表达Numb基因对人膀胱癌5637细胞周期和增殖的影响*
司马晋, 张 保△, 艾 青, 王保军, 马 鑫 , 张 旭
(1.航天中心医院泌尿外科, 北京 100049; 2.解放军总医院泌尿疾病重点实验室, 北京 100053)
过表达Numb基因对人膀胱癌5637细胞周期和增殖的影响*
司马晋1, 张 保1△, 艾 青2, 王保军2, 马 鑫2, 张 旭2
(1.航天中心医院泌尿外科, 北京 100049; 2.解放军总医院泌尿疾病重点实验室, 北京 100053)
目的:探讨Numb基因对人膀胱癌细胞周期和增殖能力的影响及相关机制。方法: 选取人膀胱癌细胞5637为研究对象,采用Numb-ORF表达质粒转染细胞为实验组,设置阴性对照和空白对照组。采用荧光定量聚合酶链式反应和蛋白质印迹技术检测各组中Numb基因和细胞周期蛋白D1(Cyclin D1)的表达;采用流式细胞技术检测各组的细胞周期;采用酶标仪检测细胞在490nm的吸光度值,评价各组细胞的增殖活力。结果: 实验组Numb的△CT值为1.58±0.41,阴性对照组为5.66±0.53,空白对照组为5.81±0.47,差异有统计学意义(F=77.39,P=0.00);实验组Cyclin D1的△CT值为4.92±0.73,阴性对照组为2.59±0.33,空白对照组为2.45±0.26,差异有统计学意义(F=11.70,P=0.01)。实验组中G0/G1期细胞的比例(%)为49.76±7.07,明显高于阴性对照组的36.52±3.32和空白对照组的38.21±2.06,差异有统计学意义(F=7.17,P=0.03)。增殖实验中,实验组24 h的吸光度值为0.35±0.08,明显低于阴性对照组0.52±0.06和空白对照组0.55±0.04(F=9.03,P=0.02)。 结论: Numb基因可以提高G0/G1期细胞比例,抑制膀胱癌细胞增殖,其机制可能是通过抑制Cyclin D1表达实现。
膀胱肿瘤; Numb基因; 细胞周期蛋白D1
膀胱癌是泌尿外科常见的恶性肿瘤,病理类型以尿路上皮癌最常见,近年来膀胱癌的发病率逐年升高[1-2]。肿瘤的发生发展是一个多因素多阶段的过程,包括抑癌基因失活、癌基因活化以及细胞生物学功能的异常改变,在各种细胞生物学功能的变化中,细胞周期紊乱所致的异常细胞增殖是恶性肿瘤的共同特点[3-4]。Numb基因是新近发现的细胞命运决定因子,参与了多种人类肿瘤的发生发展[5-6]。本课题组前期研究发现Numb基因上调可以降低膀胱癌细胞的侵袭和迁移能力[1]。本研究中我们将在前期基础上,使用质粒转染技术上调膀胱癌细胞中Numb基因的表达,检测细胞周期和细胞增殖的变化,以及对细胞周期素D1(Cyclin D1)表达的影响,探讨Numb基因在膀胱癌细胞周期和增殖中的作用及可能的相关机制。
1 材料和方法
1.1 细胞培养
人膀胱癌细胞5637由北京大学航天临床医学院实验室保存。使用含10%胎牛血清的RPMI-1640培养基(美国Gibco公司),37℃常规培养。取对数生长期细胞实验。
1.2 分组与处理
Numb-ORF表达质粒、空载体pCMV6-Entry和转染试剂Mega Tran 1.0购自美国Origene公司。实验分为三组:实验组(转染Numb-ORF)、阴性对照组(转染空载体)和空白对照组。具体操作见前期文献[1,7]。转染后48h收集细胞进行实验。
1.3 检测目的基因表达
使用ABI- 7500荧光定量聚合酶链式反应(PCR)仪检测目的基因的mRNA表达:以PPIA (peptidylprolyl isomerase A)为内参,采用相对定量比较CT值法分析数据[8]。Numb的上游引物:5’-CTTTTACAAGAGAAGGATCATTCCG-3’,下游引物:5’-CAACGACTATCTTATCTGTTTCAGC-3’;Cyclin D1的上游引物:5’-CCCTCGGTGTCCTACTTCAA- 3’,下游引物:5’-AGGAAGCGGTCCAGGTAGTT- 3’;PPIA的上游引物:5’-ATGGTCAACCCCACCGTGT- 3’,下游引物:5’-TCTGCTGTCTTTGGGACC TTGTC- 3’。使用蛋白质印迹检测各目的基因蛋白质表达强度,Numb、Cyclin D1和内参甘油醛-3-磷酸脱氢酶(GAPDH)的一抗购自英国Abcam公司,按1 ∶1 000稀释后使用。二抗购自北京中杉金桥公司,按1 ∶2 000稀释后加入,具体操作步骤参照文献[1,7]。
1.4 检测细胞周期
收集各组细胞,以70%乙醇固定12小时,加入1毫升碘化丙啶染色液(上海碧云天公司)染色后流式细胞仪检测,并计算增殖指数(proliferation index,PI)=(G2/M+S)/(G0/G1+S+G2/M),实验独立重复3次。
1.5 检测细胞增殖能力
实验前在96孔板中以2 000个细胞/孔密度铺板,检测时每孔加入MTS试剂(美国Promega公司)20μl,37℃孵育1小时后酶标仪检测490nm吸光度值(A490),比较三组的细胞活力,实验独立重复3次。
1.6 统计学分析
2 结 果
2.1 各组中Numb基因的表达水平
实验组的△CT值为1.58±0.41,阴性对照组为5.66±0.53,空白对照组为5.81±0.47,差异有统计学意义(F=77.39,P=0.00)。蛋白质印迹检测可见实验组Numb表达强度明显强于两对照组(图1),提示转染Numb-ORF质粒可以上调膀胱癌5637细胞中Numb的表达水平。

图1 蛋白印迹检测目的基因表达
2.2 各组中Cyclin D1的表达水平
实验组的△CT值为4.92±0.73,阴性对照组为2.59±0.33,空白对照组为2.45±0.26,差异有统计学意义(F=11.70,P=0.01)。根据PCR实验原理,循环数(CT值)越大则表示该基因的表达量越低。蛋白质印迹检测可见实验组中Cyclin D1的表达强度较对照组降低(图1)。
2.3 上调Numb表达对细胞周期的影响
流式细胞仪分析显示,实验组中G0/G1期细胞的比例(%)为49.76±7.07,明显高于阴性对照组的36.52±3.32和空白对照组的38.21±2.06,差异有统计学意义(F=7.17,P=0.03)。同时,实验组的S期细胞比例和增殖指数均降低(P<0.05,表1,图2)。这表明上调Numb基因可以增加G0/G1期细胞比例,减少S期细胞比例,降低细胞的增殖指数。
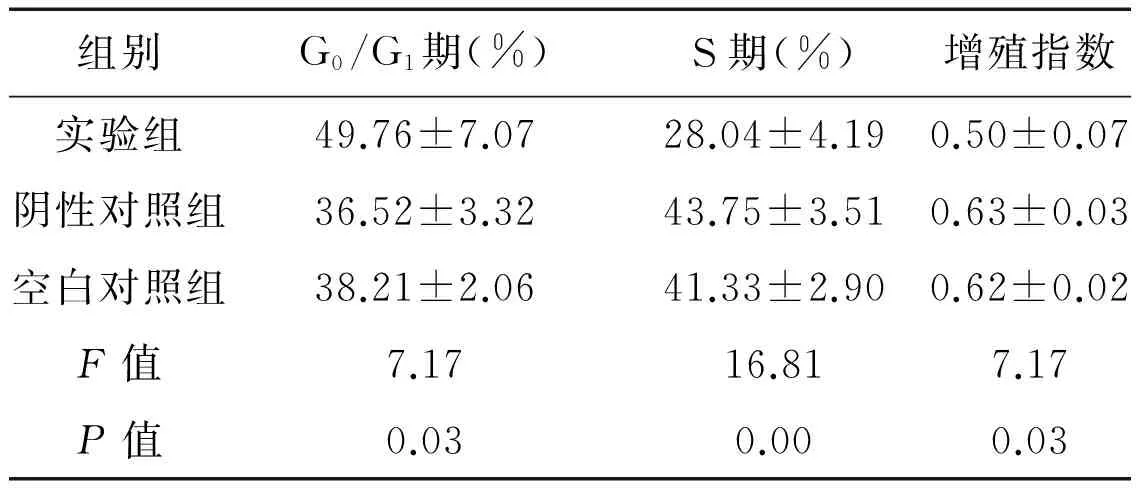
表1 流式细胞技术检测各组细胞
2.4 上调Numb表达对细胞增殖的影响
实验组在24 h的吸光度值为0.35±0.08,明显低于阴性对照组0.52±0.06和空白对照组0.55±0.04(F=9.03,P=0.02);同样,实验组在48 h和72 h的吸光度也明显低于两对照组,差异有统计学意义(P=0.01,表2)。根据MTS法的实验原理,在490nm的吸光度(A490)值与活细胞的数量呈线性关系,即A490值越大则代表的活细胞数量越多。这表明实验组的细胞增殖减弱。
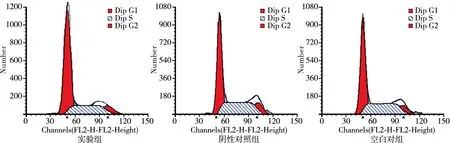
图2 流式细胞技术分析各组细胞周期分布图

组别0h24h48h72h实验组0.18±0.040.35±0.080.68±0.160.92±0.31阴性对照组0.16±0.030.52±0.061.24±0.232.02±0.36空白对照组0.17±0.020.55±0.041.38±0.181.96±0.27F值0.319.0311.1311.53P值0.740.020.010.01
3 讨 论
膀胱癌是泌尿外科常见的恶性肿瘤,发病率长期位居我国泌尿系统恶性肿瘤的首位[9-10]。近年来,随着社会工业化程度提高和环境污染等因素,膀胱癌的发病率仍在逐年提高[2]。临床上不同TNM分期的膀胱癌患者,预后差别很大[9-10]。在TNM分期中,T分期是衡量肿瘤体积大小的指标,而肿瘤的大小与肿瘤细胞的增殖能力是密切相关的。因此,研究Numb基因对膀胱癌细胞周期和增殖能力的影响,将有助于从分子水平认识膀胱癌发生发展的原因,有益于膀胱癌患者的临床治疗和预后。
现有研究表明,肿瘤的形成与进展是多因素交互的结果,基因学的改变在其中发挥了重要作用[11-12]。Numb基因是新近发现的肿瘤相关基因,广泛存在于从果蝇到哺乳动物及人类的各层级生物体内[1,6]。前期研究发现,Numb蛋白的不同表达强度决定了子代细胞不同的分化命运,因而Numb基因被定义为细胞命运决定因子[5]。目前已有多篇研究报道发现Numb基因的异常表达参与了人类肿瘤的发生发展。Rennstam等[13]利用免疫组化技术检测241例乳腺癌组织标本发现乳腺癌中Numb表达降低,并且减低程度与乳腺癌的侵袭性相关,提示Numb在乳腺癌中可能发挥抑癌因子作用。Wu等[14]对肝细胞癌中的Numb基因进行研究,发现在肝癌病理组织中Numb基因高表达,且高表达的Numb基因与患者的不良预后具有相关性,提示Numb基因在肝癌中可能发挥促癌作用。根据前期文献我们发现在不同类型的肿瘤中Numb基因的生物学作用不尽相同,有时作为抑癌因子,有时发挥促癌作用,因此Numb基因在膀胱癌中的作用尚须明确。本研究在前期工作基础上,通过Numb基因对人膀胱癌细胞周期和增殖能力的影响,进一步探讨Numb基因在人膀胱癌中的作用和相关机制。
恶性肿瘤共性的生物学特点是细胞周期紊乱所致的异常细胞增殖,同时细胞增殖强度也影响着肿瘤的大小和以此为依据的临床T分期[15]。Cyclin D1是一个负责细胞周期调控的重要蛋白质,其表达与细胞增殖密切相关[16]。生理情况下,Cyclin D1负责调控细胞由G1期进入S期;当Cyclin D1表达过量时,会促使G1期细胞向S期转化,缩短细胞周期,加速增殖,这也是肿瘤组织迅速生长的原因之一。Lima等[16]研究发现Cyclin D1在膀胱癌病理组织中表达升高,而且其表达量与肿瘤的大小、分期、分级等临床指标呈统计学相关性,降低Cyclin D1表达水平将有利于膀胱癌患者获得更好的预后转归。本研究中我们使用体外质粒转染技术,在膀胱癌5637细胞中过表达Numb基因,检测细胞周期和增殖活力的变化。我们发现过表达Numb基因可以促使膀胱癌细胞的G0/G1期比例升高,降低S期比例,抑制肿瘤细胞的G1/S期转化,减低细胞增殖指数。众所周知,S期是细胞DNA的合成期,是为细胞有丝分裂进行遗传物质准备的时期,处于S期细胞的比例降低意味着能够进行有丝分裂增殖的细胞减少[4]。在细胞增殖实验中我们也观察到,实验组细胞的增殖活力显著低于对照组。
为了进一步探讨Numb基因对膀胱癌细胞周期和增殖调控的可能机制,我们检测了与增殖相关的细胞周期蛋白 D1的表达,结果显示实验组中Cyclin D1的表达下降。Flores等报道了Numb基因可以与膜受体Notch信号相互作用,抑制Notch信号通道的活化及下游效应因子的表达[17]。我们前期在膀胱癌的研究中已证实:Notch信号的活性是通过介导细胞核转录因子Hes1从而向下传导影响下游的效应分子表达[10]。同时也有文献证实,Cyclin D1就是Notch信号通道下游的效应因子之一[18]。因此,综合这些间接证据我们可以推论Numb基因可抑制Notch信号通路的活化,受抑制的Notch信号可影响Cyclin D1的表达。由此我们预测Numb基因似乎是通过Notch信号通路途径抑制了Cyclin D1的表达,影响细胞周期和抑制细胞增殖,今后我们将继续研究证实这一观点。综上,本研究发现Numb基因可以负性调节Cyclin D1的表达促使膀胱癌细胞发生G0/G1期阻滞,抑制细胞增殖,提示Numb基因在膀胱癌中可能发挥抑癌基因作用,有可能成为新型的肿瘤标志物或潜在的抗肿瘤药物靶点。
[1] 司马晋,张 保,马 鑫,等.Numb基因对膀胱癌细胞侵袭和迁移能力的影响及机制研究[J].中华泌尿外科杂志,2014,35(3):226-229.
[2] Sverrisson EF, Zens MS, Liang FD,et al. Clinicopathological correlates of Gli1 expression in a population-based cohort of patients with newly diagnosed bladder cancer[J]. Urol Oncol,2014,32(5):539-545.
[3] 曾斯逊,李昌林,丁振宇,等.omega-3多不饱和脂肪酸对人肺腺癌细胞H460及H1975细胞周期及细胞凋亡的影响[J].肿瘤预防与治疗,2015,28(1):1-7.
[4] 司马晋,张 保,杨素霞,等.过表达Notch1基因对前列腺癌细胞增殖和周期的影响[J].中华实验外科杂志,2014,31(6):1235-1237.
[5] Xin C, Tara H, Vincent C,et al. Numb mediates the interaction between Wnt and Notch to modulate primitive erythropoietic specification from the hemangioblast[J]. Development, 2008,135(20):3447-3458.
[6] 司马晋,张 保,毛燕新,等. Numb基因过表达对人肾癌细胞侵袭和迁移能力的影响[J]. 肿瘤研究与临床,2015,27(9):582-585.
[7] Sima J, Zhang B, Yu Y, et al. Overexpression of Numb suppresses growth, migration, and invasion of human clear cell renal cell carcinoma cells[J]. Tumor Biol, 2015,36(4):2885-2892.
[8] Thomas S, Kenneth L.Analyzing real-time PCR data by the comparative CT method[J]. Nature Protocols,2008,3(6):1101-1108.
[9] 王明琼,罗德康.经尿道膀胱肿瘤电切术后应用吡柔比星两种膀胱内灌注方法治疗非浸润性膀胱尿路上皮癌的效果比较[J].肿瘤预防与治疗,2014,27(2): 77-80.
[10]司马晋,朱明阳,艾 青,等.NOTCHl/HESl/PTEN信号通路在浸润性膀胱癌中的表达分析[J].中华医学杂志,2012,92(14):964-967.
[11]Brooks S, Lomax-Browne H, Carter T, et al.Molecular interactions in cancer cell metastasis[J]. Acta Histochem, 2010,112(1):3-25.
[12]刘 玲,詹 平,汪春燕,等.LRP16和 E-cadherin 在子宫内膜腺癌中的表达研究[J].肿瘤预防与治疗,2015,28(3):135-139.
[13]Rennstam K,MeMichael N,Bcerglund P,et al.Numb protein expression correlates with a basal-like phenotype and cancer stem cell markers in primary breast Cancer[J]. Breast Cancer Res Treat, 2010, 122(2):315-324.
[14]Wu J, Shen SL, Chen B, et al. Numb promotes cell proliferation and correlates with poor prognosis in hepatocellular carcinoma[J]. PLoS One, 2014, 9(4):e95849.
[15]司马晋,张 保,王保军,等.下调Notch1基因对前列腺癌PC-3细胞迁移和增殖的影响[J].肿瘤研究与临床,2014,26(11):721-724.
[16]Lima MS, Pereira RA, Costa RS, et al. The prognostic value of cyclin D1 in renal cell carcinoma[J]. Int Urol Nephrol, 2014,46(5):905-913.
[17]Flores AN, McDermott N, Meunier A, et al. Numb inhibition of Notch signalling as a therapeutic target in prostate cancer[J].Nat Rev Urol,2014,11(9):499-507.
[18]Das D, Lanner F, Main H,et al. Notch induces cyclin-D1-dependent proliferation during a specific temporal window of neural differentiation in ES cells[J].Dev Biol,2010,348(2):153-166.
Effect of Numb Gene on Cell Cycle and Proliferation in Human Bladder Cancer 5637 Cells*
Sima Jin1, Zhang Bao1△, Ai Qing2, et al
(1.DepartmentofUrology,AerospaceCenterHospital,Beijing100049,China; 2.KeyLaboratoryofUrologicalDiseases,GeneralHospitalofChinesePeople’sLiberationArmy,Beijing100053,China)
Objective: To study the effect of Numb gene on cell cycle and proliferation in human bladder cancer cells and its related mechanism. Methods: Human bladder cancer 5637 cells which were transfected by the Numb-ORF plasmid were used as the experimental group. The negative control and blank control were also set. The expression of Numb or Cyclin D1 was detected by Real-Time PCR and Western Blot. The cell cycle was analyzed by Flow cytometry. Cell proliferation was assessed by comparing with absorbance at 490nm using a Micro-plate Reader. Results: Compared with the negative control (5.66±0.53) and blank control (5.81±0.47), the △CTvalue of Numb in the Numb-ORF group (1.58±0.41) was significantly lower (F=77.39,P=0.00). Meanwhile, the △CT value of Cyclin D1 in the Numb-ORF group (4.92±0.73) was significantly higher than that in the negative control (2.59±0.33) and blank control (2.45±0.26) (F=11.70,P=0.01). The ratio (%) of G0/G1cells was as follows: Numb-ORF group was 49.76±7.07, negative control was 36.52±3.32 and blank control was 38.21±2.06 (F=7.17,P=0.03). In proliferation assay, compared with negative control (0.52±0.06) and blank control (0.55±0.04), the OD value at 24h in Numb-ORF group (0.35±0.08) was significantly reduced (F=9.03,P=0.02). Conclusion: Numb gene could promote G0/G1phase arrested and inhibit proliferation of bladder cancer cells, the suppressive effects may be due to down-regulation of Cyclin D1.
Bladder Neoplasm; Numb Gene; Cyclin D1
2015- 10- 09
2016- 01- 09
*国家自然科学基金(81100561)
司马晋,男,山西运城人,硕士研究生,主治医师,主要研究方向:泌尿系肿瘤的基础和临床研究。
△张 保,主任医师,E-mail:baoztj@sina.com
R737.14;R730.2
A
10.3969/j.issn.1674- 0904.2016.01.001
•应用基础研究•

