Bi/Fe3O4催化NaBH4还原水中对硝基苯酚
蔡可迎,崔 耀,周慧敏
(徐州工程学院 化学化工学院,江苏 徐州 221111)
Bi/Fe3O4催化NaBH4还原水中对硝基苯酚
蔡可迎,崔 耀,周慧敏
(徐州工程学院 化学化工学院,江苏 徐州 221111)
以磁性Fe3O4为载体负载Bi(NO3)3,再用NaBH4还原Bi3+制备了Bi/Fe3O4催化剂。采用XRD和紫外-可见光谱对催化剂进行表征。考察了Bi负载量、NaBH4加入量和Bi/Fe3O4加入量对Bi/Fe3O4催化NaBH4还原对硝基苯酚(4-NP)效果的影响。表征结果显示:当催化剂中Bi含量较少时,Bi分散良好;当Bi含量较多时,会形成纳米颗粒。实验结果表明:当反应温度为25 ℃、初始4-NP浓度为4.0 mmol/L时,在Bi负载量为5%(w)、Bi/Fe3O4催化剂加入量为500 mg/L、NaBH4加入量为6.0 g/L的条件下,反应速率常数为0.581 min-1,4-NP的去除率为99.7%;Bi/Fe3O4催化剂稳定性好,重复使用15次后,活性基本不变。
对硝基苯酚;NaBH4;Bi/Fe3O4催化剂;催化还原
对硝基苯酚(4-NP)是化工生产中重要的有机合成原料,可用于生产医药和杀菌剂等。但4-NP一旦进入环境,会对人和动植物造成危害。4-NP具有高毒性,能溶于水,性质稳定,是最难以治理的化合物之一[1]。4-NP的还原产物对氨基苯酚(4-AP)的毒性相对较低。同时,4-AP也是重要的化工和医药中间体。因此,开发一种在水介质中将4-NP还原为4-AP的环境友好技术具有重要意义[2]。
目前,常用的4-NP处理方法有吸附法[3]、微生物降解法[4]、光催化降解法[5-6]、化学氧化法[7]、化学还原法[2]及电化学处理法[8]。其中,化学还原法具有反应条件温和、高效、快速和环境友好等优点。但化学还原法使用的催化剂以贵金属催化剂金[2,9-10]和银[11-13]为主,应用受到一定限制。Bi的毒性很低,是一种“绿色”金属。我国Bi资源丰富,储量总计500~600 kt,占世界总储量的70%[14-15]。对于Bi(Ⅲ)化合物催化氢转移还原芳香族硝基化合物有少量的研究报导[16],但未见Bi催化NaBH4还原4-NP的研究报道。
本工作采用吸附还原法,以Fe3O4为载体,负载Bi(NO3)3,得到Bi/Fe3O4催化剂,并用于催化NaBH4还原4-NP。采用XRD和紫外-可见光谱等技术对催化剂进行了表征。考察了Bi负载量、NaBH4加入量和Bi/Fe3O4加入量对Bi/Fe3O4催化NaBH4还原4-NP效果的影响。
1 实验部分
1.1 试剂和仪器
Bi(NO3)3·5H2O,Fe3O4,NaBH4,4-NP:分析纯。
T6型紫外-可见分光光度计:北京普析通用仪器公司;Ultima Ⅳ型X-射线衍射仪:日本理学株式会社。
1.2 催化剂的制备
将0.12 g Bi(NO3)3·5H2O溶解在稀硝酸中,稀释至50 mL。将1.0 g Fe3O4加入Bi(NO3)3溶液中,超声处理10 min,使Fe3O4尽量分散均匀。在室温下搅拌12 h。减压旋转蒸发,去除水分后加入到过量的NaBH4溶液中,室温搅拌2 h,将Bi3+还原为Bi0。再用蒸馏水洗涤固体至中性,在室温下真空干燥即得Bi负载量为5%(w,下同)的催化剂Bi/Fe3O4(记作5%Bi/Fe3O4)。用同样的方法分别制备Bi负载量为1%,3%,7%的催化剂Bi/Fe3O4,分别记作1%Bi/ Fe3O4,3%Bi/Fe3O4,7%Bi/Fe3O4。
1.3 催化还原4-NP
向100 mL浓度为4.0 mmol/L的4-NP溶液中加入一定量新配制的NaBH4溶液。开动搅拌,使溶液混合均匀,控制水浴温度为25 ℃。然后加入一定量Bi/Fe3O4进行催化还原4-NP反应。反应完成后,用磁铁分离回收催化剂,洗涤后可重复使用。
1.4 分析方法
采用XRD技术对催化剂进行表征,Cu Kα射线,工作电压40 kV,工作电流30 mA。采用紫外-可见分光光度计在波长400 nm处测定4-NP溶液的吸光度[17],计算4-NP质量浓度。
2 结果与讨论
2.1 催化剂的XRD表征结果
催化剂的XRD谱图见图1。由图1可见:2θ=18.5°,30.3°,35.6°,37.2°,43.2°,53.6°,57.1°,62.7°,74.1°处的衍射峰与标准卡片PDF No.65-3107中立方晶系的Fe3O4谱图相吻合;1%Bi/ Fe3O4,3%Bi/Fe3O4,5%Bi/Fe3O4的XRD谱图中没有出现Bi及其化合物的衍射峰,说明Bi组分很好地分散在Fe3O4中,没有形成晶体;7%Bi/Fe3O4的XRD谱图中2θ=24.0°,32.9°,47.1°处的衍射峰与标准卡片PDF No.01-0898中的Bi(OH)3谱图吻合,说明催化剂中出现Bi(OH)3,这是由于当催化剂中Bi负载较多时,Bi0被氧化成为Bi3+,且聚集,因此出现了Bi(OH)3的衍射峰。
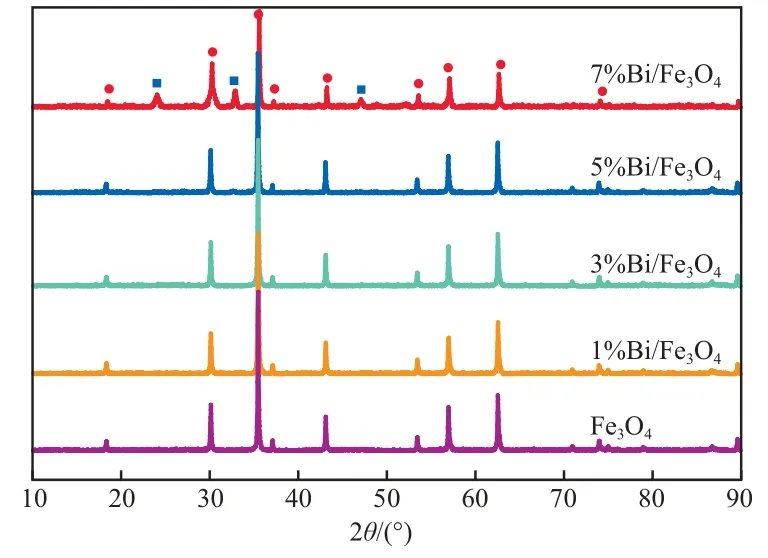
图1 催化剂的XRD谱图
2.2 催化剂的紫外-可见光谱表征结果
催化剂的紫外-可见光谱见图2。由图2可见:1%Bi/Fe3O4和3%Bi/Fe3O4的紫外-可见光谱与Fe3O4类似,未出现纳米Bi的吸收峰,表明Bi在Fe3O4表面分散较好,没有形成纳米颗粒;随Bi负载量的增加,Bi在Fe3O4表面有一定程度的聚集;当Bi负载量为7%时,在262 nm处出现了纳米Bi的特征吸收峰[18],表明此时Bi以纳米颗粒的形式分散在Fe3O4表面。
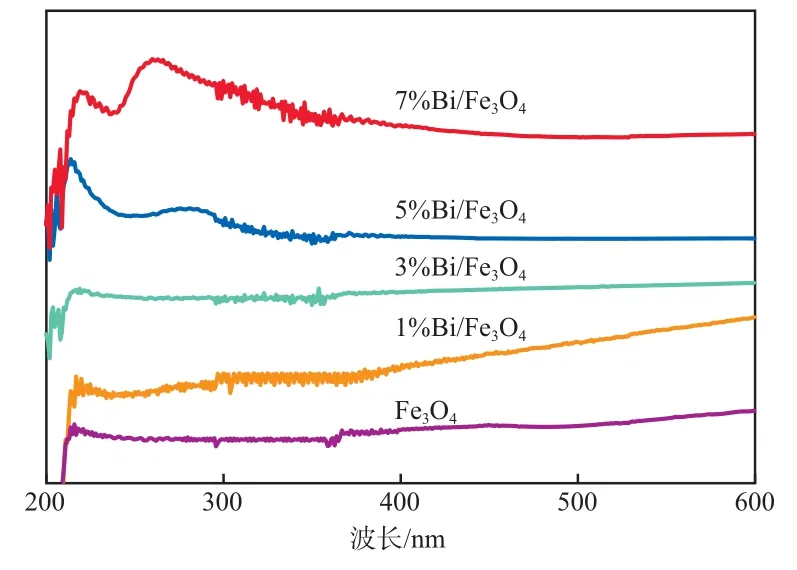
图2 催化剂的紫外-可见光谱
2.3 Bi负载量对催化还原效果的影响
在NaBH4加入量为3.0 g/L、Bi/Fe3O4加入量为300 mg/L的条件下,Bi负载量对催化还原效果的影响见图3。由图3可见:随催化剂中Bi负载量的增加,催化剂的催化还原效率逐渐提高;以1%Bi/ Fe3O4为催化剂时,反应25 min仍有未被还原的4-NP;以3%Bi/Fe3O4为催化剂时,反应速率有所提高,还原4-NP的反应在20 min后基本完成;以5%Bi/Fe3O4和7%Bi/Fe3O4为催化剂时,还原反应的速率更快,反应在12 min内基本完成;从反应进程看,5%Bi/Fe3O4和7%Bi/Fe3O4的催化活性差别不大。因此,确定适宜的Bi负载量为5%。
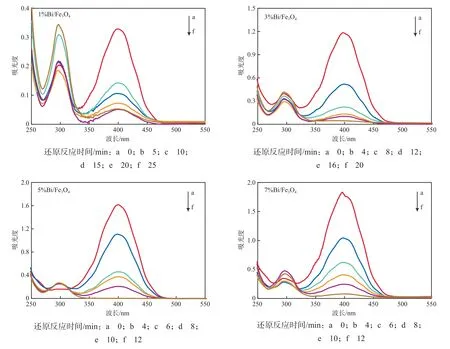
图3 Bi负载量对催化还原效果的影响
2.4 NaBH4加入量对催化还原效果的影响
在NaBH4过量时,反应可看作准一级反应,且4-NP质量浓度和吸光度成正比,因此有如下关系式:ln(At/A0)= ln(ρt/ρ0)= -kt。式中:k为反应速率常数,min-1;t为还原反应时间,min;ρ0和ρt分别为反应初始和t时刻的4-NP质量浓度;A0和At分别为反应初始和t时刻的吸光度。在Bi负载量为5%、Bi/Fe3O4加入量为100 mg/L的条件下,NaBH4加入量对催化还原效果的影响见图4。由图4可见:在不同NaBH4加入量的条件下,ln(At/A0)与t呈线性关系,拟合度较好;当NaBH4加入量为4.5 g/L和6.0 g/L时,反应速率常数较大。实验选择NaBH4加入量为6.0 g/L,此时的反应速率常数为0.234 min-1。
2.5 Bi/Fe3O4加入量对催化还原效果的影响
在Bi负载量为5%、NaBH4加入量为6.0 g/L的条件下,Bi/Fe3O4加入量对催化还原效果的影响见图5。由图5可见:当Bi/Fe3O4加入量分别为100,300,500,700 mg/L时,反应速率常数分别为0.252,0.430,0.581,0.540 min-1;随Bi/Fe3O4加入量的增加,反应速率长常数先逐渐增加后略有降低;当Bi/Fe3O4加入量为500 mg/L时,反应速率常数最大。因此,确定适宜的Bi/Fe3O4加入量为500 mg/L。
2.6 催化剂的重复使用效果
在Bi负载量为5%、Bi/Fe3O4加入量为500 mg/ L、NaBH4加入量为6.0 g/L的条件下,Bi/Fe3O4的重复使用效果见图6。由图6可见:初次使用时,Bi/ Fe3O4催化NaBH4还原4-NP的去除率为99.7%;经过15次的重复使用,Bi/Fe3O4的催化活性基本保持不变。实验结果表明,Bi/Fe3O4具有较高的稳定性,可重复多次使用。

图4 NaBH4加入量对催化还原效果的影响
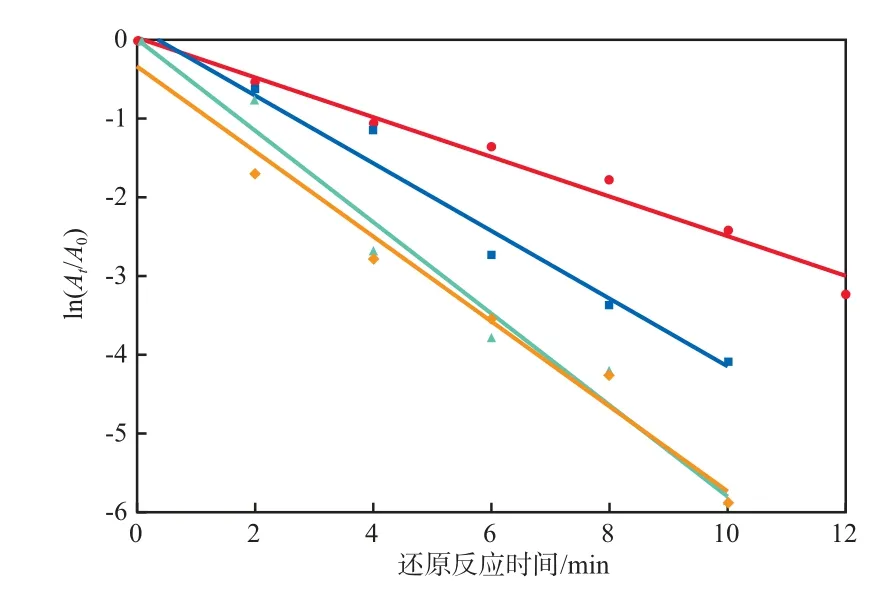
图5 Bi/Fe3O4加入量对催化还原效果的影响

图6 Bi/Fe3O4的重复使用效果
3 结论
a)采用吸附还原法制备了Bi/Fe3O4催化剂,当Bi负载量小于5%时,Bi在Fe3O4表面分散均匀。
b)在水介质中Bi/Fe3O4催化NaBH4还原4-NP具有较高的催化活性,其活性在一定范围内随Bi/ Fe3O4催化剂中Bi负载量的增加而提高。
c)增加NaBH4和Bi/Fe3O4的用量可提高催化还原反应的速率。当初始4-NP浓度为4.0 mmol/L时,在Bi负载量为5%、Bi/Fe3O4加入量为500 mg/L、NaBH4加入量为6.0 g/L的条件下,反应速率常数为0.581 min-1,4-NP的去除率为99.7%。
d)催化剂稳定性好,重复使用15次后,活性基本不变。
[1] Dong Zhengping,Le Xuanduong,Li Xinlin,et al. Silver nanoparticles immobilized on fi brous nano-silica as highly effi cient and recyclable heterogeneous catalyst for reduction of 4-nitrophenol and 2-nitroaniline[J]. Appl Catal,B,2014,158/159:129 - 135.
[2] 王珍珍,翟尚儒,翟滨,等. 基于对硝基苯酚还原模型反应的纳米金催化材料[J]. 化学进展,2014,26 (2/3):234 - 247.
[3] 孟启,周峰,舒斌斌,等. PS-Cy和PS-Acyl-Cy树脂的制备及其吸附对硝基苯酚[J]. 合成树脂及塑料,2015,32(3):44 - 48.
[4] 任磊,史延华,贾阳,等. 菌株Arthrobacter sp. CN2降解对硝基苯酚的特性与动力学[J]. 环境科学,2015,36(5):1757 - 1762.
[5] 方林霞,王玲玲,张燕,等. 膨胀珍珠岩负载Eu3+-TiO2催化剂的制备及其催化性能[J]. 化工环保,2012,32 (5):462 - 465.
[6] 刘秀华,傅依备,谢云,等. Au/TiO2薄膜的制备及其光催化氧化对硝基苯酚的性能[J]. 催化学报,2006,27(6):532 - 536.
[7] 潘维倩,张广山,郑彤,等. 微波耦合类Fenton处理水中对硝基苯酚[J]. 中国环境科学,2014,34 (12):3112 - 3118.
[8] 腾文娟,毛信表,马淳安. 活性碳载碳化钨复合材料的制备及其对对硝基苯酚的电催化性能[J]. 化工学报,2010,61(5):1313 - 1318.
[9] Gupta V K,Atar N,Yola M L,et al. A novel magnetic Fe@Au core-shell nanoparticles anchored graphene oxide recylable nanocatalyst for the reduction of nitrophenol compounds[J]. Water Res,2014,48:210 - 217.
[10] 王雪兆,齐连怀,杨清香,等. Au/Fe3O4纳米复合材料的制备及其催化性能[J]. 精细化工,2013,30 (8):860 - 865,905.
[11] Zheng Yuyu,Shu Jinxia,Wang Zhonghua. AgCl@Ag Composites with rough surfces as bifunctional catalyst for the photooxidation and catalytic reduction of 4-nitrophenol[J]. Mater Lett,2015,158:339 - 342.
[12] Gupta V K,Yola M L,Eren T,et al. Catalytic activity of Fe@Ag nanoparticle involved calcium alginatebeads for the reduction of nitrophenols[J]. J Mol Liq,2014,190:133 - 138.
[13] Mohamed M M,Al-Sharif M S. One pot synthesis of silver nanoparticles supported on tio2using hybrid polymers as template and its effi cient catalysis for the reduction of 4-nitrophenol[J]. Mater Chem Phys,2012,136:528 - 537.
[14] 李玉鹏,刘春艳,吴绍华,等. 金属铋制备方法研究现状及发展趋势[J]. 湿法冶金,2007,26(3):118 -122.
[15] Salvador J A R,Pinto R M A,Silvestre S M. Recent advances of bismuth(Ⅲ)salt in organic chemistry:Application to the synthesis of heterocycles of pharmaceutical interest[J]. Curr Org Synth,2009,6:426 - 470.
[16] 蔡可迎,刘长宁,周颖梅,等. 活性碳负载氢氧化氧铋催化水合肼还原芳香族硝基化合物[J]. 应用化学,2009,26(9):1080 - 1083.
[17] 余焕焕,刘芳,王士琦,等. 载银蒙脱石的制备及其对对硝基苯酚还原反应的催化性能[J]. 硅酸盐学报,2013,41(11):1581 - 1587.
[18] Ma Dechong,Zhao Jingzhe,Chu Rui,et al. Novel synthesis and characterization of bismuth nano/microcrystals with sodium hypophosphite as reductant[J]. Adv Powder Technol,2013,24:79 - 85.
(编辑 王 馨)
Bi/Fe3O4-catalyzed reduction of p-nitrophenol in water with NaBH4
Cai Keying,Cui Yao,Zhou Huimin
(School of Chemistry and Chemical Engineering,Xuzhou Institute of Technology,Xuzhou Jiangsu 221111,China)
The Bi/Fe3O4catalyst was prepared by loading Bi(NO3)3on magnetic Fe3O4and then reducing Bi3+with NaBH4. The catalyst was characterized by XRD and UV-Vis spectrophotometry. The factors affecting the Bi/Fe3O4-catalyzed reduction of p-nitrophenol(4-NP)with NaBH4were studied. The characterization results show that Bi can disperse uniformly in the catalyst when the content of Bi is little,vice versa,form nanoparticle. The characterization results show that:Under the conditions of reaction temperature 25 ℃,initial 4-NP mass concentration 4.0 mmol/L,Bi loading 5%(w),Bi/Fe3O4catalyst dosage 500 mg/L and NaBH4dosage 6.0 g/L,the reaction rate constant is 0.581 min-1,and the 4-NP removal rate is 99.7%;The stability of the Bi/Fe3O4catalyst is good and its activity keeps almost the same after reused for 15 times.
p-nitrophenol;NaBH4;Bi/Fe3O4catalyst;catalytic reduction
O643.3
A
1006-1878(2016)01-0036-05
10.3969/j.issn.1006-1878.2016.01.008
2015 - 07 - 24;
2015 - 10 - 08。
蔡可迎(1970—),男,江苏省沛县人,博士,副教授,电话 0516 - 83105539,电邮 caikeying@163.com。
徐州工程学院科研项目(XKY2012207)。

