抗体与抗体药物的前世今生
许卓斌,王旻
中国药科大学生命科学与技术学院, 南京 210009
抗体与抗体药物的前世今生
许卓斌†,王旻
中国药科大学生命科学与技术学院, 南京 210009
抗体药物是生物技术制药领域的一个重要方面。抗体具有识别抗原的特异性,因而利用抗体诊断与治疗疾病是医药研究者长期以来追求的目标。抗体的发现与应用离不开免疫学。从免疫系统入手,详细介绍了抗体物质发现的历史进程与临床应用。近年来,以细胞工程技术和基因工程技术为主体的抗体工程技术已成为生物技术制药领域的热点。抗体药物的研制与产业化正以迅速的发展势头进入新的时代。
抗体;可变区;单克隆抗体;人源化;基因工程
免疫系统对生命活动极其重要,又非常神秘和复杂,因此免疫学一直是诺贝尔奖的常客。学生们经常对免疫学的课程一知半解,一头雾水。免疫学的发展和人类与传染病的斗争过程是相辅相成的。从最开始的中国人接种“人痘”预防天花的记载算起,到后来的英国人Jenner受到中国人痘接种法的启示,接种牛痘预防天花,直至今日,免疫学的发展已有三个半世纪。20世纪初,抗原(Antigen)与抗体(Antibody)的发现,揭示出了“抗原诱导抗体”这一免疫学的根本问题,促进了免疫学的快速发展及抗体的临床应用。
早在19世纪末,抗体被动免疫疗法的创立为当时不发达的疾病治疗开辟了新途径。19世纪80年代后期,学者们在研究病原菌的过程中,发现白喉杆菌分泌的白喉外毒素有致病性,进而发现在感染者的血清中有“杀菌素”(bactericidins),也就是最早发现的抗体。Von Behring和同事 Kitasato 于1890年正式使用白喉抗毒素治疗白喉病人,随后他们又成功使用白喉脱毒外毒素进行预防接种。当时的科学家们根据抗体来源的特性,把能刺激宿主产生抗体的物质命名为抗原,从而使抗体研究成为免疫学的一个重要分支,促进了抗体治疗的快速发展。1895年,Charles Richet和Jules Hericourt首次将肿瘤细胞注入动物体内,尝试将动物体内产生的抗血清(antiserum)用于治疗肿瘤患者,结果显示患者症状得到明显改善,但是因为抗血清的纯度低、特异性差等原因,患者没能得到治愈。其后不少研究者们重复以上试验,然而试验结果波动较大,无法确定其疗效,有时甚至产生严重的毒副反应危及生命。后来的研究发现,抗血清是由多种不同抗体以及其他物质组成的混合物,这些抗体分别针对肿瘤细胞表面不同的抗原。长期以来,抗血清主要用于中和外源性毒素如蛇毒等,但未能成功用于肿瘤和其他疾病的治疗。
1 抗体发现
目前,科学家们对于抗体有一个公认的定义。抗体是一种由B细胞识别抗原后活化、增殖分化为浆细胞,并由浆细胞合成与分泌的、具有特殊氨基酸序列的,能够与相应的抗原发生特异性结合的免疫球蛋白分子。在抗体发现早期,这种特异性的抗体物质勾起了科学家们极大的兴趣,科学家们前赴后继致力于解析抗体的结构,但由于落后的实验条件,进展缓慢。直到20世纪50年代,科学家们对抗体的结构和抗原抗体识别机理的理解还非常浅显。1937年瑞典物理学家Arne Wilhelm Kaurin Tiselius通过电泳技术证明了抗体也是一种蛋白质,并将其称为γ球蛋白。1953年英国生物化学家Frederick Sanger成功解析了同样身为蛋白质的胰岛素的化学结构,从而为科学家们解析抗体结构指明了方向。抗体结构的解析离不开美国生物学家Gerald Maurice Edelman,他受到Sanger解析胰岛素结构的启发,用β-巯基乙醇处理免疫球蛋白G,分解成两条链,根据分子量大小分别称为重链和轻链,并在此基础上提出了自己心目中的抗体结构:重链和轻链折叠形成奇特的袋状结构,从而识别抗原。1963年,Edelman与Rodney Robert Porter(Sanger的第一个博士研究生)结合两人多年的研究结果,提出了比较成熟的抗体分子模型。他们认为,抗体是由两条重链和两条轻链组成的“Y”型对称结构,一条轻链和一条重链的一半组成了“Y”型结构的分支。抗体识别抗原的特异性结合位点位于“Y”型结构的两个分支的顶端,轻链和重链都有一部分包含其中。1969年,Edelman和Porter完成了一项在当时了不起的成就,他们成功对抗体1 300多个氨基酸序列进行了测定,是当时测定氨基酸序列的最大的蛋白质分子[1-2]。随后Edelman继续深入研究抗体的结构,陆续提出了越来越精确的抗体分子结构,包括重链可变区、重链恒定区、轻链可变区、轻链恒定区以及抗体内部二硫键的位置,同时他认为抗体的差异是由可变区的差异决定的。
通过对抗体结构的不懈研究,抗体识别抗原的结构基础得到了有效阐释,却仍无法回避抗体多样性的基本问题。抗体的分子序列并不固定,免疫系统能够产生不同抗体结合不同的抗原物质。若依据“一个基因编码一条多肽链”的理论,即使人类基因组都无法满足抗体多样性编码的需求。对于这个问题,Edelman和另一位同行Joseph Gajly于1967年提出了一个抗体多样性产生的最初的设想[2]。他们认为编码抗体的基因存在染色体重排现象,识别抗原之后数量有限的抗体基因通过不同的组合形式编码无限种类的抗体分子。
在Edelman(图1左)提出的抗体多样性理论的基础上,1976年,日本科学家利根川进(图1右)和同事在检测不产生抗体的胚胎细胞和产生抗体骨髓瘤细胞中抗体轻链基因的分布时发现,胚胎细胞中不同抗体基因距离较远,而骨髓瘤细胞中抗体基因距离接近,这个发现说明生殖细胞在发育成免疫细胞的过程中,抗体基因发生了重新分布现象。利根川进在此基础上用一系列确凿的实验数据确定了抗体多样性是由B淋巴细胞中抗体基因的染色体重排和突变造成的。根据估算,抗体基因通过重组和突变甚至可以编码100亿种不同的抗体,很好解释了抗体多样性产生的原因[3-4]。1987年,利根川进由于抗体多样性的突破性研究独享了该年度的诺贝尔生理学或医学奖。

图1 Edelman(左)和利根川进(右)
2 抗体结构
任何抗体的轻链都可以根据结构上的差异分为κ或λ型,而抗体的类型则是由重链决定的(图2)。
2.1 重链
哺乳动物抗体(Ig)的重链一共分为5种,分别用希腊字母α、δ、ε、γ和μ来命名,相对应组成的5种抗体分别称为IgA、IgD、IgE、IgG和IgM(表1)。不同的重链在大小和组成上有所区别,α、δ和γ型重链包含大约450个氨基酸,而μ和ε则有大约550个氨基酸。每个重链有两个区:恒定区(CH)和可变区(VH)。所有同一型的抗体其恒定区都是相同的,不同型的抗体恒定区之间则存在差异。重链α、δ和γ的恒定区的组成为3个前后串联的Ig结构域(CH1、CH2和CH3),并有一个铰链区增加抗体各区域的灵活性;重链μ和ε的恒定区则由4个Ig结构域组成(CH1、CH2、CH3和CH4)。不同B淋巴细胞产生的抗体其重链的可变区不同,但同一种B细胞产生的抗体可变区则是相同的,每一个重链的可变区都是大约为110个氨基酸,并组成一个单独的结构域。
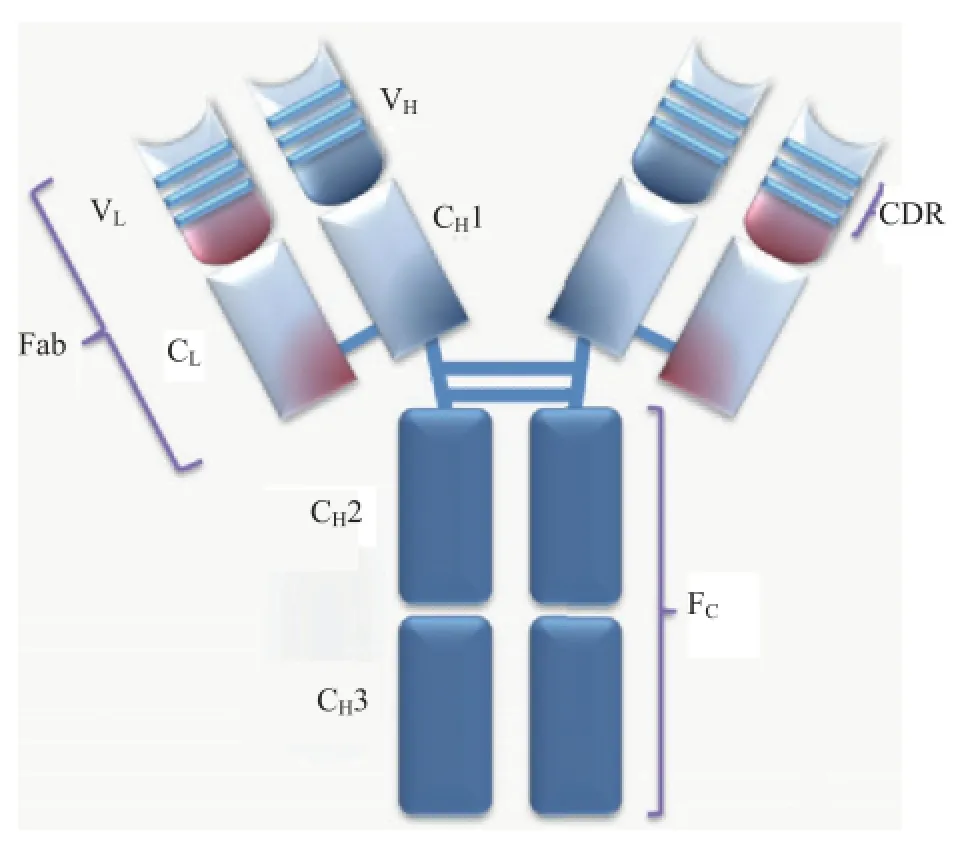
图2 抗体分子的结构简化示意图
2.2 轻链
哺乳动物只有两种轻链:λ型和κ型。每条轻链有两个前后相连的结构域:一个恒定区(CL)和一个可变区(VL)。轻链的长度为210~220个氨基酸,每个抗体包含的两条轻链总是相同的。对哺乳动物来说每一个抗体中的轻链只有一个型:κ或λ型。
2.3 Fab和Fc段
抗体Fc段可以直接结合酶或荧光染料来标记抗体,是在免疫沉淀、免疫印迹和免疫组化等多种免疫结合反应中识别并结合二抗的部位。抗体可以被蛋白水解酶如木瓜蛋白酶水解成2个Fab段和1个Fc段,或者被胃蛋白酶从铰链区断开,水解成1个F(ab)2段和1个Fc段。IgG抗体片段有时是非常有用的。由于缺少Fc段,Fab段不会和抗原发生沉淀,也不会在活体研究中被免疫细胞捕获。因为分子片段较小,且缺乏交联功能(由于Fc段的缺失),Fab段通常用于功能性研究中的放射性标记。Fc段则主要用做免疫组化染色中的阻断剂。
3 单克隆抗体
抗体技术又一次重大突破是单克隆抗体技术的诞生。为了便于区别,此前以抗原免疫动物获得抗血清途径制备的抗体则称之为多克隆抗体。1975年英国科学家Milstein和法国科学家Kohler将产生抗体的B淋巴细胞同肿瘤细胞融合形成杂交瘤细胞[5]。杂交瘤细胞具备亲本细胞的特性,既可以产生抗体,又具有肿瘤细胞无限增殖的特性,从而持续分泌单克隆抗体。单克隆抗体优点众多,在抗体临床应用过程中具有划时代的意义。除了易于通过细胞工程手段在体外大量制备以外,尤其重要的是单克隆抗体识别的高度特异性以及产生的均一性,和多克隆抗体相比可以大大降低在病人体内的交叉反应,同时为利用抗体治疗肿瘤带来了新的希望,被形象地称之为“魔弹”,希望单克隆抗体靶向攻击致病源而不产生毒副作用。两位科学家因此被授予1984年的诺贝尔生理学或医学奖。

表1 不同抗体的组成、大小、结构以及功能的区别
4 人源化抗体
由于通过杂交瘤技术制备的单克隆抗体是鼠源性的,应用于人体不可避免地引起人抗鼠抗体(HAMA)反应,限制了单克隆抗体的临床应用。为了克服这种缺陷,20世纪80年代中期研究者们寻求以基因工程技术对鼠源性单克隆抗体进行改造,尝试对其人源化处理(图3)。如将鼠源抗体可变区与人抗体恒定区拼接而形成嵌合抗体,或将鼠抗体可变区的互补决定区(CDR区)与人的抗体的互补决定区互换构成人源化抗体,等等。

图3 抗体人源化的基本原理
4.1 人鼠嵌合抗体
人鼠嵌合抗体是指鼠源抗体的恒定区被人抗体的恒定区所取代,保留鼠单抗的可变区序列,形成所谓的人鼠嵌合抗体。操作过程简便,同时大幅度降低HAMA反应,而与亲本鼠单抗的亲和力相比几乎没有改变。另外,由于恒定区替换成了人抗体恒定区,人鼠嵌合抗体还具有与人抗体同样的效应功能,如抗体依赖的细胞介导的细胞毒作用(ADCC)、补体固定作用等[6]。嵌合抗体成功的例子:Rituxan(中文名美罗华),罗氏公司的抗 CD20 抗体,用于治疗 B 淋巴瘤,含人IgG1恒定区。它的抗淋巴瘤作用主要来自于补体作用、ADCC作用和诱导肿瘤细胞凋亡。2015年此单一产品的销售额达到70亿美元。但是更多的临床数据显示,不同的嵌合抗体有着不同程度的免疫原性,所以有必要进一步降低鼠源性。
4.2 人源化抗体
因为人鼠嵌合抗体仅仅消除了鼠源单抗的部分异源性,未经改造的可变区的鼠源序列依然可以诱导人体产生HAMA反应,因此对鼠源抗体可变区的进一步进行人源化改造是必然趋势[7-8]。通过研究大量小鼠抗体可变区序列,截取可变区中与抗原直接接触的序列(互补决定区)与人抗体可变区的框架区嫁接,经过亲和力重塑,可在极大程度上保持亲本抗体的特异性和亲和力,同时在人鼠嵌合抗体的基础上进一步消除免疫原性和毒副作用。人源化抗体成功的例子: Herceptin (中文名赫赛汀),罗氏公司治疗人表皮生长因子的受体-2(HER2)过度表达的转移性乳腺癌抗体,2015年销售额超过60亿美元。
4.3 全人抗体
通过转基因技术,在体外加工形成功能完全的全人抗体,或者利用基因工程改造的抗体基因缺失动物表达人类抗体,从而获得全人源抗体,避免了鼠源性单抗的种种缺点。全人抗体是用于临床治疗的理想抗体,目前主要通过抗体库技术以及转基因小鼠技术等方法生产全人抗体。
4.3.1 抗体库筛选技术
从狭义上讲,所谓抗体库技术,就是通过基因工程手段克隆全套抗体重链和轻链可变区基因,表达有功能的抗体分子片段,最后通过亲和筛选获得与抗原产生特异性结合的抗体可变区基因的技术[9]。利用抗体库技术获得的抗体基因将被用于体外表达基因工程抗体。不仅如此,抗体库技术还能够对已有的抗体分子进行改造,如降低鼠源性、提高亲和力和稳定性等。抗体库筛选技术主要包括:噬菌体抗体库和核糖体展示技术。
(1) 噬菌体展示技术
从人B淋巴细胞中分离抗体可变区基因,扩增抗体VH和VL基因片段,随后将体外扩增的基因片段随机克隆形成组合文库;将基因组合文库噬菌体外膜蛋白融合表达,展示在噬菌体颗粒的表面。最后用固相化抗原直接、高效地筛选出表达特异性好、亲和力强的抗体基因序列[10-11],经体外加工形成全人抗体。目前,利用噬菌体抗体库技术已经非常成熟,在全世界范围内得到广泛应用,而且通过该技术成功筛选出大量进入临床应用的抗体。全人抗体成功的例子:Humira(中文名修美乐),雅培公司研发的抗TNF全人单抗,是人单克隆重链和轻链经二硫键结合的二聚物,用于治疗关节炎。Humira全球销售额连续多年超过140亿美元,是2015年全球最畅销药品。
(2) 核糖体展示技术
扩增目的基因文库,再加上各种体外表达的必须元件,在转录/翻译偶联系统作用下,形成“蛋白质-核糖体-mRNA”三元复合物,用靶抗原反复筛选复合物,分离mRNA,逆转录富集目的基因,从而获得库容量大、特异性强、亲和力高的人源基因工程抗体库。
核糖体展示技术无需进行体内外系统转化,全程只需通过简单的基因工程手段,使得其建库时间大大缩短,简化筛选流程。同时PCR技术还可定向引入突变序列,提高靶基因多样性,便于筛选高亲和力抗体序列。
4.3.2 转基因小鼠制备全人抗体
简单地说就是将人抗体基因替换小鼠的抗体基因生成转基因小鼠。美国Cell Genesys公司和Gerrpharm公司于1994年同年先后宣布成功研发转基因小鼠生产全人抗体。运用转基因小鼠技术进一步制备一系列功效优越、亲和力高的抗体。但是也存在不足之处,所制备的抗体通常具有不完全的人序列以及鼠糖基化修饰,因此这些单抗的最终形式也并不是全人的[12-13]。
5 小分子抗体
抗体分子可变区组成的Fv段是与抗原结合的结构基础,在Fv段的基础上可以构建具有抗原结合功能的抗体分子片段,也叫作小分子抗体。小分子抗体是制备其他基因工程抗体的前提。
5.1 抗原结合片段( Fragment with antigen binding, Fab)
Fab片段包括重链Fd段(可变区VH和第一恒定区CH1)和完整轻链,不含Fc段,重链Fd段和轻链间有一个二硫键,形成异二聚体结构。整个Fab分子占完整抗体大小的三分之一,具有一个抗原结合位点。木瓜蛋白酶可以水解全长抗体获得Fab片段。Fab片段结构稳定,具有与完整抗体相似的抗原结合活性,但亲和力较低。Fab片段多用于对肿瘤进行成像诊断,阳性率最高达95%。F(ab)2抗体片段由两个Fab片段组合而成,可以同时与两个抗原表位结合,在临床尤其是在放射免疫治疗中应用广泛。必须强调的是,目前Fab片段和F(ab)2片段都有FDA批准的药物上市。
5.2 单链抗体( single chain Fv,scFv)
scFv由重链可变区VH和轻链可变区VL通过连接肽结合在一起,是含有完整抗原结合部位的最小抗体片段,易于大肠杆菌表达。目前所有成功制备的单链抗体都来源于基因工程手段。由于分子量较小,不仅抗原性较小,而且用于肿瘤治疗时组织穿透能力强,容易进入实体瘤内部;用于体内显像时,因不具备Fc段,所以本底较低,与传统单克隆抗体和Fab片段相比显示出优越性。
6 抗体片段的改型
6.1 纳米抗体(Nanobody)
1993年Hamers等[14]首次报道,骆驼体内有一半抗体天然缺失全长轻链和重链恒定区CH1,这种仅由单独重链可变区的抗体片段,被称为“纳米抗体”,它是最小的功能性抗原结合片段。纳米抗体性质独特,易于进行基因改造,在疾病诊断和靶向治疗等方面具有广阔的前景。
6.2 双特异性抗体(Bispecific antibody,BsAb)
双特异性抗体是通过基因工程手段将两个分别靶向不同抗原的抗体片段组合在一起,所以具有两种抗原结合位点,发挥协同作用,进而提高治疗效果[15]。这种结构设计能有效地改善抗体药物在体内的药物代谢动力学过程,增强临床治疗效果。然而,设计出疗效好、稳定性高且利于生产的BsAb仍需深入研究。
7 结语
抗体研究经历了比较曲折的发展过程。历经20世纪前期的缓慢发展,到1975年单克隆抗体技术问世,受到了相关领域学者们的高度重视,逐渐广泛用于免疫、医学、肿瘤和细胞生物学等领域。第一个应用单克隆抗体治疗是在1982年,Karr将一株抗独特型单抗应用于B细胞淋巴瘤的治疗获得成功,治疗性抗体的研究很快成为生物制药行业的热点。1986年,美国FDA批准抗CD3单抗OKT3进入市场,用于器官移植时的抗排斥反应。然而,随着研究的广泛深入,大量的临床试验结果背离了人们的期望,许多单抗在临床应用中屡遭失败,抗体的应用一度陷入低谷。此后,随着分子生物学技术的发展,情况有了很大的改观[16]。中国在研究治疗性抗体方面也取得了阶段性的成果,有很多试剂抗体或诊断用抗体进入市场。目前,中国抗体药物开发市场正处于高速发展的时期。截止2015年底,批准上市的国产单克隆抗体药物数量仅有10种。表2是已获CFDA批准的国产单克隆抗体。
国内的10个抗体药物产品中,3个是鼠源型,1个嵌合型和2个人源化单抗,另有4个Fc融合蛋白类药物,而国外市场上人源和全人源化单抗药品约占90%。
抗体人源化以及全人源抗体的制备已经成为当今治疗性抗体的发展趋势,同时,各种抗体衍生物也不断涌现,它们从不同角度克服了抗体本身的应用局限,也为治疗人类疾病提供了更多利器。
(2016年3月28日收稿)■

表2 已获CFDA批准的国产单克隆抗体
参考文献
[1] NELSON A L, DHIMOLEA E, REICHERT J M. Development trends for human monoclonal antibody therapeutics [J]. Nat Rev Drug Discov, 2010, 9: 767-774.
[2] 郭晓强. 埃德尔曼: 发现抗体结构的科学家[J]. 科学源流,2014, 11(4): 49-52.
[3] 谢蜀生. 揭开抗体多样性的奥秘[J]. 生理科学进展, 1989, 20(3): 284-286.
[4] 郭晓强. 抗体多样性遗传机制发现者——利根川进[J]. 遗传, 2012, 34(11): 1501-1504.
[5] KOHLER G, MILSTEIN C. Continuous cultures of fused cells secreting antibody of predefined specificity [J]. Nature, 1975, 256: 495-497.
[6] MORRISON S L, JOHNSON M J, HERZENBERG L A, et al. Chimeric human antibody molecules: mouse antigen-binding domains with human constant region domains [J]. Proc Natl Acad Sci USA, 1984, 81: 6851-6855.
[7] PRESTA L G. Engineering of therapeutic antibodies to minimize immunogenicity and optimize function [J]. Adv Drug Deliv Rev, 2006, 58: 640-656.
[8] JONES P T, DEAR P H, FOOTE J, et al. Replacing the complementarity-determining regions in a human antibody with those from a mouse [J]. Nature, 1986, 321: 522-525.
[9] VAUGHAN T J, OSBOURN J K, TEMPEST P R. Human antibodies by design [J]. Nat Biotechnol, 1998, 16: 535-539.
[10] WINTER G, GRIFFITHS A D, HAWKINS R E, et al. Making antibodies by phage display technology [J]. Annu Rev Immunol, 1994, 12: 433-455.
[11] BRADBURY A R, MARKS J D. Antibodies from phage antibody libraries [J]. J Immunol Methods, 2004, 290: 29-49.
[12] LONBERG N. Fully human antibodies from transgenic mouse and phage display platforms [J]. Curr Opin Immunol, 2008, 20: 450-459.
[13] LONBERG N. Human antibodies from transgenic animals [J]. Nature Biotechnol, 2005, 23: 1117-1125.
[14] RAHBARIZADEH F, AHMADVAND D, SHARIFZADEH Z.Nanobody: An old concept and new vehicle for immunotargeting [J]. Immunol Invest, 2011, 40(3): 299-338.
[15] MABRY R, SNAVELY M. Therapeutic bispecific antibodies: the selection of stable single-chain fragments to overcome engineering obstacles [J]. IDrugs, 2010, 13: 543-549.
[16] STERN M, HERRMANN R. Overview of monoclonal antibodies in cancer therapy: present and promise [J]. Crit Rev Oncol Hematol, 2005, 54: 11-29.
Pastlife of antibody and antibody drug
XU Zhuobin, WANG Min
College of Life Science & Technology, China Pharmaceutical University, Nanjing 210009, China
Antibody drug plays a critical role in biotechnology pharmaceutical feld. It is a long term goal for antibody to diagnose and treat disease by its specifc for antigen recognition. The discovery and application of antibody are inseparable from immunology. From the immune system, a detailed description of the historical process of discovery and clinical application of antibody was carried out. In recent years, cell engineering and genetic engineering technology as the main antibody engineering technology have been a hot feld of pharmaceutical biotechnology. Antibody drug development and industrialization are entering a new age rapidly.
antibody, variable region, monoclonal antibody, humanization, genetic engineering
10.3969/j.issn.0253-9608.2016.04.007
†通信作者,E-mail: minwang@cpu.edu.cn

