丹参酮乳房注入剂中有效成分含量测定
黄鑫,梁剑平,郝宝成,高旭东,郭文柱
(中国农业科学院兰州畜牧与兽药研究所∕农业部兽用药物创制重点实验室∕甘肃省新兽药工程重点实验室,兰州 730050)
丹参酮乳房注入剂中有效成分含量测定
黄鑫,梁剑平,郝宝成,高旭东,郭文柱*
(中国农业科学院兰州畜牧与兽药研究所∕农业部兽用药物创制重点实验室∕甘肃省新兽药工程重点实验室,兰州 730050)
采用高效液相色谱测定丹参酮乳房注入剂有效成分隐丹参酮和丹参酮ⅡA的含量。将供试品用正己烷萃取后挥干,甲醇溶解后检测;采用反相高效液相色谱,ZORBAX SB-C18键合硅胶柱(4.6×250 mm,5 μm);柱温30 ℃;流动相为乙腈(A)-0.026%磷酸水溶液(B),梯度洗脱(0~20 min:V(A)60→90,V(B)40→10;20~30 min:V(A)∶V(B)=90∶10);流速1.2 mL/min;检测波长270 nm。丹参酮乳房注入剂中隐丹参酮含量在500~1750 μg/g(r=0.9999)范围内线性关系良好,平均加样回收率为101.15%,RSD为1.55%;丹参酮ⅡA的含量在1125~3937.5 μg/g(r=0.9999)范围内线性关系良好,平均加样回收率为100.89%,RSD为1.64%。结果显示,该方法简单、准确、灵敏,精密度、重复性好,可作为丹参酮乳房注入剂中有效成分含量测定的参考方法。
奶牛乳房炎;含量测定;丹参酮乳房注入剂;高效液相色谱
奶牛乳房炎是奶牛养殖业中最普遍、危害最大的疾病之一[1]。据美国国家乳房炎委员会(The National Mastitis Committee)1996年的统计,全球每年因乳房炎造成的损失约350亿美元[2]。奶牛乳房炎的发生,不仅给全世界奶牛业的生产造成了巨大的经济损失,而且影响着整个畜牧业的发展[3]。随着社会经济的迅速发展,人们生活水平也日益提高,在日常膳食中牛奶已成为不可或缺的一部分,但随之而来的牛奶中抗生素残留[4]、微生物超标[5]、耐药性细菌[6]等食品安全问题也相对增多,奶牛乳房炎的防治成为世界奶牛业的难题。中草药等天然产物因残留低、毒副作用小、环保等特点引起了人们的广泛关注,中草药在奶牛乳房炎治疗中的应用也越来越普遍[7-8]。
丹参作为常用药材,具有活血化瘀,活络通痹,安心养神,解毒凉血,排脓生肌,消肿止痛,疗疮止痢等功效。丹参中含有多种有效成分,主要成分有丹参酮Ⅰ、丹参酮ⅡA、丹参酮ⅡB、隐丹参酮、二氢丹参酮等,临床上常作为杀菌消炎药使用[9]。甘志华[10]等将研制的“复方丹参液”用于隐性奶牛乳房炎的治疗,结果显示治愈率达87.55%,且高效无害、简单安全。 据报道,丹参还具有抗肿瘤、抗抑郁、抗衰老、提高机体免疫力等作用[11]。丹参酮乳房注入剂是由中国农业科学院兰州畜牧与兽药研究所研发的一种用于治疗奶牛乳房炎的纯中药制剂,其主要成分是中药丹参通过乙醇提取所得,再按一定比例与油质辅料配制而成。药效学和临床实验显示其用于奶牛乳房炎的治疗效果显著,丹参酮高剂量组治愈奶牛临床型乳房炎乳区数可达72.22%,显著优于双丁对照组,治疗后的患牛临床症状明显改善[12-13]。为了更好地控制丹参酮乳房注入剂的质量,确保临床安全用药,建立丹参酮乳房注入剂的质量标准,本文参考已有文献[14-15],建立了更加简单、准确、灵敏的丹参酮乳房注入剂有效成分的高效液相色谱的定量检测方法。
1 材料与方法
1.1 仪器设备与材料 超高效液相色谱仪(Agilent 1290,配置真空脱气机、二元泵、自动进样器、柱温箱、二极管阵列检测器等),美国Agilent 公司;KH-300DB 型数控超声波清洗器,昆山禾创超声仪器有限公司;电子分析天平,德国sartorius 公司;HH-S4氮气吹干仪,郑州长城科工贸有限公司; MX-S旋涡混合器,美国 scilogexscilogex公司。
含量测定对照品:隐丹参酮,批号:110852-201506,HPLC≥98.9%,中国食品药品检定研究院;丹参酮ⅡA,批号:110766-201520,HPLC≥98.9%,中国食品药品检定研究院。
供试品:丹参酮乳房注入剂(批次:20130806、20130808、20130810),承德金奥生物技术开发有限公司试制。
试剂:色谱纯甲醇、乙腈,美国赛默飞世尔(Fisher Scientific)公司;异丙醇(色谱纯,批号:2015080601),山东禹王实业有限公司化工分公司;磷酸(分析纯,批号:20150601),烟台市双双化工有限公司;水为屈臣氏蒸馏水。
1.2 色谱条件 色谱柱:Agilent ZORBAX SB-C18键合硅胶柱(4.6×250 mm,5 μm);流动相:以乙腈为流动相A,以0.026%磷酸(取520 μL磷酸加入至2 L超纯水中,即得)溶液为流动相B,按表1中的规定进行梯度洗脱;检测波长270 nm;柱温30 ℃;流速1.2 mL/min。

表1 梯度洗脱流动相比例
1.3 溶液配制的方法
1.3.1 对照品溶液配制 分别精密称取隐丹参酮和丹参酮ⅡA标准品20、45 mg置于100 mL容量瓶中,用甲醇溶解并定容,制备成每1 mL约含隐丹参酮200 μg和丹参酮ⅡA 450 μg的200%混合标准品储备液。
1.3.2 供试品溶液配制 精密量取丹参酮乳房注入剂2 g,加入乙腈30 mL,用力振摇3 min,再加入正己烷10 mL,用力振摇3 min,静置至分层;取下层溶液,再加入正己烷10 mL,振摇3 min,静置至分层;取下层溶液置于蒸发皿中,氮气吹干,再用甲醇溶解,定容至25 mL容量瓶中,然后用0.2 μm有机滤膜过滤,弃去初滤液,保留后续滤液,即得。
2 结果与分析
2.1 系统性实验
2.1.1 专属性 将配制好的对照品溶液和已知批次(20130806)丹参酮乳房注入剂供试品溶液,按色谱条件进行分析,分析结果如图1(A、B)所示。

图1 对照品和样品的HPLC 色谱图(1为隐丹参酮峰,2为丹参酮ⅡA峰,3为杂质峰)
2.1.2 中间精密度 在色谱条件下,将配制好的同一批次(批号:20130806)供试品溶液连续进样5 d,每天重复进样3次,记录隐丹参酮和丹参酮ⅡA的峰面积,得到中间精密度(表2)。
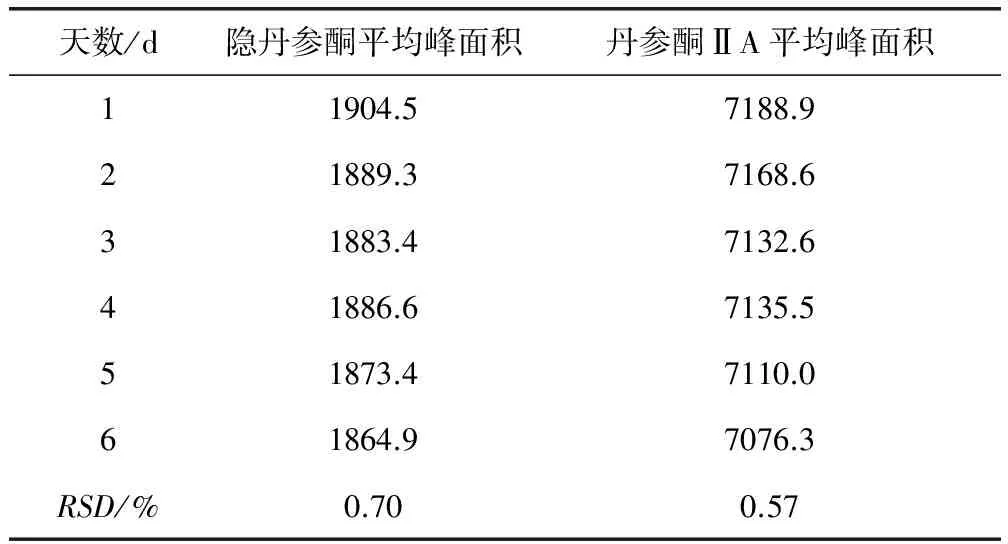
表2 丹参酮乳房注入剂的中间精密度
2.2 标准曲线与线性范围 按照试验用色谱条件,将200%标准品储备溶液梯度稀释成6个浓度(140%、120%、100%、80%、60%、40%),然后按表1中的方法进行分析,每个浓度的对照品溶液重复进样3次,分别记录图谱中各浓度隐丹参酮和丹参酮ⅡA的峰面积。分别以隐丹参酮和丹参酮ⅡA对照品溶液的浓度(μg/mL)为横坐标(X),平均峰面积为纵坐标(Y)进行回归分析,绘制标准曲线,得出回归方程(表3)。
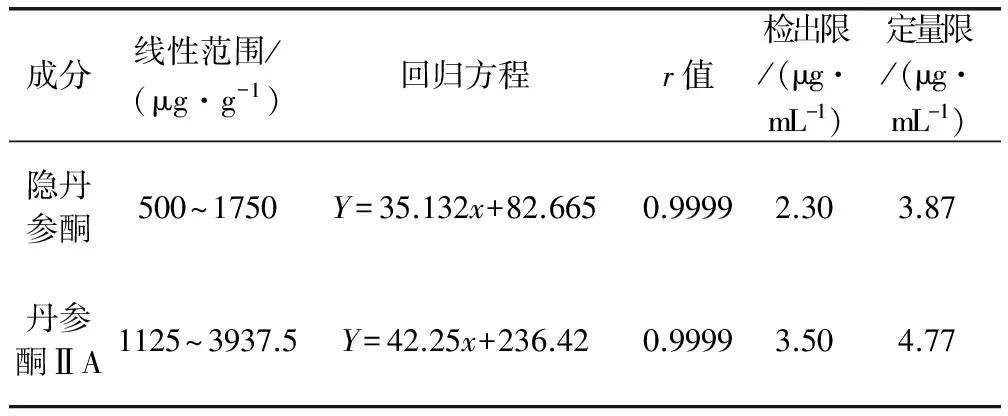
表3 丹参酮乳房注入剂中主要成分的回归方程、线性范围、检出限和定量限
2.3 加样回收 精密量取已测定含量的同一批次(20130806)样品6份,每份样品中各加入一定适量的隐丹参酮和丹参酮ⅡA标准品溶液,然后按照供试品溶液制备方法,将样品萃取挥干,用甲醇定容至25 mL容量瓶中,备用。在已选定的色谱条件下进样分析,记录峰面积并分别计算隐丹参酮和丹参酮ⅡA的加样回收率,结果见表4、表5。
2.4 重复性 精密称取6份同一批次(20130806)丹参酮乳房注入剂样品,每份按照供试品配制方法将其配制成同一浓度的供试品溶液,然后按照色谱条件进行分析,每份样品重复3次进样,记录色谱图,求得丹参酮乳房注入剂中隐丹参酮的平均含量为643.25 μg/g,RSD为1.56%;丹参酮ⅡA的平均含量为1895.38 μg/g,RSD为1.62%。
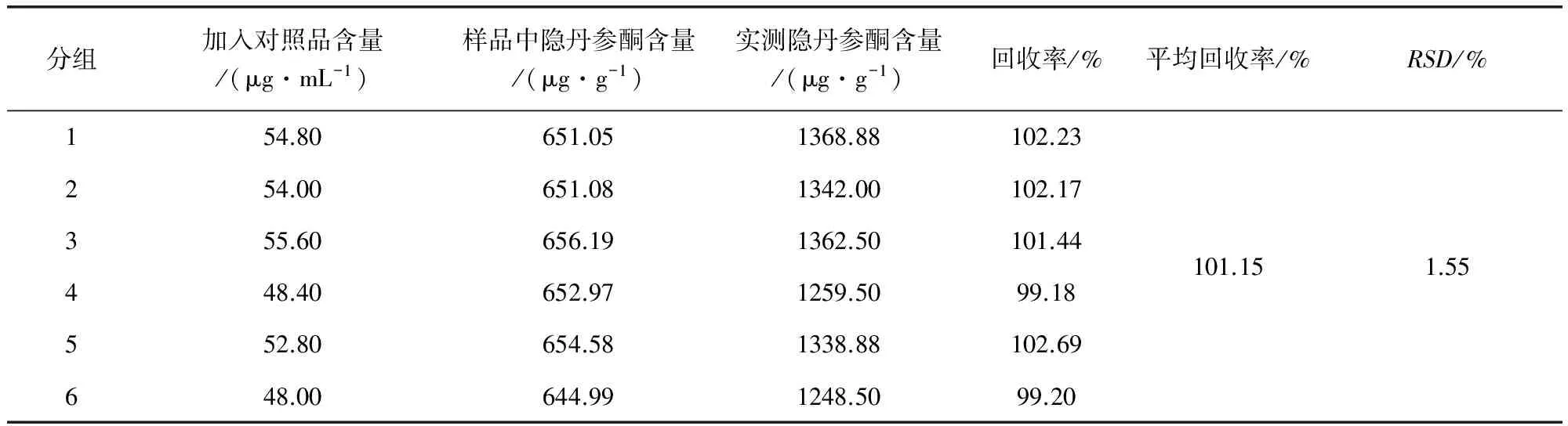
表4 样品中隐丹参酮加样回收率
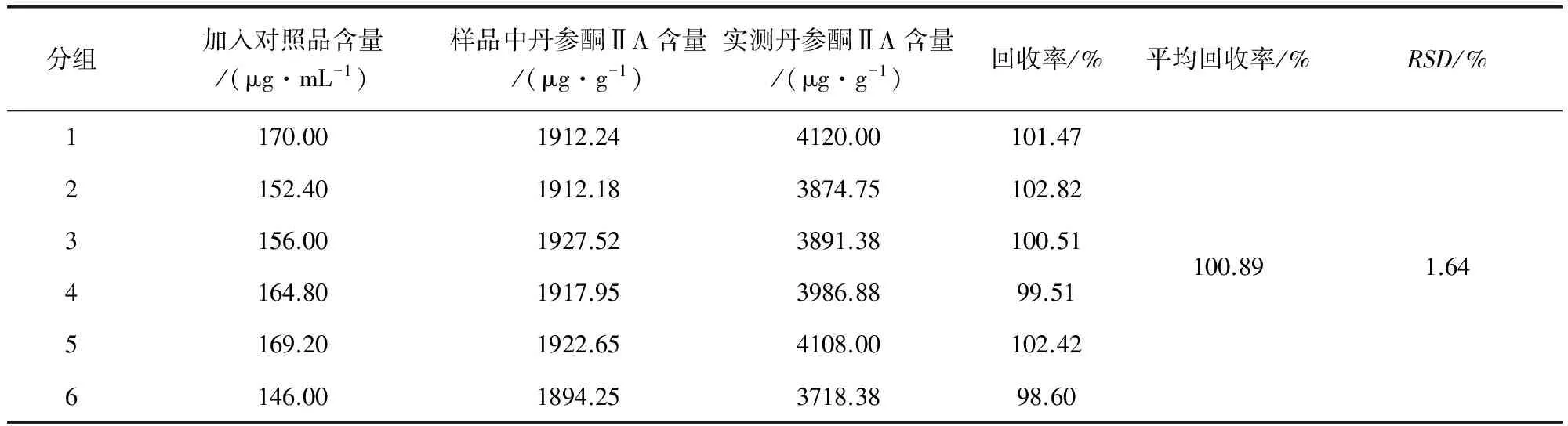
表5 样品中丹参酮ⅡA加样回收率
2.5 样品含量测定 取不同批次(20130806、20130808、20130810)供试样品,每个批次样品取3份,依照供试品配制方法制备,在实验色谱条件下进样,计算含量,结果如表6所示。

表6 丹参酮乳房注入剂中主要成分的含量测定结果
3 讨论与小结
3.1 检测波长的选择 结合紫外吸收光谱图以及2010年版《中国兽药典》中对丹参提取物的高效液相色谱检测方法,参考其最大吸收波长,以确保试验灵敏度较高,选择在270 nm波长下检测丹参酮乳房注入剂中主要有效成分隐丹参酮和丹参酮ⅡA的含量,并且在方法验证耐用性研究中证实270 nm是其有效成分的最适波长。
3.2 溶剂的选择与样品前处理的方法 由于丹参提取物中有效成分均不溶于水等溶剂,所以溶剂选取和样品前处理方法对丹参酮乳房注入剂中有效成分隐丹参酮和丹参酮ⅡA的含量检测影响较大。在选用溶剂溶解隐丹参酮和丹参酮ⅡA的标准样品实验中发现,甲醇、乙腈和丙酮等均能使其溶解,但考虑到甲醇的毒性和刺激性较小,所以选定甲醇为溶剂。
在样品的前处理过程中,由于丹参酮乳房注入剂的辅料是植物油,黏性较大,且不溶于甲醇等溶剂,检测时容易损坏色谱柱,所以采用乙腈和正己烷进行液液萃取的方式,将样品中的有效成分隐丹参酮和丹参酮ⅡA萃取在溶剂乙腈中,再将乙腈挥发后溶于甲醇中进行检测。本研究还对样品的溶解方法做了考察,经比较超声溶解优于手动振荡溶解;使用氮气挥干仪优于常温挥发和水浴挥发,因此样品处理选择乙腈萃取后氮气吹干,用甲醇超声溶解。
3.3 流动相及柱温的优化 在查阅了大量丹参提取物液相检测方法并参照《中国兽药典》后,选择乙腈和磷酸水溶液作为流动相,并利用梯度洗脱的方法检测,方法验证耐用性实验结果显示,在此流动相下对照品出峰良好,符合要求,最终确定流动相乙腈(A)-0.026%磷酸水溶液(B)梯度洗脱,0~20 min时V(A)(60→90),V(B)(40→10),20~30 min时V(A)∶V(B)为90∶10,在此条件下检测时,目的峰峰形较好,无拖尾。
柱温对样品中隐丹参酮和丹参酮ⅡA的峰型均有影响,尤其以隐丹参酮的影响最为严重,在隐丹参酮出峰前后有一较高峰伴随,如果柱温太低,则达不到分离效果,提高柱温能很好的改善峰型,但考虑到样品中有效成分对温度较为敏感,选择柱温为30 ℃。
丹参酮乳房注入剂是一种新的治疗奶牛乳房炎的纯中药制剂,主要药效成分为隐丹参酮和丹参酮ⅡA,临床试验显示其对奶牛乳房炎具有良好的效果,临床应用前景广阔。本文建立的高效液相色谱(HPLC)检测丹参酮乳房注入剂中有效成分含量的方法,峰型对称性较好,分离度、回收率较高,且此方法操作简单、准确,精密度、重复性好,可作为丹参酮乳房注入剂质量监控的参考方法。
[1] 雷晓峰, 赵晏, 雷英鹏. 奶牛乳房炎的危害及防治[J]. 畜牧兽医科技信息, 2011,(5):46-47.
[2] 米耀荣,郭生泉,张 勇,等.奶牛乳房炎的危害及其防治措施[J].畜牧与饲料科学,2009,30(13910):163-164.
[3] 阚远征. 奶牛乳房炎引发的经济损失[J]. 乳业科学与技术,2006,2:93-94.
[4] 宁海容,彭瑛,金兴良,等.牛奶中抗生素残留检测研究进展[J].中国畜牧兽医,2012,39(27208):227-230.
[5] 李菲,董文宾,高洁,等.牛奶中微生物检测技术研究进展[J].食品科技,2008,20006:181-183.
[6] 张咚咚,陈丹瑾,刘继超,等.奶牛乳房炎细菌耐药菌的筛选及菌株鉴定——基于北京某规模牛场的调查[J].中国畜牧杂志,2015,5112:68-73.
[7] 孙占武,苏禹刚.中草药在防治奶牛乳腺炎中的应用[J].中国畜禽种业,2016,1201:82-83.
[8] 刘长彬,罗小玲,康立超,等.复方中草药对奶牛乳品质的影响[J]. 江苏农业科学,2016,4401:239-242.
[9] 谷雨,谷巍,于淑莲. 丹参药理作用的研究进展[J].人参研究,2007,7501:25-27.
[10]甘志华,李启良,蒋武成,等.复方丹参液治疗奶牛隐性乳房炎试验[J]. 湖南农学院学报,1995,1:84-88.
[11]马丙祥,董宠凯. 丹参的药理作用研究新进展[J]. 中国药房,2014,25(46907):663-665.
[12]刘一霖. 丹参酮乳房注入剂对乳房炎常见致病菌抑菌作用及临床疗效研究[D].杨凌:西北农林科技大学,2014.
[13]叶文初,班赟,袁富威,等.丹参酮乳房注入剂对奶牛乳房炎的临床治疗试验[J].黑龙江畜牧兽医,2016,49301:185-187.
[14]汤瑶,李佐刚,王秀文,等. 超高效液相色谱法同时测定丹参酮提取物中隐丹参酮、丹参酮Ⅰ和丹参酮Ⅱ_A[J]. 药物分析杂志,2014,3405:813-818.
[15]王加文,洪建华,晏永新,等.丹参提取物的质量标准研究[J]. 河北化工,2008,15010:19-23.
(编辑:侯向辉)
Determination of Active Ingredient Content in Tanshinone Injection Agent for the Treatment of Bovine Mastitis
HUANG Xin,LIANG Jian-ping, HAO Bao-cheng, GAO Xu-dong, GUO Wen-zhu*
(LanzhouInstituteofHusbandryandPharmaceuticalSciencesofCAAS,KeyLaboratoryofNewAnimalDrugProject,GansuProvince,KeyLaboratoryofVeterinaryPharmaceuticalDevelopment,MinistryofAgriculture,Lanzhou730050,China)
This study is aimed to establish a high performance liquid chromatography (HPLC) method to determine the active ingredient in tanshinone injection agent for the treatment of bovine mastitis. Samples were dried with hexane extraction and analyzed by reverse phase high performance liquid chromatography after dissolved with methanol.The target cryptotanshinone and tanshinone II A were separated on a ZORBAX SB-C18 column (4.6×250 mm, 5 μm) using acetonitrile(A) and 0.026% phosphoric acid solution(B) (0~20 min,V(A)60→90,V(B)40→10;20~30 min:V(A)∶V(B)=90∶10) as the mobile phase by gradient elution, the flow rate was 1.2 mL/min with colomn temperature of 30 ℃ and detection wavelength of 270 nm. The content of cryptotanshinone in tanshinone injection agent for the bovine mastitis showed good linear relationship at the range of 500~1750 μg/g(r=0.9999), the average recovery was 101.15% with the relative standard deviation of 1.55%. The other content of tanshinone II A in it also displayed a good linear relationship at the range of 1125~3937.5 μg/g (r=0.9999), The average recovery was 100.89% with the relative standard deviation of 1.64%. The results showed that the method demonstrated advantage of simpleness, accuraty and sensitivity, and successfully applied to the analysis of cryptotanshinone and tanshinone II A in tanshinone injection agent for the bovine mastitis.
bovine mastitis;determination of content;tanshinone injection agent for the bovine mastitis;HPLC
黄鑫,在读硕士,从事天然兽用药开发与应用工作。
郭文柱。E-mail:417052657@qq.com
2016-05-26
A
1002-1280 (2016) 09-0053-05
S859.2

