猪霍乱沙门菌菌蜕的制备及免疫保护效力研究
单晓枫,陈龙,李茂辉,康元环,孙武文,张伟,钱爱东
(吉林农业大学动物科学技术学院,长春 130118)
猪霍乱沙门菌菌蜕的制备及免疫保护效力研究
单晓枫,陈龙,李茂辉,康元环,孙武文,张伟,钱爱东*
(吉林农业大学动物科学技术学院,长春 130118)
为制备猪霍乱沙门菌菌蜕并研究其免疫保护效力,克隆噬菌体phiX174裂解基因E,与pBV220连接,构建温控溶菌表达载体,将该载体转入猪霍乱沙门菌TTB1中,制备菌蜕并对其裂解率、安全性以及对小鼠的免疫保护效力进行了研究。结果显示:成功克隆了裂解基因E、片段大小274bp,构建了温控溶菌质粒载体pBVE,制备了猪霍乱沙门菌菌蜕,其裂解率最高为99.46%、经冻干灭活残余活菌,安全性试验检测证实其安全后,对小鼠进行了免疫保护试验,其保护率为70%、与弗氏佐剂灭活苗保护率相当、优于甲醛灭活苗。研究为猪霍乱沙门菌感染的防治奠定了基础。
猪霍乱沙门菌;菌蜕;免疫保护效力;裂解基因E;裂解效率
猪霍乱沙门菌(Salmonellacholeraesuis)是沙门菌属的一个代表种,其可以感染2~4月龄的仔猪,引起败血症计肠炎,是仔猪副伤寒的主要病原菌之一[1-2]。此外,该菌也侵害其他动物,还引起人类的食物中毒、伤寒、败血症等,是典型的人兽共患病原菌[3-4]。预防猪霍乱沙门菌感染的有效手段是疫苗接种,目前,国内已有减毒疫苗使用[5],但减毒活疫苗存在毒力返强以及与野毒株发生重组而出现新毒菌株的危险。
菌蜕(bacterial ghost)是近年来新发展起来的一种新型死菌苗,其一般是由phiX174噬菌体的裂解蛋白E,在格兰阴性菌表面形成一种特异性跨膜通道,胞内物质通过通道排出,从而形成一个菌体完好、表面抗原结构完整的细菌空壳[6]。由于菌蜕的各种表面抗原结构完整,因此具有良好的免疫原性;而且,抗原蛋白、核酸等均可导入菌蜕中,因此菌蜕是良好的递送系统具有很好的佐剂功能[7-8]。
目前,我国沙门菌菌蜕的研究并不多见[9-10],而有关猪霍乱沙门菌菌蜕的研究更未见报道,鉴于此,研究通过构建猪霍乱沙门菌菌蜕,并对其免疫保护效力进行研究,为猪霍乱沙门菌引发疾病的预防奠定基础。
1 材料与方法
1.1 菌株与质粒 猪霍乱沙门菌TTB1,吉林农业大学预防兽医学实验室分离并保存;大肠杆菌DH5α,全式金公司;pBV220,上海北诺生物科技有限公司;大肠杆菌噬菌体phiX174 RFI DNA,BioLabs公司。
1.2 主要试剂 ExTaq DNA聚合酶、dNTP、限制性内切酶(PstI和BamHⅠ)、T4连接酶、pMD18-T载体等,TaKaRa公司;质粒提取试剂盒、氨苄西林(Amp)、胶回收试剂盒,北京索莱宝生物公司;其余均为国产或进口分析纯。
1.3 裂解基因E的克隆 依据phiX174 RFI裂解基因E序列设计一对引物:P1: GGATCCATGGTACGCTGGACTTTG(下划线为限制性酶切位点BamHI)、P2:CTGCAGTCACTCCTTCTGCACGTA(下划线为限制性酶切位点PstI),并送至华大基因公司合成。
以phiX174 RFI基因组为模板,PCR扩增裂解基因E,扩增条件为:94℃ 4min,94℃1min,53℃ 1 min,72℃ 1 min,30循环,72℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测并回收,与pMD18-T载体16℃连接过夜,构建重组质粒pMD18T-E,转入DH5α,经PCR及双酶切鉴定,阳性克隆送至华大基因公司测序。
1.4 溶菌质粒载体的构建 用PstI和BamHⅠ双酶切pMD18T-E与pBV220质粒,酶切反应条件:37℃ 2h、30℃ 2 h,分别回收目的片段,16℃连接过夜,并转化至DH5α内,PCR鉴定,阳性者送至华大基因公司测序,并将重组质粒命名为pBVE。
1.5 猪霍乱沙门菌菌蜕的制备 将溶菌质粒pBVE转化入自制的猪霍乱沙门菌感受态细胞中,Amp抗性筛选,挑取白色菌落接种于5 mL含Amp的液体LB培养基中,28℃过夜,提取质粒,PCR鉴定,阳性克隆继续扩增培养,并于次日取100 μL转至50 mL液体LB中,28℃ 170 r/min,培养至OD600为0.4时,升温42℃,诱导6 h,测定OD600及活菌数,以此观察裂解效果。
1.6 裂解率测定及电镜观察 分别计算42℃诱导前后的活菌数,依据公式:裂解率=(1-诱导后CFU/诱导前CFU)×100%,计算裂解率。
将收集的菌蜕按参考文献[9]方法处理,并使用扫描电镜观察。
1.7 菌蜕安全性试验 将制备的猪霍乱沙门菌菌蜕经冻干处理,以破坏活菌菌体,经无菌检验合格,免疫注射健康小鼠10只,每只1.0 mL。连续观察14 d小鼠健康状况,同时设PBS作为对照。
1.8 菌蜕免疫保护效力实验 分别制备猪霍乱沙门菌的甲醛灭活苗、弗氏佐剂灭活苗,并无菌检验。
将120只6~8周龄昆明鼠随机分为灭活组、灭佐组、菌蜕BG组、PBS组等4组,30只/组。其中,灭活组、灭佐组、菌蜕BG组免疫剂量为1×108CFU/只,PBS组每只注射200 μL无菌PBS。共分为3免、两周免疫1次。将三免后的小鼠分别感染猪霍乱沙门菌TTB1,5×108CFU/只,连续观察14 d,记录并计算免疫保护率。
2 结果
2.1 噬菌体phiX174裂解基因E的克隆 以phiX174基因组为模板,PCR扩增裂解基因E,电泳结果显示:在300 bp左右有目的条带(图1)连接pMD18-T,构建pMD18T-E,经双酶切与PCR鉴定,阳性克隆者测序,结果显示扩增的DNA片段长274 bp,经比对,与phiX174裂解基因E同源性为100%。
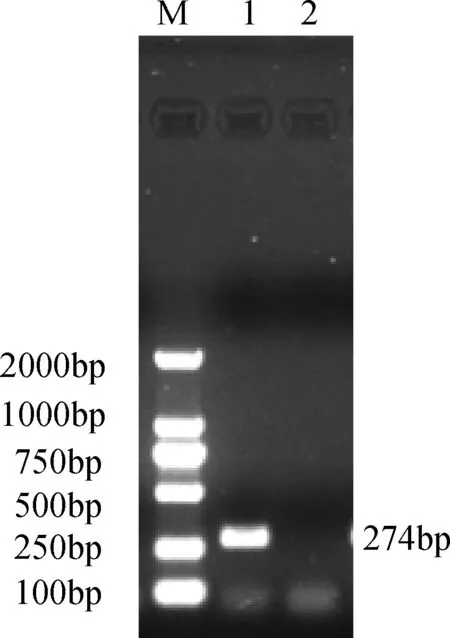
M:DL2000 ;1:裂解基因E; 2:阴性对照图1 裂解基因E PCR扩增产物电泳图
2.2 溶菌质粒载体的构建 将重组质粒pBVE双酶切,并电泳检测,其出现两条目的条带,与预期结果相符(图2)。温控溶菌质粒载体构建成功。
2.3 猪霍乱沙门菌菌蜕株的鉴定
pBVE转化至猪霍乱沙门菌感受态细胞中,Amp抗性筛选,出现白色单个菌落(图3),挑取并扩增培养,PCR鉴定,出现目的条带,菌蜕株制备成功。将菌蜕株28℃ 170 r/min培养至OD6000.4时,开始42℃诱导6 h,其OD600值上升、单活菌数下降。
2.4 裂解率的测定与扫描电镜观察 通过活菌计数,诱导前活菌数为6.1×107CFU/mL,诱导后活菌数为3.3×105CFU/mL,依据公式,裂解率为99.46%。冻干处理后,无活菌存在。
经扫描电镜观察,溶菌孔道位于细菌的两端,有大量内容物排出,细菌形态基本没有改变,但有明显皱缩(图4)。
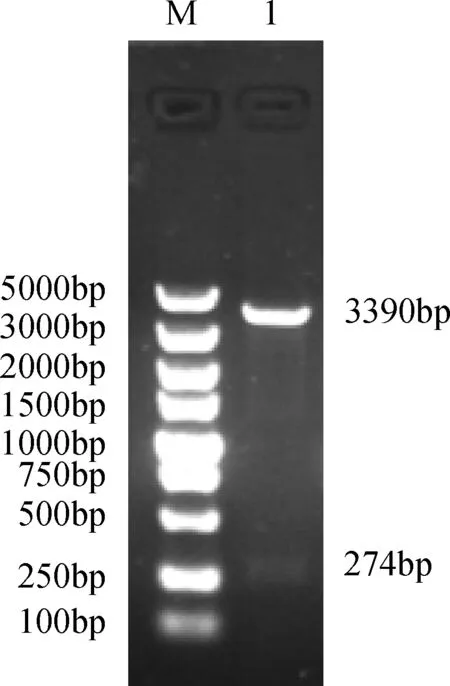
M:DL 5000 ;1:质粒pBVE双酶切鉴定图2 重组表达质粒pBVE酶切鉴定结果
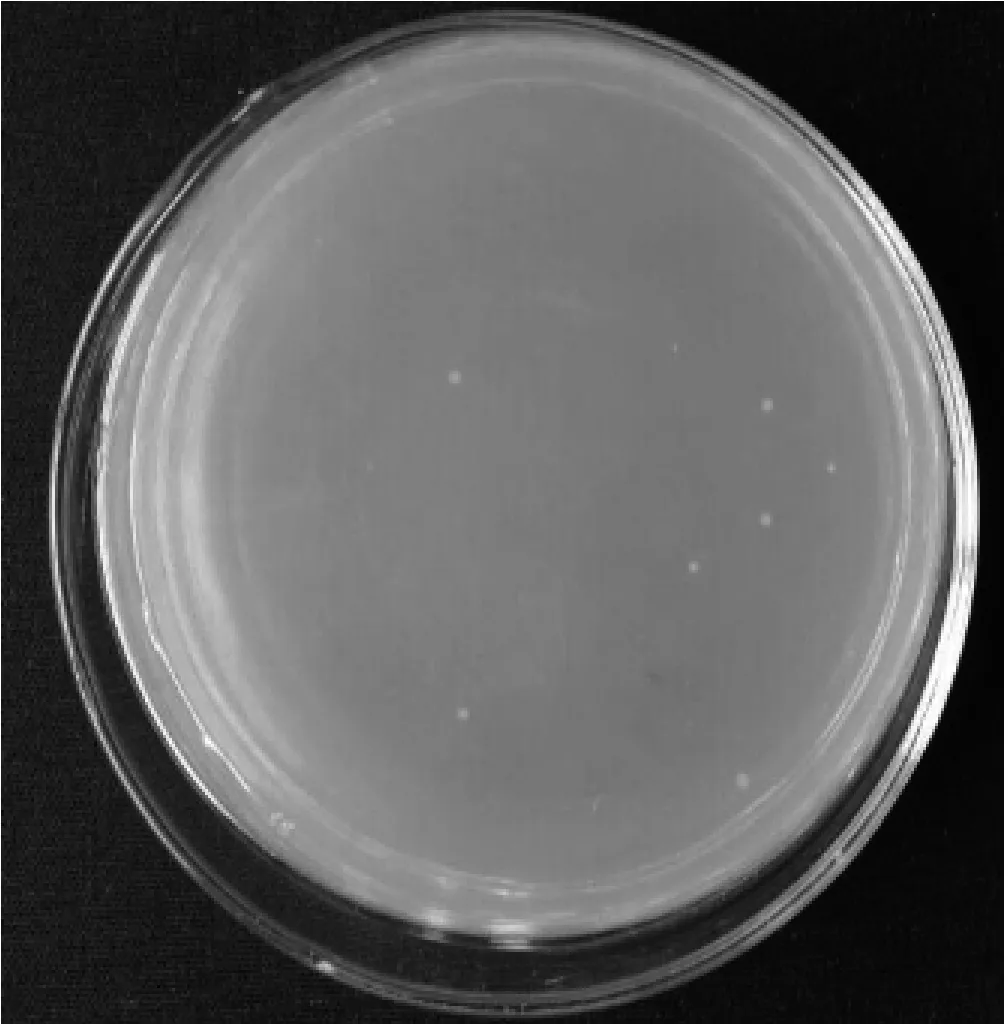
图3 沙门氏菌重组菌株生长结果图

图4 猪霍乱沙门菌TTB1菌蜕扫描电镜图片(20000×)
2.5 菌蜕安全性与免疫保护效力试验 将菌蜕与PBS分别免疫小鼠,二组小鼠在一周内均出现体重略有下降、一周后恢复正常的现象,其余无临床异常现象。
用猪霍乱沙门菌TBB1对免疫后的小鼠进行攻毒试验,结果显示:菌蜕BG组、甲醛灭活组、佐剂灭活组的保护率分别是:70%、60%、70%,PBS对照组发病死亡。
3 讨论
菌蜕是革兰阴性菌以物理化学方法制备的细菌空壳,其有多种制备方法。本研究是以温控表达系统控制phiX174裂解基因E的表达,在42℃发挥最大裂解效应,从而实现猪霍乱沙门菌的裂解,进而制备菌蜕。
通过前期试验摸索,当沙门菌28℃生长至OD600为0.4左右时,开始42℃诱导,可达到理想效果,但如果大于0.4,则裂解效率较低。因此,本实验在沙门菌28℃生长至OD600为0.4左右时42℃诱导6 h,裂解效率最高可达99.46%。但在诱导7 h甚至更长时间时,仍可检测到活菌存在,这与温晶、吕敏娜等[10-11]研究结果类似。而未被裂解的活菌蜕株膜上存有裂解E蛋白,如果进行无保护剂的冻干,其要比没有携带E蛋白的菌株更易破裂[12],因此,为保证菌蜕使用的安全性,本研究采用冻干法将残余活菌灭活。
在正式免疫试验之前,本研究对菌蜕以及其他2种疫苗进行动物安全性试验,结果显示,三种疫苗均安全可以进行下一步试验。而在安全性试验中,所有免疫小鼠(包括PBS组)均出现体重暂时下降,而后有恢复正常,出现这种现象的原因可能与免疫注射产生的应激有一定关联。虽然免疫保护效力试验显示,菌蜕组与佐剂灭活苗组的免疫保护效力相当,但是菌蜕不含有甲醛、对机体没有不良刺激,且菌蜕有佐剂功能、没有遗传物质[13-15],因此,菌蜕与传统疫苗相比,其生物安全性更高,具有更好的应用前景。
本研究成功的构建了温控溶菌质粒载体pBVE,制备了猪霍乱沙门菌菌蜕,小鼠试验表明,其具有一定的保护力。研究为猪霍乱沙门菌菌蜕的临床应用奠定基础。
[1] John S G, Joanna M M, Stephen B,etal. Salmonella chronic carriage: epidemiology, diagnosis, and gallbladder persistence[J]. Trends in Microbiology, 2014 ,22(11): 648-655.
[2] 王蓓,杨环,尚宏霞,等.三级综合医院69 株沙门菌分布特征及耐药性分析[J].海南医学,2016,27(3):428-430.
[3] 宗萍,詹震泽.人血流感染猪霍乱沙门菌8 例临床分析[J].吉林医学,2015,36(3):470.
[4] 加春生,毛泽明,耿明杰,等.猪沙门菌分离株的毒力及耐药特征[J].中国兽医科学,2015,45(02):190-194.
[5] 徐黎娟,李求春,刘杰,等.猪霍乱沙门菌疫苗株C500毒力致弱的主要原因是rpos基因的缺失[J].中国人兽共患病学报,2015,31(10):908-913.
[6] Gentschev I, Dietrich G, Spreng S,etal. Recombinant attenuated bacteria for the delivery of subunit vaccines[J]. Vaccine, 2001, 19(17-19): 2621-2628.
[7] Nishikawa H, Tsuji T, Jager E,etal. Induction of regulatory T cell-resistant helper CD4+ T cells by bacterial vector[J]. Blood, 2008, 111(3):1404-1412.
[8] Reschel T, Konak C, Oupicky D,etal. Physical properties and in vitro transfection efficiency of gene delivery vectors based on complexes of DNA with synthetic polycations[J]. J Control Release, 2002, 81(1-2):201-217.
[9] 郭荣显,耿士忠,焦红梅,等.噬菌体裂解E蛋白介导鸡白痢沙门菌跨膜孔道的电镜观察[J].电子显微镜学报,2014,33(1):80-83.
[10]温晶,寇志华,于虹,等.人伤寒沙门菌Ty21a菌蜕的制备[J].中国人兽共患病学报,2011,27(6):479-483.
[11]吕敏娜,覃宗华,余劲术,等.鸭源大肠杆菌O78菌蜕的制备及免疫原性研究[J].中国预防兽医学报,2010,09(32):712-715.
[12]吴忆春.猪大肠杆菌O139菌影的制备及其裂解效率[J].中国兽医科学,2013,43(05):476-479.
[13]Paukner S, Stiedl T, Kudela P,etal. Bacterial ghosts as a novel advanced targeting system for drug and DNA delivery[J]. Expert Opin DrugDeliv, 2006, 3(1):11-22.
[14]Kudela P, Paukner S, Mayr U B,etal.Bacterial ghosts as novel efficient targeting vehicles for DNA delivery to thehuman monocyte-derived dendritic cells[J]. J Immunother, 2005, 28(2):136-143.
[15]Ebensen T, Paukner S, Link C,etal. Bacterialghosts are an efficient delivery system for DNA vaccines[J]. J Immunol, 2004, 172(11):6858-6865.
(编辑:陈希)
Preparation and Immune Efficacy ofSalmonellacholeraesuisGhost
SHAN Xiao-feng,CHEN Long,LI Mao-hui,KANG Yuan-huan,SUN Wu-wen,ZHANG Wei,QIAN Ai-dong*
(CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun,Jilin130118,China)
In order to develop aSalmonellacholeraesuisbacterial ghost vaccine and investigate its protective immunity. This study, we cloned the lysis gene E from phage phiX174 and inserted into an temperature-induced expression plasmid pBV220 vector,and then wastransformed intoSalmonellaTTB1.We created theSalmonellacholeraesuisghost and studied its lytic efficiency and protective immunity. The results showed that the lysisgene E about 274 bp was clone, the temperature-induced lytic plasmid pBVE andSalmonellacholeraesuisbacterial ghost were created.The lysis rate can be 99.46%and no life bacteria survived after freeze drying, The results of protective immunity showed thatSalmonellaghost group providethe protection rate of 70%, The protection rate ofplasmid-typeSalmonellaghost vaccine strain was comparable with that ofSalmonellainactivated vaccine with adjuvant, which was better than that of the inactivated vaccine. The research provides a foundation for the prevention and treatment of diseases caused bySalmonellacholeraesuis.
Salmonellacholeraesuis; bacterial ghost; protective immunity; lysis gene E; lysis efficiency
吉林省现代农业产业技术体系建设项目(201634)
单晓枫,博士,副教授,从事动物细菌学方面的研究;陈龙,博士研究生,从事动物分子细菌学方面研究,与单晓枫为共同第一作者。
钱爱东。E-mail: qianaidong0115@163.com
2016-07-15
A
1002-1280 (2016) 09-0022-04
S852.61

