三种不同灭活方法对新城疫病毒血凝和RT-PCR试验结果的影响
陈羽琪,南文龙,秦立得,巩明霞,张悦勇,陈义平
(1.中国动物卫生与流行病学中心诊断试剂研究室,山东青岛 266032;2.西交利物浦大学生物科学系,江苏苏州 215123)
三种不同灭活方法对新城疫病毒血凝和RT-PCR试验结果的影响
陈羽琪1,2,南文龙1,秦立得1,巩明霞1,张悦勇1,陈义平1
(1.中国动物卫生与流行病学中心诊断试剂研究室,山东青岛 266032;2.西交利物浦大学生物科学系,江苏苏州 215123)
为研究热灭活、甲醛、β-丙内酯(BPL)三种不同灭活方法对新城疫病毒(NDV)血凝和RT-PCR试验结果的影响,将收获的NDV鸡胚尿囊液分别用浓度为0.1%~0.5%的甲醛37 ℃灭活24 h或4 ℃灭活48 h、浓度为0.02%~0.2%的BPL 37 ℃灭活9 h、60 ℃热灭活30~90 min,并于灭活前后进行血凝试验和RT-PCR检测。结果表明,用0.02%的BPL 37 ℃灭活9 h或0.1%的甲醛4 ℃灭活48 h,不影响NDV的血凝价;采用热灭活30 min或0.02%的BPL 37 ℃灭活9 h,不影响NDV核酸检测。本研究可为相关病原检测以及诊断制品制备过程中灭活方法的选择提供参考。
新城疫病毒;灭活;血凝;RT-PCR
在动物疫病检测时,为确保生物安全,常需对临床样品或分离培养的病原微生物进行灭活处理。灭活也是动物疫病诊断制品制备过程中的重要环节,通过灭活可有效消除制品在使用过程中潜在的病原扩散风险。常用的物理灭活方法包括热、超声波、紫外线和γ-射线等,化学灭活方法包括甲醛、戊二醛、β-丙内酯(beta-propiolactone, BPL)、二乙烯亚胺、盐酸聚六亚甲基胍等[1]。不同处理方法的灭活原理不同,灭活时对病原微生物组分(如蛋白、核酸等)造成的破坏也有所差异。灭活后,进行疫病检测分析时,其检测结果与灭活前相比会受到不同程度的影响。本研究以新城疫病毒(Newcastle disease virus,NDV)为模型,分别研究热、甲醛及BPL这3种常用灭活方法对其血凝(HA)和RT-PCR试验结果的影响,以期为相关病原检测及诊断制品制备过程中灭活方法的选择提供参考。
1 材料与方法
1.1 主要材料 NDV La Sota株,由中国动物卫生与流行病学中心提供;10日龄SPF鸡胚,购于济南斯帕法斯家禽有限公司;甲醛购自国药集团化学试剂有限公司;BPL购自Serva公司;病毒RNA提取试剂盒购自康为世纪公司;TransScript II One-Step RT-PCR SuperMix检测试剂盒购自全式金公司。
1.2 病毒扩增 用灭菌生理盐水将NDV La Sota种毒进行10-4稀释,尿囊腔接种10日龄SPF鸡胚,0.1mL/枚,接种后置37 ℃继续孵化,弃去24 h内死亡鸡胚,取出随后死亡的鸡胚置4 ℃,120 h时取出全部鸡胚,收获鸡胚尿囊液。4 ℃ 2500 r/min离心10 min,取上清,测定血凝价。
1.3 病毒灭活
1.3.1 甲醛灭活 40%的甲醛溶液经稀释后加入到5份等量的100 mL NDV病毒液中,充分混匀,使甲醛终浓度分别为0.1%、0.2%、0.3%、0.4%、0.5%。将5份含有不同甲醛终浓度的NDV病毒液分为两组,一组置37 ℃灭活24 h,另一组置4 ℃灭活48 h。
1.3.2 BPL灭活 将BPL溶液稀释后加入到5份等量的100 mL NDV病毒液中,充分混匀,使BPL终浓度分别为0.02%、0.025%、0.05%、0.1%、0.2%,置37 ℃灭活9 h。1.3.3 热灭活 将3等份NDV病毒液(100 mL/份)置60 ℃水浴中,分别灭活30 min、60 min、90 min。
1.4 灭活检验 取上述灭活样品各5 mL,参照《兽用生物制品质量标准》[2]附录中灭活检验法。将各灭活留样,接种10日龄SPF鸡胚,0.1 mL/枚,每个样品接种6枚。接种后置37 ℃继续孵化,每日照蛋2~4次,随时取出死亡鸡胚并置4 ℃,活胚继续孵化至120 h时,然后取出所有鸡胚,置4 ℃过夜,收获尿囊液并测定血凝价。将24 h鸡胚死亡数≤1,48~120 h无死亡胚,且尿囊液HA=0的灭活样品视为完全灭活。
1.5 血凝价测定 参照《兽用生物制品质量标准》[2]附录中红细胞凝集试验法,测定各灭活留样的血凝价,并与灭活前病毒液血凝价比较。
1.6 RT-PCR测定 分别取灭活前病毒液以及各灭活留样,采用无菌生理盐水10倍递进稀释,从10-1稀释至10-6。病毒RNA提取参照RNA提取试剂盒说明书进行。引物参照《新城疫诊断技术》(GB/T 16550-2008)[3]所用的检测引物,由宝生物工程(大连)有限公司合成。反应体系按RT-PCR检测试剂盒说明书配制,反应条件为:50 ℃反转录30 min;94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃延伸5 min。反应结束后,用1.5%琼脂糖凝胶电泳分析结果,PCR 产物送宝生物工程(大连)有限公司测序。测定各灭活留样可检出的病毒最高稀释倍数,并与灭活前病毒液比较。
2 结果
2.1 灭活检验 按所述方法检测各灭活留样的灭活效果,采用浓度为0.1%~0.5%的甲醛灭活时,无论37 ℃灭活24 h或4℃灭活48 h,灭活的病毒样品再次接种鸡胚后,收获的尿囊液血凝价均为0,证明灭活完全;采用浓度为0.02%~0.2%的BPL 37 ℃灭活9 h,经检测均灭活完全;采用60 ℃30 min、60 min、90 min热灭活,经检测均灭活完全。
2.2 灭活前后血凝试验检测 结果见表1。病毒灭活前,经测定病毒液血凝价为 210。用甲醛灭活,灭活温度为37 ℃时,随着甲醛浓度从0.1%增加至0.5%,灭活后的病毒液血凝价下降到29~26;灭活温度为4 ℃时,在不同的灭活浓度下,灭活后的病毒液血凝价与灭活前保持一致,均为210。用BPL灭活时,灭活浓度从0.02%增加至0.2%,灭活后的病毒液血凝价与灭活前保持一致,均为210。采用60 ℃热灭活,灭活时间从30 min增加至90 min,灭活后的病毒液均检测不到血凝价。
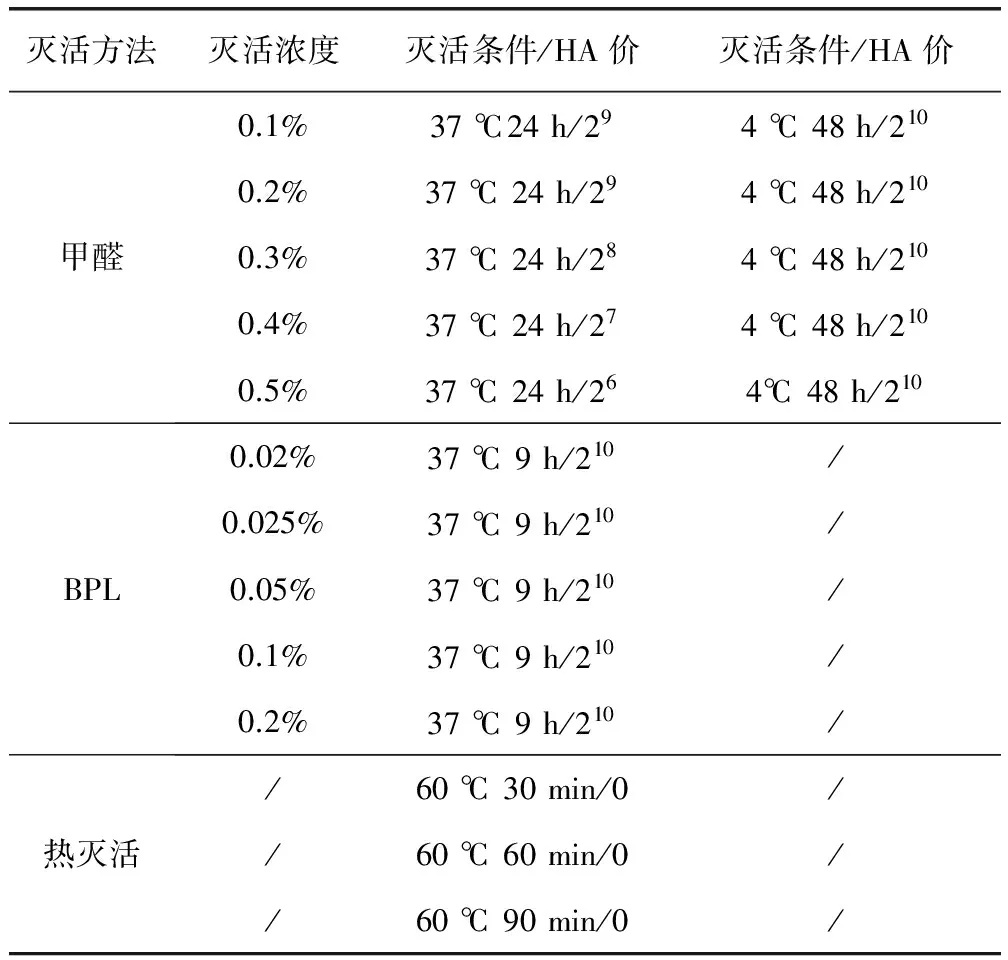
表1 不同灭活处理方法对NDV血凝价的影响
“/”代表无数据;HA效价为“0”代表无凝集
2.3 灭活前后RT-PCR检测 结果见表2。病毒灭活前,RT-PCR可检测到的病毒最高稀释倍数为10-3。甲醛灭活时,无论采用37 ℃或4 ℃灭活,或是灭活浓度从0.1%增加至0.5%,灭活后的病毒液均检测不到病毒核酸。BPL灭活时,灭活浓度为0.02%时,灭活后可检测到的病毒最高稀释倍数与灭活前一致,仍为10-3;随着灭活浓度从0.025%增加至0.2%,灭活后可检测到的病毒最高稀释倍数有所下降,但仍可检测到10-2稀释的病毒液。60 ℃热灭活时,灭活时间从30 min增加至90 min,灭活后可检测到的病毒最高稀释倍数均和灭活前一致,为10-3。

表2 不同灭活方法处理后RT-PCR可检测到NDV的最高稀释倍数
“/”代表无数据;可检测稀释倍数“-”代表检测结果为阴性
3 讨论
甲醛是传统的灭活剂[6-7],通过对蛋白和核酸的烷化作用使病毒或细菌丧失感染性[4]。本研究中,37 ℃或4 ℃条件下0.1%~0.5%甲醛灭活后,NDV核酸结构受损,RT-PCR检测结果均为阴性。37 ℃灭活时,随甲醛浓度升高,NDV血凝价呈下降趋势,这可能与血凝素蛋白变性发生交联反应而致抗原性破坏有关。采用4 ℃灭活,则可抑制上述交联反应,有效保存血凝素蛋白的抗原性。不过,在相关诊断制品(如新城疫抗原、禽流感抗原等)制备过程中,甲醛灭活浓度、温度、时间,还需依据生物材料的特性及具体工艺,灵活选择。
BPL在国外广泛用于疫苗灭活,其作用于病原体DNA或RNA,通过与核酸的嘌呤碱基(主要是鸟嘌呤)反应破坏核酸结构,但不直接作用于蛋白质,因此能保持良好的抗原活性。同时,BPL灭活病原时间短,且易水解为无毒性的人体脂肪代谢产物β-羟基丙酸,故不必考虑在成品中的残留[8]。本研究采用0.02%~0.2%BPL进行灭活,在NDV完全灭活的情况下,灭活前后血凝价保持不变,效果较为理想。同时,BPL虽然直接作用于核酸,当采用0.02%的浓度进行灭活时,灭活前后RT-PCR检测结果未受影响;当浓度增加到0.025%~0.2%时,RT-PCR可检测病毒最高稀释倍数降低至10-2,但与甲醛相比,BPL灭活对RT-PCR检测结果影响相对较小。本研究表明,用0.02%的BPL 37 ℃ 9h灭活效果较好,既保持了NDV血凝素蛋白的抗原性,又不会影响RT-PCR 检测。
热灭活简单易行,但容易造成病原体蛋白质变性,进而使抗原活性受到影响。本研究采用热灭活后,均检测不到血凝价,说明血凝素蛋白变性而失去其抗原性。但热灭活对核酸检测影响较小,灭活30~90 min,均不会影响RT-PCR检测结果,该方法较适用于分子检测试剂的质控品、对照品的制备。
本研究显示,3种灭活方法对NDV血凝性的影响,依次为热灭活﹥甲醛﹥BPL;对NDV核酸检测的影响,依次为甲醛﹥BPL﹥热灭活。因此,新城疫血凝和血凝抑制试验时,推荐采用0.02%的BPL 37 ℃灭活9 h或0.1%的甲醛4 ℃灭活48 h;NDV核酸检测时,建议热灭活30 min,也可用0.02%的BPL 37 ℃灭活9 h。实际应用中,可根据检测目的以及病原微生物的种类和生物学特性,合理选择灭活方法及灭活条件。
[1] 徐守振,尹燕博,王新.动物疫苗中常用抗原灭活剂的研究进展[J].中国畜牧兽医,2010,37(9):162-167.
[2] 中华人民共和国农业部.中华人民共和国兽用生物制品质量标准[S].北京:中国农业科技出版社,2001.
[3] 新城疫诊断技术(GB/T 16550-2008)[M].北京:中国农业科技出版社,2001.
[4] 姜平.兽医生物制品学[M].第2版.北京:中国农业出版社,2006.
[5] 徐守振,王新,尹燕博.四种不同灭活剂对新城疫病毒的灭活效果研究[J].中国家禽,2011,33(14):15-19.
[6] Jagt H J,Bekkers M L,Van Bommel S A,etal.The influence of the inactivating agent on the antigen content of inactivated Newcastle disease vaccines assessed by theinvitropotency test[J].Biologicals,2010,38:128-134.
[7] Habib M,Hussain I,Fang W H,etal.Inactivation of infectious bursal disease virus by binary ethylenimine and formalin[J].Zhejiang Univ Science B,2006,7(4):320-323.
[8] 卫龙兴,王福泉.动物疫苗中灭活剂与佐剂的种类及其作用[J].现代农业科技,2009,19:321-322.
(编辑:李文平)
Influence of Three Different Inactivation Methods on Newcastle Disease Virus Hemagglutinin Test and RT-PCR Assay
CHEN Yu-qi1,2, NAN Wen-long1, QIN Li-de1, GONG Ming-xia1,ZHANG Yue-yong1, CHEN Yi-ping1
(1.LaboratoryofDiagnosticsDevelopment,ChinaAnimalHealthandEpidemiologyCenter,Qindao,Shangdong266032,China;2.DepartmentofBiologicalSciences,Xi’anJiaotong-LiverpoolUniversity,Suzhou,Jiangsu215123,China)
In order to investigate the influence of different inactivation methods on Newcastle disease virus (NDV) hemagglutinin (HA) test and RT-PCR assay, viral suspensions were inactivated by 0.1%~0.5% formaldehyde for 37 ℃24 h and 4 ℃ 48 h, 0.02%~0.2%β-propiolactone (BPL) for 37 ℃ 9 h and 60 ℃ water bath for 30~90 min, respectively. Then the suspensions were detected by HA test and RT-PCR assay. The results showed that the optimal inactivation conditions for HA were 0.02% BPL at 37 ℃ for 9 h or 0.1% formaldehyde at 4 ℃ for 48 h; for RT-PCR were 60 ℃ water bath for 30 min or 0.02% BPL at 37 ℃ for 9 h. This study provided suggestions for the selection of appropriate inactivation methods, which were used in detecting related pathogens and preparing diagnostic reagents.
Newcastle disease virus; inactivation; hemagglutinin; RT-PCR
国家重点研发计划项目(2016YFD0501609)
陈羽琪, 从事微生物相关研究。
陈义平。 E-mail: cyp777@163.com
2016-07-23
A
1002-1280 (2016) 09-0011-04
S852.65

