ω-3多不饱和脂肪酸单药或联合用药逆转多发性骨髓瘤耐药性及细胞凋亡的机制研究
石微房德芳赵永刚
·基础研究·
ω-3多不饱和脂肪酸单药或联合用药逆转多发性骨髓瘤耐药性及细胞凋亡的机制研究
石微①房德芳①赵永刚②
目的:探讨ω-3多不饱和脂肪酸(ω-3 polyunsaturated fatty acids,ω-3 PUFA)单药或联合糖皮质激素地塞米松(dexamethasone,DEX)逆转多发性骨髓瘤(multiple myeloma,MM)耐药性及诱导细胞凋亡的作用及其机制。方法:采用不同浓度的两种ω-3 PUFA,二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)单药处理,或与DEX联合处理DEX耐药细胞系MM1R在24 h或48 h后,采用MTT法检测细胞的增殖,流式细胞术检测细胞周期的细胞凋亡,Western blot检测相关凋亡蛋白的表达水平。分析方法采用两样本间t检验,以P<0.05为差异具有统计学意义。结果:不同浓度EPA或DHA(10、20、50、100 μM),及50 μM EPA或DHA与10 μM DEX联合处理均能够抑制MM1R细胞的增殖,且呈剂量和时间依赖性,联合组抑制效果较EPA(50 μM)或DHA(50 μM)单药组更明显(P=0.014,0.032)。不同浓度EPA或DHA作用MM1R细胞48 h后,随着药物浓度增加,G0/G1期细胞逐渐增加,S期和G2期细胞逐渐减少,细胞凋亡率逐渐升高,细胞阻滞在G0/G1期;而两药联合组与EPA(50 μM)或DHA(50 μM)单药处理组相比,细胞阻滞和细胞凋亡率更加明显(P=0.015,0.004);凋亡相关Cleaved caspase-3、Bax蛋白水平逐渐升高,Pro-caspase-3、BCL-2蛋白水平逐渐降低,且呈剂量依赖性。不同浓度EPA或DHA作用MM1R细胞,随药物浓度增加,耐药倍数逐渐下降,逆转倍数逐渐上升,而两药联合组较单药组细胞耐药倍数下降及逆转倍数上升更明显。结论:ω-3 PUFA能够抑制DEX耐药MM细胞增殖,阻滞细胞周期,诱导细胞凋亡,与DEX联合应用对抑制MM细胞增殖、诱导细胞凋亡具有协同作用,是一种新型且有效的逆转MM耐药的治疗药物。
ω-3多不饱和脂肪酸多发性骨髓瘤地塞米松耐药
多发性骨髓瘤(multiple myeloma,MM)是一种起源于浆细胞的恶性肿瘤。近年来新型化疗药物的应用使MM的治疗取得长足进展,但是患者的预后仍较差。耐药是MM难治、复发的原因之一[1]。MM细胞异质性强,基因组高度不稳定,生长增殖高度依赖骨髓微环境,是耐药细胞出现和存在的主要原因[1]。ω-3多不饱和脂肪酸(ω-3 polyunsaturated fatty acid,ω-3 PUFA)为人体必需脂肪酸,是细胞膜的组成成分,参与基因表达、生长发育等多种生理活动[2]。ω-3 PUFA包括二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)。研究表明ω-3 PUFA可通过影响某些基因转录,抑制细胞增殖、阻滞细胞周期及诱导细胞凋亡,从而发挥抗肿瘤作用[3]。地塞米松(dexamethasone,DEX)作为糖皮质激素的一种衍生物,被广泛应用于MM的临床治疗。目前国内外尚无ω-3 PUFA对MM的影响以及对糖皮质激素耐药改善情况的报道。本研究将EPA和DHA单药或与地塞米松联合作用于MM耐药细胞系,观察其对MM细胞生长的影响,为ω-3 PUFA用于治疗MM提供理论依据。
1 材料与方法
1.1 材料
对DEX耐药的人MM细胞株MM1R由本研究实验室长期保存,实验前从液氮取出,常规快速复苏后传代培养。RPMI-1640培养基和胎牛血清(均购自美国Gibco公司);EPA、DHA和DEX(均购自美国Sigma公司);MTT试剂盒(购自日本同仁化学研究所);细胞周期检测试剂盒、流式凋亡检测试剂盒(购自南京凯基公司);Cleaved caspase-3抗体、Pro-caspase-3抗体、BCL-2抗体、Bax抗体、GAPDH抗体(均购自美国Abcam公司);蛋白裂解液、BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒(均购自上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 细胞培养MM1R细胞常规培养于含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的RPMI-1640培养基中,置于37℃、5%CO2饱和湿度下培养,每2~3 d换液传代1次,取对数生长期细胞用于实验。
1.2.2 药物浓度设定根据既往文献报道及预实验结果,用二甲基亚砜配置浓度为10 mM的DEX储备液,然后用RPMI-1640培养基稀释至10 μM工作液。用无水乙醇配置浓度为100 mM的EPA和DHA储备液,然后用RPMI-1640培养基稀释,EPA和DHA工作浓度梯度为:10、20、50、100 μM。联合加药组中先加入50 μM的EPA或DHA培养12 h,再加入10 μM DEX培养24 h进行相关实验。
1.2.3 MTT法检测细胞增殖收集对数生长期的MM1R细胞,以0.25%胰酶消化后制成细胞悬液,调整细胞浓度为1×105/mL,接种于96孔培养板中,200 μL/孔,每种浓度5个复孔,37℃、5%CO2饱和湿度条件下培养24 h,待细胞贴壁后,加入不同浓度的药物,分别处理24、48 h,吸去各孔培养液,换无血清培养液200 μL/孔,并加入20 μL/孔MTT(5 mg/mL),继续培养4 h;吸尽各孔培养液,加入二甲基亚砜(DMSO)200 μL/孔,振荡器上振荡溶解5~10 min,以空白对照调零,用自动酶标读数仪读取各组吸光度(A)值,检测波长为492 nm。细胞增殖抑制率(%)=(A对照组-A实验组)/(A对照组-A空白组)×100%。实验重复3次,取平均值为最终结果。
1.2.4 流式细胞术检测细胞周期和凋亡细胞处理方法同上;培养48 h后收集各组细胞,用4℃预冷的PBS洗细胞2次,1 000 r/min离心5 min。取l×105个细胞,加入4℃预冷的70%乙醇固定6 h。用4℃预冷的PBS洗细胞2次,1 000 r/min离心5 min。。将细胞重悬于100 μL PBS中,加入5 μL碘化丙锭(propidium iodide,PI),混匀后室温避光反应15 min,加入300 μL PBS,立即上流式细胞仪(BD FASC Calibur)检测。另取1×105个细胞,用100 μL结合缓冲液重新悬浮细胞,加入5 μL AnnexinnV-FITC和5 μL PI,混匀后于室温避光孵育15 min。加入400 μL结合缓冲液,立即上流式细胞仪分析。采用Modifit 1.0软件分析细胞周期分布,采用CellQuest Pro软件分析细胞凋亡,结果判断:活细胞(Annexin-V-/PI-),早期凋亡细胞(Annexin-V+/PI-),晚期凋亡细胞(Annexin-V+/ PI+),细胞总凋亡=早期凋亡细胞+晚期凋亡细胞。实验重复3次,取平均值为最终结果。
1.2.5 测定EPA和DHA单药或与地塞米松联合作用对MM细胞耐药及逆转倍数的影响细胞处理方法同上;取指数生长期细胞用胰酶消化后用培养液制成单细胞悬液,细胞计数后,以每孔6 000个细胞接种到96孔板上,每孔体积100 μL。细胞贴壁后,用细胞培养液配制不同浓度梯度的药物培养细胞,对照孔细胞用普通培养基培养。48 h后,每孔加入20 μL MTT溶液(5 mg/mL),继续培养4 h。以空白孔调零,全自动酶标仪于570 nm处测定各孔吸光值(OD值),参比波长为630 nm。实验重复3次,取平均值。抑制率=(1-实验组OD/对照组OD)×100%。采用直线回归方程计算出生长抑制率50%时的药物浓度即为半数抑制浓度(IC50)。耐药倍数=耐药细胞IC50/敏感细胞IC50;逆转倍数(RF)=药物IC50(不加逆转剂)/药物IC50(加逆转剂)。
1.2.6 Western blot检测蛋白表达水平细胞处理方法同上;培养24 h后收集各组细胞,用蛋白裂解液裂解细胞后,离心去细胞碎片,取上清液,BCA法定量细胞总蛋白,各组取20 μg总蛋白进行12%SDSPAGE,并转印到PVDF膜上,用1%牛血清白蛋白(BSA)和0.05%Tween 20封闭非特异性抗原后,一抗4℃温育过夜。次日TBST洗膜后,二抗1∶5 000稀释,37℃温育1 h,TBST洗膜后ECL荧光显色。蛋白质条带用扫描仪进行扫描,以GAPDH条带作为参照,应用Imagaquent 5.1软件对蛋白质条带灰度进行相对定量分析。以目的蛋白条带与GAPDH灰度比值表示蛋白相对表达水平。实验重复3次,取平均值为最终结果。
1.3 统计学分析
采用SPSS 16.0软件进行统计学分析,所有数据均采用±s表示,分析方法采用两样本间t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 EPA和DHA单药或与地塞米松联合作用对MM细胞增殖的影响
MTT法检测细胞增殖结果显示,EPA和DHA单药或与DEX联合均对MM1R细胞的增殖有抑制作用;同一时间点不同浓度的EPA或DHA对MM1R的增殖抑制率,差异均具有统计学意义(均P<0.05);同一浓度不同时间EPA或DHA对MM1R的增殖抑制率,差异均具有统计学意义(均P<0.05);两药联合组较单药组对细胞抑制作用更强,差异均具有统计学意义(均P<0.05)。结果见表1,2。
表1 EPA单药或与地塞米松联合作用对MM细胞增殖的影响(±s)Table 1Effects of EPA alone or in combination with dexamethasone on MM cell proliferation±s)
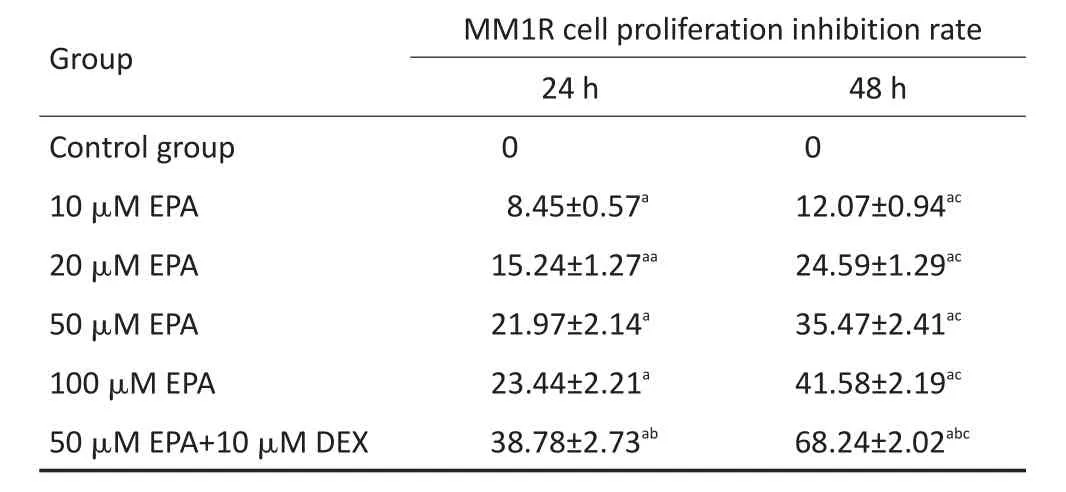
表1 EPA单药或与地塞米松联合作用对MM细胞增殖的影响(±s)Table 1Effects of EPA alone or in combination with dexamethasone on MM cell proliferation±s)
a.Compared with control group,P<0.05;b.compared with 50 μM EPA group,P<0.05;c.compared with 24 h,P<0.05
Group Control group 10 μM EPA 20 μM EPA 50 μM EPA 100 μM EPA 50 μM EPA+10 μM DEX MM1R cell proliferation inhibition rate 24 h 0 8.45±0.57a15.24±1.27aa21.97±2.14a23.44±2.21a38.78±2.73ab48 h 0 12.07±0.94ac24.59±1.29ac35.47±2.41ac41.58±2.19ac68.24±2.02abc
表2 DHA单药或与地塞米松联合作用对MM细胞增殖的影响(±s)Table 2Effects of DHA alone or in combination with dexamethasone on MM cell proliferation(±s)
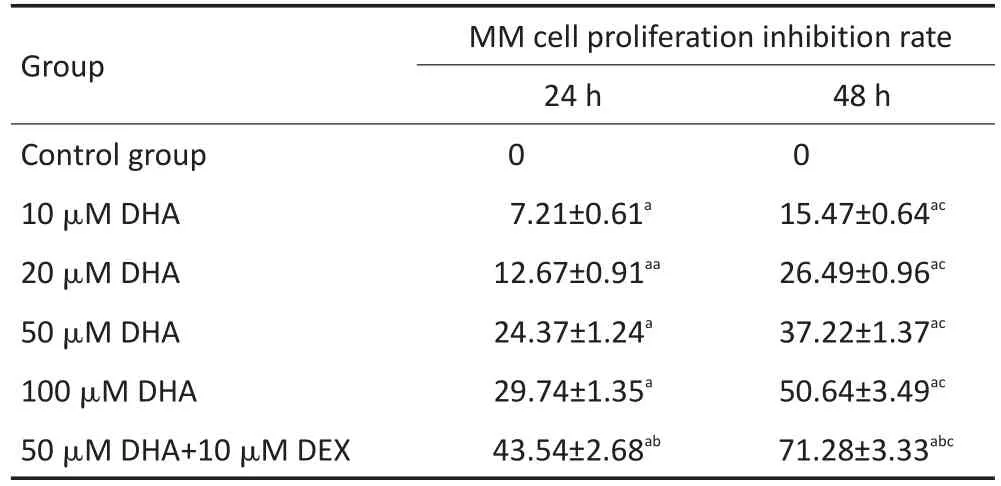
表2 DHA单药或与地塞米松联合作用对MM细胞增殖的影响(±s)Table 2Effects of DHA alone or in combination with dexamethasone on MM cell proliferation(±s)
a.Compared with control group,P<0.05;b.compared with 50 μM EPA group,P<0.05;c.compared with 24 h,P<0.05
Group Control group 10 μM DHA 20 μM DHA 50 μM DHA 100 μM DHA 50 μM DHA+10 μM DEX MM cell proliferation inhibition rate 24 h 0 7.21±0.61a12.67±0.91aa24.37±1.24a29.74±1.35a43.54±2.68ab48 h 0 15.47±0.64ac26.49±0.96ac37.22±1.37ac50.64±3.49ac71.28±3.33abc
表3 EPA单药或与地塞米松联合作用对MM细胞周期的影响(±s)Table 3Effects of EPA alone or in combination with dexamethasone on the cell cycle of MM(±s)
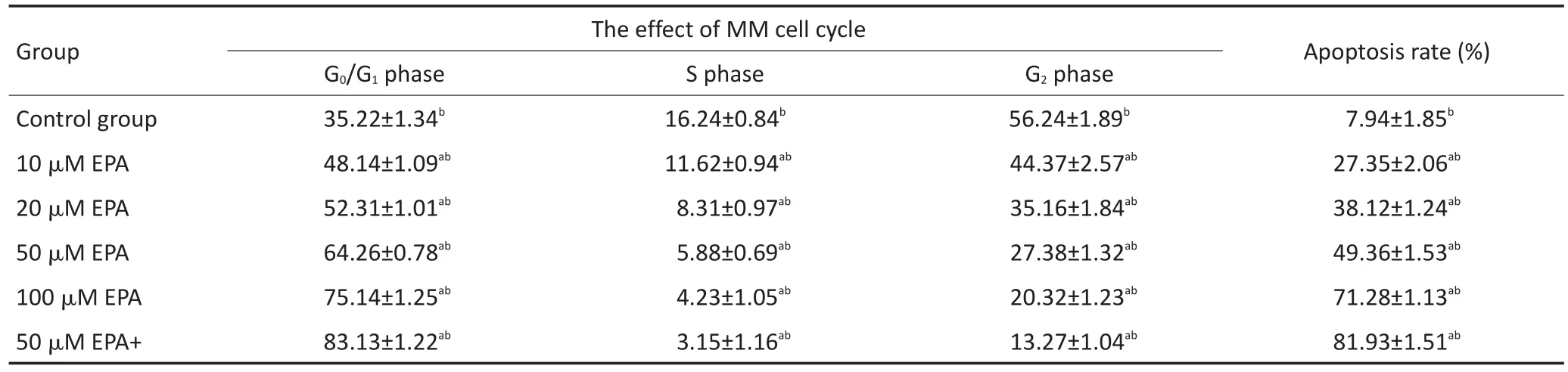
表3 EPA单药或与地塞米松联合作用对MM细胞周期的影响(±s)Table 3Effects of EPA alone or in combination with dexamethasone on the cell cycle of MM(±s)
Total variance analysis,significant level α=0.05.Multiple comparison,adjusting the significance level by comparing the number of times K,α'=0.05/K. Comparisonbetweenthetwogroups,usingLSDmethodandHSDmethod.a.Comparedwiththeblankgroup,therewasstatisticaldifference;b.therewas statisticaldifferencebetweenarbitrarilytwogroups
Group Control group 10 μM EPA 20 μM EPA 50 μM EPA 100 μM EPA 50 μM EPA+ The effect of MM cell cycle G0/G1phase 35.22±1.34b48.14±1.09ab52.31±1.01ab64.26±0.78ab75.14±1.25ab83.13±1.22abS phase 16.24±0.84b11.62±0.94ab8.31±0.97ab5.88±0.69ab4.23±1.05ab3.15±1.16abG2phase 56.24±1.89b44.37±2.57ab35.16±1.84ab27.38±1.32ab20.32±1.23ab13.27±1.04abApoptosis rate(%) 7.94±1.85b27.35±2.06ab38.12±1.24ab49.36±1.53ab71.28±1.13ab81.93±1.51ab
2.2 EPA和DHA单药或与地塞米松联合作用对MM细胞周期的影响
不同浓度EPA或DHA作用MM1R细胞48 h后,随着药物浓度增加,G0/G1期细胞逐渐增加,S期和G2期细胞逐渐减少,细胞阻滞在G0/G1期。而两药联合组较单药组细胞阻滞更明显(均P<0.05)。结果见表3,4。
2.3 EPA和DHA单药或与地塞米松联合作用对MM细胞凋亡的影响
不同浓度EPA或DHA作用MM1R细胞48 h后,随着药物浓度增加,细胞凋亡率逐渐增加,而两药联合组较单药组细胞凋亡增加更明显(均P<0.05)。结果见表3,4。
2.4 EPA和DHA单药或与地塞米松联合作用对MM细胞耐药及逆转倍数的影响
不同浓度EPA或DHA作用MM1R细胞,随药物浓度增加,耐药倍数逐渐下降,逆转倍数逐渐上升,而两药联合组较单药组细胞耐药倍数下降及逆转倍数上升更明显。结果见表5,6。
表4 DHA单药或与地塞米松联合作用对MM细胞周期的影响(±s)Table 4Effects of DHA alone or in combination with dexamethasone on the cell cycle of MM(±s)
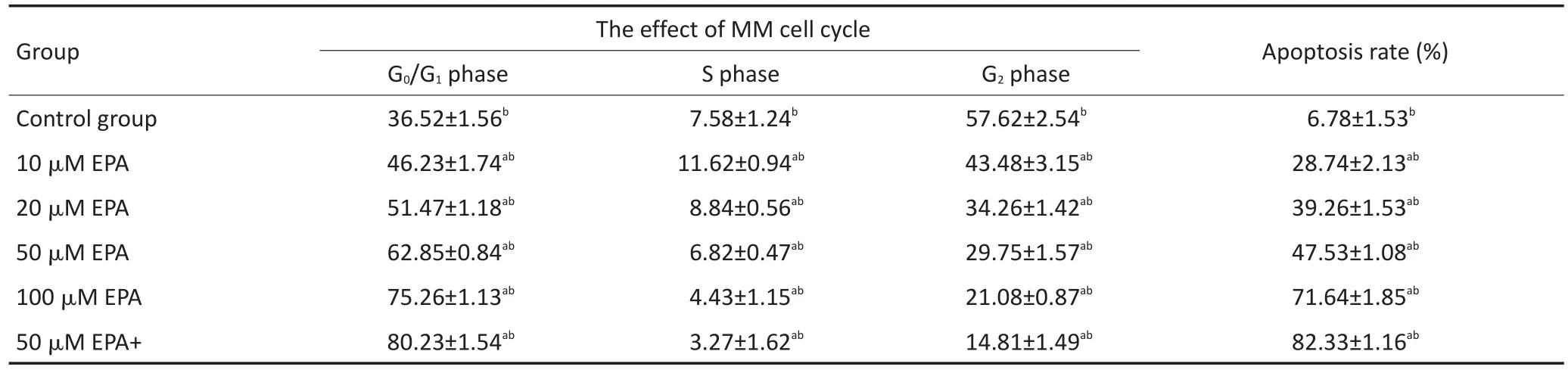
表4 DHA单药或与地塞米松联合作用对MM细胞周期的影响(±s)Table 4Effects of DHA alone or in combination with dexamethasone on the cell cycle of MM(±s)
Total variance analysis,significant level α=0.05.Multiple comparison,adjusting the significance level by comparing the number of times K,α'=0.05/K. Comparison between the two groups,using LSD method and HSD method.a.Compared with the blank group,there was statistical difference;b.there wasstatisticaldifferencebetweenarbitrarilytwogroups
Group Control group 10 μM EPA 20 μM EPA 50 μM EPA 100 μM EPA 50 μM EPA+ The effect of MM cell cycle G0/G1phase 36.52±1.56b46.23±1.74ab51.47±1.18ab62.85±0.84ab75.26±1.13ab80.23±1.54abS phase 7.58±1.24b11.62±0.94ab8.84±0.56ab6.82±0.47ab4.43±1.15ab3.27±1.62abG2phase 57.62±2.54b43.48±3.15ab34.26±1.42ab29.75±1.57ab21.08±0.87ab14.81±1.49abApoptosis rate(%) 6.78±1.53b28.74±2.13ab39.26±1.53ab47.53±1.08ab71.64±1.85ab82.33±1.16ab
表5 EPA单药或与地塞米松联合作用对MM细胞耐药、逆转及增敏倍数的影响(±s)Table 5Effects of EPA alone or in combination with dexamethasone on drug resistance,reversal,and enhancement of MM cells(±s)
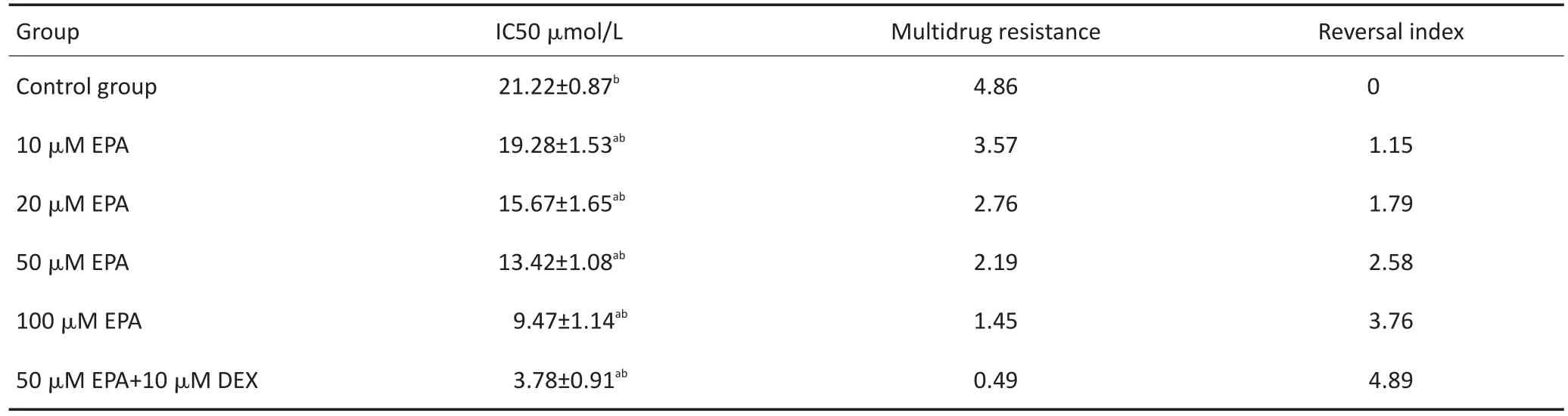
表5 EPA单药或与地塞米松联合作用对MM细胞耐药、逆转及增敏倍数的影响(±s)Table 5Effects of EPA alone or in combination with dexamethasone on drug resistance,reversal,and enhancement of MM cells(±s)
a.Compared with the control group,there were significant differences;b.there were significant differences between the two groups in any group
Group Control group 10 μM EPA 20 μM EPA 50 μM EPA 100 μM EPA 50 μM EPA+10 μM DEX IC50 μmol/L 21.22±0.87b19.28±1.53ab15.67±1.65ab13.42±1.08ab9.47±1.14ab3.78±0.91abMultidrug resistance 4.86 3.57 2.76 2.19 1.45 0.49 Reversal index 0 1.15 1.79 2.58 3.76 4.89
表6 DHA单药或与地塞米松联合作用对MM细胞耐药倍数及逆转倍数的影响(±s)Table 6Effects of DHA alone or in combination with dexamethasone on drug resistance and enhancement of MM cells(±s)

表6 DHA单药或与地塞米松联合作用对MM细胞耐药倍数及逆转倍数的影响(±s)Table 6Effects of DHA alone or in combination with dexamethasone on drug resistance and enhancement of MM cells(±s)
Adjusting the significance level by comparing the number of times K,α'=0.05/K.Comparison between the two groups,using LSD method and HSD method.a.Compared with the blank group,there was statistical difference;b.there was statistical difference between arbitrarily two groups
Group Control group 10 μM DHA 20 μM DHA 50 μM DHA 100 μM DHA 50 μM DHA+10 μM DEX IC50μmol/L 22.38±1.85b18.76±1.63ab14.36±1.36ab12.42±1.57ab7.13±0.82ab4.57±0.81abMultidrug resistance 5.34 3.72 2.69 2.07 1.38 0.58 Reversal index 0 1.24 1.48 2.37 3.86 5.17
2.5 EPA和DHA单药或与地塞米松联合作用对MM细胞凋亡相关蛋白表达的影响
不同浓度EPA或DHA作用MM1R细胞24 h后,随着药物浓度增加,凋亡相关Cleaved caspase-3、Bax蛋白水平逐渐增加,Pro-caspase-3、BCL-2蛋白水平逐渐减少,且呈剂量依赖性。两药联合组Cleaved caspase-3、Bax蛋白水平上调更明显,而Pro-caspase-3、BCL-2蛋白水平下调更明显(均P<0.05),结果见图1~3。
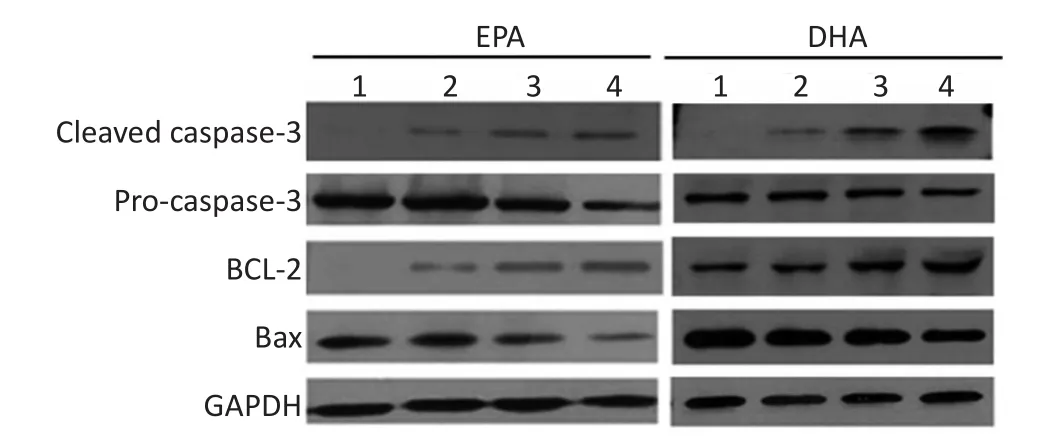
1.Control group;2.20 μM EPA or DHA;3.50 μM EPA or DHA;4.50 μM EPA or DHA+10 μM DEX图1Western blot检测凋亡相关蛋白表达水平Figure 1Detection of the expression level of apoptosis-related proteins

图2 EPA单药或与地塞米松联合作用对MM细胞凋亡相关蛋白表达的影响Figure 2Effect of EPA alone or in combination with dexamethasone on the expression of apoptosis-related proteins in MM cells
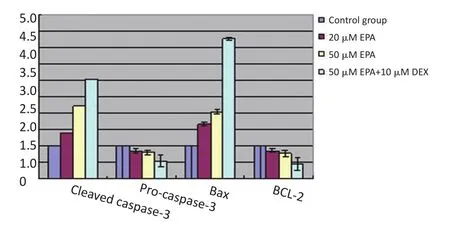
图3 DHA单药或与地塞米松联合作用对MM细胞凋亡相关蛋白表达的影响Figure 3Effect of DHA alone or in combination with dexamethasone on the expression of apoptosis-related proteins in MM cells
3 讨论
糖皮质激素是治疗MM的一线药物,是联合化疗方案中不可缺少的药物。在化疗过程中,不同MM患者对激素的反应差异较大,部分MM患者即使加大激素剂量仍表现为反应差甚至无反应,这种现象称为糖皮质激素抵抗(glucocorticoid resistance,GCR)[4]。GCR导致化疗无效或出现药物严重不良反应,这是MM治疗的难点。因此,如果能够减少化疗药物的用量而降低化疗药物的不良反应显得尤为重要。ω-3 PUFA与肿瘤的关系为:1)进展期肿瘤患者血ω-3 PUFA浓度降低;2)抗肿瘤治疗期间补充ω-3 PUFA可以提高治疗反应并改善患者生存质量;3)ω-3 PUFA在提高抗肿瘤治疗的疗效及减轻化疗不良反应等方面起到重要作用[5-6]。如果EPA或DHA对MM细胞有抑制和杀伤作用,或有改善MM细胞GCR的作用,这在MM的治疗领域将具有非常诱人的前景。
本研究结果发现,EPA和DHA单药对DEX耐药的MM细胞株MM1R的生长均有显著的抑制作用,随着剂量的增加和作用时间的延长,抑制效果越发显著,呈浓度梯度和时间梯度依赖性,表明ω-3 PUFA对耐药的MM细胞增殖起作用。同时联合ω-3 PUFA与DEX来观察两者的协同作用,显示采用50 μM ω-3 PUFA与10 μM DEX联合产生的细胞增殖抑制效果均较EPA和DHA单药产生的抑制效果强,且联合组的抑制效果也呈时间梯度依赖性。不同浓度EPA或DHA作用MM1R细胞,随药物浓度增加,耐药倍数逐渐下降,逆转倍数逐渐上升,而两药联合组较单药组细胞耐药倍数下降及逆转倍数上升更明显。充分表明ω-3 PUFA与DEX联合具有协同作用,能够发挥更大的肿瘤杀伤效果,微摩尔浓度的ω-3 PUFA能对耐药MM细胞产生明显的抑制作用,表明ω-3 PUFA是高效、低剂量毒性的抗MM药物,并且能够改善MM细胞的GCR作用。ω-3 PUFA的增强化疗敏感性在临床实体肿瘤中也获得研究和证实。Serini等[7]研究发现ω-3 PUFA通过调控基因表达遗传和M2巨噬细胞极性化改善大肠炎性反应和肿瘤的发生发展。在动物水平上,Chen等[8]研究发现,饮食内源性的ω-3 PUFA,无论是在体外还是体内,均有预防乳腺癌发生、肿瘤生长和转移的作用。Abdi等[9]研究结果表明EPA和DHA能诱导骨髓瘤细胞凋亡,增加硼替佐米对MM细胞的敏感性,而正常人外周血单个核细胞的活性不受影响。Fahrmann等[10]对B细胞性慢性淋巴细胞白血病细胞系EHEB和MEC-2、B细胞性幼淋巴细胞白血病细胞系JVM-2进行体外培养,判断在有无PUFA的情况下对化疗药物阿霉素、长春新碱或氟达拉滨的敏感性,结果提示EPA和DHA能通过G2/M阻滞、脂质过氧化作用诱导细胞凋亡,增加上述化疗药物的敏感性,ω-3 PUFA可能是慢性淋巴细胞白血病有效的化疗增敏剂。因此,上述研究和本研究结果均证实ω-3 PUFA具有改善激素耐药、增加化疗敏感性的作用,具有良好的临床应用前景。ω-3 PUFA可能通过以下几个方面发挥其抗肿瘤作用:1)ω-3 PUFA可以掺入膜磷脂层影响膜相关信号转导。可能关联的信号转导途径有Ras、PI3K/Akt、HER-2/neu途径等;2)脂质过氧化作用:ω-3 PUFA的脂质过氧化作用的产物可抑制肿瘤细胞DNA合成、细胞分裂及生长,诱导凋亡;3)抑制NF-κB信号转导通路:NF-κB是重要的核转录因子,激活后可调控多种基因表达,参与炎性反应、免疫应答以及细胞的增殖、分化、凋亡等生物学过程;4)改变肿瘤细胞膜通透性,增加抗肿瘤药物的摄入;5)作用于细胞凋亡相关因子,诱导肿瘤细胞凋亡。ω-3 PUFA影响肿瘤的机制非常复杂,是作用于多个靶点发挥效果。本研究发现EPA和DHA单药或与DEX联合应用能够使MM1R细胞的细胞周期阻滞在G0/G1期,且随着药物剂量和作用时间的增加,阻滞效果逐渐明显,呈剂量依赖性。表明ω-3 PUFA作用的敏感点在细胞周期的早期G0/G1期。药物作用48 h后出现细胞凋亡,且随着药物剂量的增加,凋亡率越来越高,并且ω-3 PUFA与DEX联合应用细胞凋亡增加更明显,充分表明ω-3 PUFA具有细胞周期阻滞、诱导凋亡的双重作用。有研究显示EPA和DHA主要通过影响线粒体膜电位和激活caspase-3诱导细胞凋亡,且在细胞凋亡中起到不可替代的作用,是细胞凋亡过程中最主要的剪切酶[11]。另外,BCL-2和Bax是调控细胞凋亡非常重要的两个基因,同属BCL-2家族,BCL-2发挥抗凋亡作用,而Bax则促进细胞凋亡,它们在调节细胞凋亡和细胞耐药方面具有重要作用[12]。本研究发现,经ω-3 PUFA作用后,MM1R细胞的Cleaved caspase-3、Bax蛋白水平均逐渐上调,Pro-caspase-3、BCL-2蛋白逐渐下调,而且具有剂量依赖性,表明ω-3 PUFA可能是通过caspase途径和调节BCL-2/Bax比率来诱导MM细胞凋亡的。
综上所述,ω-3 PUFA是一种新型且有效逆转MM耐药的治疗药物,为MM尤其是发生激素抵抗MM的治疗提供新思路和新靶点,为提高MM的治疗效果、降低化疗药物的不良反应、减少治疗费用、改善患者生存质量开辟新的方法,具有重要的临床意义。但是,目前该药物对MM逆转耐药作用仍停留在初步研究阶段,后续还需要动物实验和临床试验进一步研究和证实。
[1]Zang MR,Qiu LG.Advances in drug resistance mechanisms of multiple myeloma:reports from the 55th ASH annual meeting[J].J Leuk Lymph,2014,23(3):133-136.[藏美蓉,邱录贵.多发性骨髓瘤耐药机制相关研究进展:第55届美国血液学会年会报道[J].白血病·淋巴瘤,2014,23(3):133-136.]
[2]Lang LW,Wang HY,Hu B,et al.Research advanced of polyunsaturated fatty acids in cancer and inflammation disease[J].Chin J Biochem Pharm,2014,34(1):153-155.[郎丽巍,王洪允,胡蓓,等.多不饱和脂肪酸在癌症及炎症疾病方面的研究进展[J].中国生化药物杂志,2014,34(1):153-155.]
[3]Liu CA,Xu QW,He K,et al.Preventive effect of n-3 polyunsaturated fatty acids intragastric administration on rats colorectal cancer[J]. Canc Res Prev Treat,2014,41(12):1279-1281.[刘春安,许庆文,何可,等.n-3多不饱和脂肪酸灌胃对大鼠结直肠癌的预防作用[J].肿瘤防治研究,2014,41(12):1279-1281.]
[4]Hao M,Lin JT.Research advanced in the molecular mechanisms of insensitivity glucocorticoid[J].Natl Med J China,2014,25(26):2073-2075.[郝敏,林江涛.糖皮质激素不敏感的分子机制研究进展[J].中华医学杂志,2014,25(26):2073-2075.]
[5]D'eliseo D,Velotti F.Omega-3 fatty acids and cancer cell cytotoxicity: implications for multi-targeted cancer therapy[J].J Clin Med,2016,5 (2):3390-3399.
[6]Devi KP,Rajavel T,Russo GL,et al.Molecular targets of omega-3 fatty acids for cancer therapy[J].Anticancer Agents Med Chem, 2015,15(7):888-895.
[7]Serini S,Ottes VR,Fasano E,et al.Epigenetic regulation of gene expression and M2 macrophage polarization as new potential omega-3 polyunsaturated fatty acid targets in colon inflammation and cancer[J].Expert Opin Ther Targets,2016,20(7):843-858.
[8]Chen Z,Zhang Y,Jia C,et al.mTORC 1/2 targeted by n-3 polyunsaturated fatty acids in the prevention of mammary tumorigenesis and tumor progression[J].Oncogene,2014,33(37):4548-4557.
[9]Abdi J,Garssen J,Faber J,et al.Omega-3 fatty acids,EPA and DHA induce apoptosis and enhance drug sensitivity in multiple myeloma cells but not in normal peripheral mononuclear cells[J].J Nutr Biochem,2014,25(12):1254-1262.
[10]Fahrmann JF,Hardman WE.Omega 3 fatty acids increase the chemosensitivity of B-CLL-derived cell lines EHEB and MEC-2 and of B-PLL-derived cell line JVM-2 to anti-cancer drugs doxorubicin,vincristine and fludarabine[J].Lipids Health Dis,2013,12(36)1180-1194.
[11]Zhang C,Yu H,Shen Y,et al.Polyunsaturated fatty acids trigger apoptosis of colon cancer cells through a mitochondrial pathway [J].Arch Med Sci,2015,11(5):1081-1094.
[12]Czabotar PE,Lessene G,Strasser A,et al.Control of apoptosis by the BCL-2 protein family:implications for physiology and therapy [J].Nat Rev Mol Cell Biol,2014,15(1):49-63.
(2016-07-25收稿)
(2016-10-18修回)
(编辑:孙喜佳 校对:周晓颖)
Role and mechanisms of ω-3 polyunsaturated fatty acids in inducing cell apoptosis and reversing drug resistance in multiple myeloma
Wei SHI¹,Defang FANG¹,Yonggang ZHAO²
Defang FANG;E-mail:782674212@qq.com
1Nursing Department,Lianyungang TCM Branch,Jiangsu Union Vocational Technical Institute,Lianyungang 222006,China;2Department of Pathology,the First People's Hospital of Lianyungang,Lianyungang 222006,China
Objective:To explore the role and mechanisms of ω-3 polyunsaturated fatty acids(ω-3PUFAs)alone or in combination with dexamethasone(DEX)in inducing cell apoptosis and reversing drug resistance in multiple myeloma(MM).Methods:DEX-resistant MM cell line MM1R was treated with different concentrations of eicosapentaenoic acid(EPA)or docosahexaenoic acid(DHA)alone or in combinationwithDEXfor 24or 48h.Cell proliferationwasdetectedbyMTTassay.Cell cycleandapoptosisweremeasuredbyflowcytometry. Expression levels of apoptosis-related proteins were analyzed by Western blot.Two-tailed,unpaired Student's t-test was used to compare the two treatment groups.A value of P<0.05 was considered statistically significant.Results:MM1R proliferation was inhibited by different concentrations(10,20,50,and 100 μM)of EPA or DHA alone or in combination with 10 μM DEX in a dose-and time-dependent manner. The inhibition effect was significantly higher in combinative groups than in single EPA or DHA treatment group(P=0.014,P=0.032).The percentage of G0/G1phase and cell apoptosis rate in MM1R treated with different concentrations of EPA or DHA alone increased in a dosedependent manner.This percentage was also significantly higher in the combinative groups than in the single EPA or DHA treatment group (P=0.015,P=0.004).The expression levels of cleaved caspase-3 and Bax were upregulated,whereas those of pro-caspase-3 and BCL-2 were downregulated in a dose-dependent manner.Drug resistance gradually decreased in MM1R cells at different concentrations of EPA or DHA with the increase of drug concentration.The reversal fold also increased gradually,whereas the cells decreased in the two drug-combination groups compared with the single-drug group.Moreover,the drug-resistance reversal index increased significantly.Conclusion:ω-3PUFAs can inhibit DEX-resistant MM cell proliferation,arrest cell cycle,and induce cell apoptosis.ω-3PUFAs also exhibit a synergistic anti-resistanteffect in combination with DEX.Furthermore,ω-3PUFAs can serve as novel effective drugs for MM treatment.
:ω-3 polyunsaturated fatty acids,multiple myeloma,dexamethasone,drug resistance

10.3969/j.issn.1000-8179.2016.24.879
①江苏省联合职业技术学院连云港中医药分院医学护理系临床医学教研室(江苏省连云港市222006);②江苏省连云港市第一人民医院病理科
房德芳782674212@qq.com
石微专业方向为生物化学教学和分子生物学。
E-mail:846855639@qq.com

