宫颈癌HPV分型与Th17和Treg细胞的相关性研究*
蔡冬慧 李燕 郭润梅 张亭亭 陈志芳
·临床研究与应用·
宫颈癌HPV分型与Th17和Treg细胞的相关性研究*
蔡冬慧 李燕 郭润梅 张亭亭 陈志芳
目的:检测感染人乳头状瘤病毒(human papilloma virus,HPV)患者的外周血中CD4+IL17+Th17、CD4+CD25+Foxp3+Treg细胞,分析Th17/Treg比值,比较血清中IL-17、IL-10、TGF-β、IL-23细胞因子的表达差异。方法:收集2014年9月至2016年6月119例新疆医科大学第一附属医院HPV感染未行治疗患者的资料,分为宫颈癌(cervical cancer,CC)组46例、宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)Ⅱ~Ⅲ组43例、慢性宫颈炎(chronic cervicitis,CCS)组30例,根据检测HPV分型将患者HPV感染分为高危型80例与低危型39例,流式细胞仪检测Treg及Th17细胞,ELISA检测相关细胞因子。结果:高危型HPV感染患者中CC组感染率为87%(40/46),显著高于CINⅡ~Ⅲ组77%(33/43)及CCS组23%(7/30)。CC组外周血中Th17、Treg细胞及血清中相关细胞因子均明显高于其他两组,且随着宫颈病变加重,Th17/Treg比值升高更加显著。高危型HPV感染患者外周血中Th17和Treg细胞高于低危型HPV感染患者(P<0.05),Th17/Treg比值在高危型HPV感染患者中显著升高。高危型HPV感染患者血清中IL-17、IL-10、TGF-β、IL-23细胞因子的表达较低危型HPV感染患者均显著增高(P<0.05)。结论:Treg、Th17细胞在高危型HPV感染患者中存在增高现象,Th17/Treg比值的升高可能直接参与宫颈HPV的感染及免疫逃逸过程,在宫颈癌的发生发展中起着重要作用。
宫颈癌人乳头状瘤病毒Treg细胞Th17细胞
宫颈癌(cervical cancer,CC)是威胁女性生命健康的主要恶性肿瘤之一,据2012年中国恶性肿瘤死亡与分析报道,宫颈癌在我国女性恶性肿瘤发病率中居第5位,在我国女性恶性肿瘤死亡率中居第8位[1]。流行病学调查研究显示,高危型人乳头状瘤病毒(human papilloma virus,HPV)持续感染是导致宫颈癌发生的主要原因。约80%妇女一生中曾感染过HPV病毒,但只有少部分持续感染者发展成为宫颈癌[2]。宫颈癌及宫颈上皮内瘤变的发生与宫颈HPV的免疫逃逸存在密不可分的关系[3]。不同类型的T淋巴细胞在肿瘤的微环境中起着重要作用,Treg细胞及Th17细胞均属于T淋巴细胞亚群,叉头状/翼状螺旋转录因子3(forkhead or winged helix transcription 3,Foxp3)在Treg细胞中特异性表达,在Treg细胞免疫抑制作用中承担重要角色。Th17细胞通过释放IL-17细胞因子发挥促炎症效应,机体内Th17/Treg比值的升高与宫颈癌的发生密切相关[4]。本研究通过研究宫颈病变患者HPV分型与Th17/Treg比值改变及相关细胞因子的关系,初步探讨高危型及低危型宫颈HPV感染患者体内的免疫状态,为宫颈癌的免疫防治提供新的思路。
1 材料与方法
1.1 材料
1.1.1 资料收集2014年9月至2016年6月119例新疆医科大学第一附属医院宫颈HPV感染未行治疗患者的资料。分为宫颈癌(cervical cancer,CC)组46例,年龄36~60岁;宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)Ⅱ~Ⅲ组43例,年龄27~58岁;慢性宫颈炎(chronic cervicitis,CCS)组30例,年龄24~53岁。根据检测HPV分型将患者HPV感染分为高危型80例与低危型39例。宫颈病变诊断以病理诊断为金标准。所有参加者均自愿签署新疆医科大学伦理委员会批准的项目知情同意书。排除糖尿病、高血压、心血管疾病、妊娠、急性或慢性感染性疾病或转移性肿瘤的患者。
1.1.2 试剂与仪器HPV核酸扩增分型检测试剂盒(购自广东凯普生物化学有限公司)检测多种HPV亚型,包括15种高危亚型、6种低危亚型。核酸分子快速杂交仪(购自广东凯普生物化学有限公司);Epics ALTRA型流式细胞仪(购自美国Beckman公司);Bench Mark Plus型酶标仪(购自美国Biorad公司);酶联免疫吸附试验(ELISA)试剂盒(购自奥地利Bender MedSystems公司)。
1.2 方法
1.2.1 宫颈HPV检测将HPV检测专用宫颈刷放置于宫颈,旋转5~10圈,收集脱落细胞放置专门的保存液中。采用PCR技术行HPV分型检测。
1.2.2 CD4+CD25+Foxp3+Treg细胞检测对纳入患者采静脉血2 mL,EDTA抗凝。测定管中各加入100 mL抗凝血,加入相应的抗体10 μL/管,避光,室温,孵育20 min。加入Foxp3荧光抗体20 μL,避光,4℃,静置30 min,加入破膜剂2 mL洗涤,1 200 r/min离心5 min,弃上清,加入细胞染色液2 mL洗涤2次,0.5 mL细胞染色液重悬细胞混匀。流式细胞仪检测样本。
1.2.3 CD4+IL17+Th17细胞检测RPMI 1640培养基调整细胞浓度至2×106/mL,接种于24孔培养板后加入佛波醇乙酯25 ng/mL、离子霉素1 μg/mL和莫能霉素1.7 μg/mL,在37℃、5%CO2细胞培养箱培养4~6 h,最终调整细胞浓度至1×107/mL。取测定试管及对照试管各1支分别加入100 μL细胞悬液和10 μL Fitc-CD4,避光,室温,孵育15 min;PBS洗涤1次,两管分别加入200 μL细胞破膜剂试剂A,避光、室温、孵育15 min;PBS洗涤1次,重悬细胞,测定试管中加入200 μL破膜剂试剂B和10 μL PE-IL17A,对照试管中加入200 μL破膜剂试剂B和10 μL同型对照抗体PE,避光,室温,孵育15~20 min;PBS洗涤1次。流式细胞仪检测样本。
1.2.4 细胞因子的检测严格按照ELISA试剂盒说明书操作,分别检测各组血清IL-17、IL-10、TGF-β、IL-23的水平,酶标仪450 nm处读吸光度(OD)值,根据标准曲线计算浓度。
1.3 统计学分析
采用SPSS 21.0软件进行统计学分析。计量资料的比较采用独立样本t检验,均用±s表示;计数资料的比较采用χ2检验。以P<0.05为差异具有统计学意义。
2 结果
2.13 组患者高危型HPV感染率比较
CC组HPV感染率为87%(40/46)、CINⅡ~Ⅲ组为77%(33/43)、CCS组为23%(7/30),CC组与CINⅡ~Ⅲ组及CCS组比较差异均具有统计学意义(均P<0.05),CINⅡ~Ⅲ组及CCS组之间比较差异亦具有统计学意义(P<0.05)。
2.23 组患者外周血Th17、Treg细胞百分率及Th17/ Treg比值比较
对CC、CINⅡ~Ⅲ、CCS组患者的外周血中CD4+IL17+Th17细胞百分率、CD4+CD25+Foxp3+Treg细胞百分率及Th17/Treg比值进行比较,CC组与CINⅡ~Ⅲ组及CCS组比较差异均具有统计学意义(均P<0.05),CINⅡ~Ⅲ组与CCS组之间比较差异亦具有统计学意义(P<0.05,表1)。
2.33 组患者的血清中IL-17、IL-10、TGF-β、IL-23细胞因子的表达差异比较
对CC、CINⅡ~Ⅲ、CCS组患者的血清中IL-17、IL-10、TGF-β、IL-23细胞因子进行比较,CC组与CINⅡ~Ⅲ组及CCS组比较差异均具有统计学意义(均P<0.05),CINⅡ~Ⅲ组与CCS组之间比较差异亦具有统计学意义(P<0.05,表2)。
2.4 高危型与低危型HPV感染患者的外周血中Th17、Treg细胞百分率及Th17/Treg比值比较
对高危型与低危型HPV感染患者的外周血中CD4+IL17+Th17细胞百分率、CD4+CD25+Foxp3+Treg细胞百分率及Th17/Treg比值进行比较,高危型HPV感染患者显著高于低危型HPV感染患者,差异具有统计学意义(P<0.05,表3)。
2.5 高危型与低危型HPV感染患者的血清中IL-17、IL-10、TGF-β、IL-23细胞因子的表达差异比较
对高危型与低危型HPV感染患者的血清IL-17、IL-10、TGF-β、IL-23细胞因子进行比较,高危型HPV感染患者显著高于低危型HPV感染患者,差异具有统计学意义(P<0.05,表4)。
表1 CC、CINⅡ~Ⅲ、CCS组患者的外周血中Th17、Treg细胞百分率及Th17/Treg比值比较(±s)Table 1Comparison of Th17 and Treg cell percentages and Th17/Treg ratio in the peripheral blood of patients among CC,CINⅡ-Ⅲ,and CCS groups (±s)

表1 CC、CINⅡ~Ⅲ、CCS组患者的外周血中Th17、Treg细胞百分率及Th17/Treg比值比较(±s)Table 1Comparison of Th17 and Treg cell percentages and Th17/Treg ratio in the peripheral blood of patients among CC,CINⅡ-Ⅲ,and CCS groups (±s)
Group CCS CINⅡ-ⅢCC Percentage of CD4+IL17+Th17(%) 1.34±0.64 3.09±1.28 3.96±1.15 Percentage of CD4+CD25+Foxp3+Treg(%) 2.28±1.18 4.34±1.32 5.29±1.11 Th17/Treg ratio 0.60±0.08 0.69±0.11 0.74±0.07
表2 CC、CINⅡ~Ⅲ、CCS组患者的血清中IL-17、IL-10、TGF-β、IL-23细胞因子表达差异比较(±s,pg/mL)Table 2Comparison of IL-17,IL-10,TGF-β,and IL-23 cytokines in the serum of patients among CC group,CINⅡ-Ⅲgroup,and CCS group(±s,pg/mL)
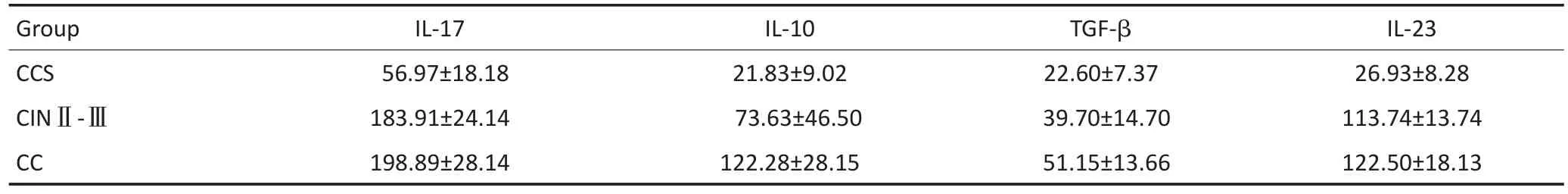
表2 CC、CINⅡ~Ⅲ、CCS组患者的血清中IL-17、IL-10、TGF-β、IL-23细胞因子表达差异比较(±s,pg/mL)Table 2Comparison of IL-17,IL-10,TGF-β,and IL-23 cytokines in the serum of patients among CC group,CINⅡ-Ⅲgroup,and CCS group(±s,pg/mL)
Group CCS CINⅡ-ⅢCC IL-17 56.97±18.18 183.91±24.14 198.89±28.14 IL-10 21.83±9.02 73.63±46.50 122.28±28.15 TGF-β 22.60±7.37 39.70±14.70 51.15±13.66 IL-23 26.93±8.28 113.74±13.74 122.50±18.13
表3 高危型与低危型HPV感染患者的外周血中Th17、Treg细胞百分率及Th17/Treg比值比较(±s)Table 3Comparison of Th17 and Treg cell percentages and Th17/Treg ratio in peripheral blood of high-and low-risk HPV patients(±s)

表3 高危型与低危型HPV感染患者的外周血中Th17、Treg细胞百分率及Th17/Treg比值比较(±s)Table 3Comparison of Th17 and Treg cell percentages and Th17/Treg ratio in peripheral blood of high-and low-risk HPV patients(±s)
Group Low-risk High-risk Percentage of CD4+IL17+Th17(%) 1.62±0.93 3.65±1.25 Percentage of CD4+CD25+Foxp3+Treg(%) 2.45±1.11 5.03±1.20 Th17/Treg ratio 0.61±0.09 0.72±0.09
表4 高危型与低危型HPV感染患者的血清中IL-17、IL-10、TGF-β、IL-23细胞因子表达差异比较(±s,pg/mL)Table 4Comparison of IL-17,IL-10,TGF-β,and IL-23 cytokines in the serum of high-and low-risk HPV patients(±s,pg/mL)

表4 高危型与低危型HPV感染患者的血清中IL-17、IL-10、TGF-β、IL-23细胞因子表达差异比较(±s,pg/mL)Table 4Comparison of IL-17,IL-10,TGF-β,and IL-23 cytokines in the serum of high-and low-risk HPV patients(±s,pg/mL)
Group Low-risk High-risk IL-17 96.08±58.07 187.74±41.07 IL-10 31.23±27.50 102.85±43.73 TGF-β 26.79±10.93 46.16±15.70 IL-23 57.13±37.12 46.16±15.70
3 讨论
HPV病毒是一种环状双链DNA病毒[2],目前分离的HPV病毒约120余种,多种疾病与HPV感染相关,包括泌尿生殖系统及口咽部肿瘤等[5]。HPV分为3个基因区,包括2个编码区和1个非编码区,编码区包括E区和L区,E编码区编码的E1、E2蛋白与病毒复制相关,E6、E7蛋白可诱导p53和Rb抑癌基因的失活,诱发宫颈癌的发生[3]。高危型HPV E6/E7 mRNA的检出率在宫颈癌患者为76%,显著高于健康体检者,且随着宫颈病变加重HPV E6/E7 mRNA的阳性率越高[6]。根据致病力,可将HPV分为高危型及低危型。研究证明高危型宫颈HPV持续感染与宫颈癌的发生密不可分[2]。
随着宫颈HPV疫苗的问世及临床应用,宫颈癌的免疫治疗成为热门研究方向。目前HPV的免疫逃逸机制尚不明确,有研究发现Treg细胞及Th17细胞可能参与宫颈HPV的免疫逃逸[3]。Treg细胞主要发挥免疫抑制作用,与许多肿瘤的发生呈正相关,包括乳腺癌、宫颈癌等,外周血中Treg细胞的百分率升高与肿瘤的分期、大小及淋巴转移呈正相关[7-8]。Foxp3+Treg细胞百分率的升高往往提示疾病结局不良[7,9]。CD4+CD25+Treg细胞是最具代表性的Treg细胞,Foxp3在CD4+CD25+Treg细胞中特异性表达,为CD4+CD25+Treg细胞发育必须的转录因子[7-8]。研究发现Treg细胞与TGF-β、IL-10、IL-6细胞因子呈正相关[4]。Th17与IL-6、IL-23、IL-17细胞因子呈正相关[4,10]。Th17细胞主要介导炎症反应,在自身免疫性疾病、感染性疾病中发挥重要作用。肿瘤患者的外周血中同样存在Th17细胞高表达,但Th17细胞在肿瘤作用机制尚不明确。研究认为Th17细胞与Treg细胞存在平衡状态,机体这种平衡状态被打破更易导致肿瘤的发生[10-13]。本研究通过检测高危型和低危型HPV感染患者的外周血Treg和Th17细胞的表达,分析Th17/Treg比值,比较血清中IL-17、IL-10、TGF-β、IL-23细胞因子的表达差异,初步了解Treg、Th17细胞以及二者的比值改变与HPV免疫逃逸的关系,从而为宫颈癌的病情监测提供新的思路。
本研究发现,CC组患者高危型HPV感染率显著高于CINⅡ~Ⅲ组及CCS组(P<0.05),高危型宫颈HPV的筛查对预防CIN及CC的发生有着重要意义[2]。在CC组患者的外周血中CD4+IL17+Th17细胞百分率、CD4+CD25+Foxp3+Treg细胞百分率、Th17/Treg比值及血清中相关细胞因子显著高于CINⅡ~Ⅲ组及CCS组,说明Th17细胞及Treg细胞很可能参与CC的发生,Th17/Treg比值的改变与宫颈病变程度相关[14]。为进一步研究HPV分型与Th17/Treg比值及相关细胞因子间的关系,本研究依据HPV分型将纳入患者分为高危型HPV感染与低危型HPV感染,发现高危型HPV感染患者外周血中CD4+IL17+Th17细胞百分率、CD4+CD25+Foxp3+Treg细胞百分率及Th17/Treg比值显著高于低危型HPV感染患者。高危型HPV感染患者的血清中IL-10、IL-17、TGF-β、IL-23细胞因子的表达高于低危型,差异具有统计学意义(P<0.05)。高危型宫颈HPV可能通过诱导外周血中Th17/Treg比值的升高,改变机体免疫平衡状态而促进宫颈癌的发生。
综上所述,本研究推测Treg、Th17细胞很可能参与高危型HPV诱导宫颈癌发生的免疫逃逸过程,通过调控机体内Th17细胞及Treg细胞比值的平衡以抑制高危型HPV持续感染,有助于降低宫颈癌的发生率,对监测宫颈病变发展及预后具有一定意义。
[1]Chen WQ,Zheng RS,Zhang SW,et al.Report of cancer incidence and mortality in China,2012[J].China Cancer,2016,25(1):1-8.[陈万青,郑荣寿,张思维,等.2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,25(1):1-8.]
[2]Sudenga SL,Shrestha S.Key considerations and current perspectives of epidemiological studies on human papilloma virus persistence,the intermediate phenotype to cervical cancer[J].Int J Infect Dis,2013,17(4):e216-220.
[3]Yang W,Meng YG.Research progress on immune escape mechanism of human papilloma virus infection[J].Infect Inflamm Rep, 2014,15(4):244-247.[杨雯,孟元光.人乳头瘤病毒感染免疫逃逸机制的研究进展[J].感染、炎症、修复,2014,15(4):244-247.]
[4]Chen Z,Ding J,Pang N,et al.The Th17/Treg balance and the expression of related cytokines in Uygur cervical cancer patients[J]. Diagn Pathol,2013,81:61.
[5]Lee SJ,Yang A,Wu TC,et al.Immunotherapy for human papilloma virus associated disease and cervical cancer:review of clinical and translational research[J].J Gynecol Oncol,2016,27(5):e51.
[6]Wang XH,Qian YM,Miu L,et al.Correlation between high risk type human papilloma virus E6/E7 and cervical cancer[J].Chin J Epidemiol,2016,37(7):1003-1005.[王小红,钱艺美,缪铃,等.高危型HPVE6/E7mRNA与宫颈癌相关性分析[J].中华流行病学杂志, 2016,37(7):1003-1005.]
[7]Shang B,Liu Y,Jiang SJ,et al.Prognostic value of tumor-infiltrating FoxP3+regulatory T cells in cancers:a systematic review and metaanalysis[J].Sci Rep,2015,5:15179.
[8]Luo Q,Zhang S,Wei H,et al.Roles of Foxp3 in the occurrence and development of cervical cancer[J].Int J Clin Exp Pathol,2015,8(8): 8717-8730.
[9]Ma NY.Zhang SL.Research progress of correlation between Fork head transcription 3 and malignant gynecology tumor[J].J Int Obstet Gynecol,2013,40(3):255-257.[马宁耶,张淑兰.叉头状/翼状螺旋转录因子3与妇科恶性肿瘤相关性研究进展[J].国际妇产科学杂志,2013,40(3):255-257.]
[10]Han GC,Shen BF.Research progress of Th17 cells differentiation, regulation and action[J].Prog Biochem Biophys,2008,35(2):117-123.[韩根成,沈倍奋.Th17细胞分化、调节及效应研究进展[J].生物化学与生物物理进展,2008,35(2):117-123.]
[11]Zang MY,Wang DM,Qu CF.The role of Th17 cells in tumor[J].Int J Immunol,2013,36(3):190-195.[臧梦雅,王冬梅,曲春枫.Th17细胞在肿瘤中的作用[J].国际免疫学杂志,2013,36(3):190-195.]
[12]Shao SF,Yu CM.Expression and clinical significance of Th17 and Treg cells in peripheral blood of patients with ovarian cancer[J]. Chin J Immunol,2015,31(4):537-540.[邵素芳,于春美.卵巢癌患者外周血Th17/Treg细胞的检测及其临床意义[J].中国免疫学杂志, 2015,31(4):537-540.]
[13]Ding AP,Zhang Y,Wei H,et al.Correlation study of HPV-16 existential status with Th17/Treg cytokines[J].Natl Med J China,2013,93 (37):2957-2960.[丁爱萍,张瑶,魏恒,等.HPV16型存在状态与Treg/Th17细胞因子的相关性研究[J].中华医学杂志,2013,93(37): 2957-2960.]
[14]Hou F,Li Z,Ma D,et al.Distribution of Th17 cells and Foxp3-expressing T cells in tumor-infiltrating lymphocytes in patients with uterine cervical cancer[J].Clin Chim Acta,2012,413(23-24):1848-1854.
(2016-09-29收稿)
(2016-12-06修回)
(编辑:张抿 校对:周晓颖)
Correlation of HPV types with Th17 and Treg cells in cervical cancer
Donghui CAI,Yan LI,Runmei GUO,Tingting ZHANG,Zhifang CHEN
Zhifang CHEN;E-mail:645286940@qq.com
Department of Gynecology,the First Affiliated Hospital of Xinjiang Medical University,Urumqi 830054,China
This work was supported by the Urumqi Key Laboratory of Infection and Tumor(No.WIT-2013-02)and the Key Laboratory of Major Diseases of Xinjiang(No.SKLIB-XJMDR-2014-5)
Objective:Based on the detection of CD4+IL17+Th17 and CD4+CD25+Foxp3+Treg cells in the peripheral blood of patients with human papilloma virus(HPV),the study analyzes the ratio of Th17 to Treg and compares the different expression of cytokine IL-17,IL-10,TGF-β,and IL-23 in the serum.Methods:From September 2014 to June 2016,119 cases of untreated patients with cervical HPV infection were collected at the First Affiliated Hospital of Xinjiang Medical University,which include 46 cases of cervical cancer(CC),43 cases with cervical intraepithelial neoplasia(CIN)Ⅱ-Ⅲ,and 30 with chronic cervicitis(CCS).The detection of HPV types classified 80 patients as high-risk and 39 as low-risk.Flow cytometry examined Treg and Th17 cells,and enzyme-linked immune sorbent assay was used to test related cytokines.Results:In the infection of high-risk cervical HPV,the rate of the CC group was 87%(40/46),which was higher than that of the CINⅡ-Ⅲgroup and the CCS group,which were 77%(33/43)and 23%(7/30),respectively.For the expression of Th17 and Treg cells in the peripheral blood and the related cytokine IL-17,IL-23,TGF-β,and IL-10 in the serum,the levels of CC group were also significantly higher than that of the other two groups,and the ratio of Th17 to Treg increased considerably with the severity of cervical lesions.The expression of Th17 and Treg cells in the peripheral blood of patients with high-risk cervical HPV were higher than that of patients with low-risk cervical HPV(P<0.05),which was the same for the expression of the related cytokine IL-17,IL-23,TGF-β,and IL-10 in the serum.The ratio of the Th17 to Treg of patients with high-risk cervical HPV increased remarkably(P<0.05). Conclusion:The expression of Treg and Th17 cells in high-risk patients exhibits an increasing trend,and the ratio of increased Th17 to Treg may directly participate in the process of HPV infection and immune evasion,which plays an important role in the occurrence and development of cervical cancer.
cervical cancer,human papilloma virus,Treg cells,Th17 cells

10.3969/j.issn.1000-8179.2016.24.137
新疆医科大学第一附属医院妇科(乌鲁木齐市830054)
*本文课题受新疆乌鲁木齐市感染与肿瘤重点实验室项目(编号:WIT-2013-02)与新疆重大疾病医学重点实验室开放课题项目(编号:SKLIB-XJMDR-2014-5)资助
陈志芳645286940@qq.com
蔡冬慧专业方向为妇科肿瘤临床治疗及基础研究。
E-mail:137617265@qq.com

