组织多普勒成像测量E/Ea评价胸部放疗对患者左心室功能影响的价值
组织多普勒成像测量E/Ea评价胸部放疗对患者左心室功能影响的价值
姚世发1,江翠华2,汤燕芳2,周宁明2
(1上海交通大学医学院附属国际和平妇幼保健院,上海200030;2复旦大学附属上海市第五人民医院)
摘要:目的探讨组织多普勒成像(TDI)技术测量二尖瓣舒张早期左室充盈峰值流速(E)/舒张早期运动速度峰值(Ea)评价胸部放疗对患者左心室功能影响的临床价值。方法将80例患者依据是否联合化疗分为单纯放疗组(A组)、放疗联合化疗组(B组)各40例,分别于放疗前后采用TDI测定E、心房收缩期左室充盈峰值流速(A)、二尖瓣环收缩期运动速度峰值(Sa)、Ea、心房收缩期运动速度峰值(Aa),计算E/A、E/Ea值。结果A组放疗前后E、A、E/A、Sa比较差异无统计学意义(P均>0.05),Ea减低(P<0.05),Aa、E/Ea升高(P均<0.05);B组放疗前后E、A、E/A比较差异无统计学意义(P均>0.05),Ea、Sa减低(P均<0.05),Aa、E/Ea升高(P均<0.05);放疗后B组与A组比较,Ea、Sa降低,Aa、E/Ea升高(P均<0.05)。结论 TDI测量的E/Ea可作为评价胸部放疗患者左心室功能早期损害的敏感指标。
关键词:组织多普勒成像;放射治疗;左心功能
doi:10.3969/j.issn.1002-266X.2015.41.013
中图分类号:R541.9
文献标志码:B
文章编号:1002-266X(2015)41-0036-03
基金项目:上海市闵行区自然科学研究课题(NO.2012MHZ074)。
通信作者:江翠华
随着现代放疗技术广泛应用于胸部肿瘤的治疗,由放射线诱发的心脏损伤逐步受到重视,胸部放疗在杀伤肿瘤细胞的同时,也可导致心脏损伤,严重影响患者预后。然而,在心肌受损早期常规超声检查很少能发现结构和功能异常,只有当心肌严重受损时,才会出现心脏收缩功能指标的改变[1],而组织多普勒成像(TDI)可综合评价心脏收缩和舒张功能,较常规超声心动图能更早反映放疗所致的心功能损害[2]。本研究主要探讨应用TDI测量二尖瓣舒张早期左室充盈峰值流速(E)/舒张早期运动速度峰值(Ea)评价胸部放疗对患者左心室功能影响。
1资料与方法
1.1临床资料选取2012年6月~2013年11月接受胸部放疗的肿瘤患者80例,均经手术或穿刺病理学检查证实,均无器质性心脏病、糖尿病等,男37例、女43例,年龄31~62(48.52±8.71)岁;左侧肺癌31例、左侧乳腺癌23例、中下段食管癌16例、纵隔淋巴瘤10例。按是否应用化疗分为单纯放疗40例(A组)、放疗联合化疗40例(B组)。放疗均采用左前胸部常规分割照射,每次2 Gy,每周5次,连续5周;化疗均采用以蒽环类药物为主的化疗方案。两组性别、年龄等比较差异无统计学意义。
1.2TDI方法两组分别于放疗前后行TDI检查。采用GE Vivid E9 型彩色多普勒超声诊断仪,探头频率2~4 MHz。受检者左侧卧位,取标准心尖四腔心切面,应用脉冲多普勒获取二尖瓣血流频谱,并测定E、心房收缩期左室充盈峰值流速(A),计算E/A比值;在TDI模式下,将取样框置于二尖瓣环水平左室侧壁,分别测量二尖瓣环收缩期运动速度峰值(Sa)、Ea、心房收缩期运动速度峰值(Aa),计算E/Ea。所有测量指标均取3个连续心动周期的平均值。
1.3统计学方法采用SPSS12.0统计软件。计量资料用±s表示,组间比较采用独立样本t检验,组内比较采用配对t检验。P<0.05为差异有统计学意义。
2结果
A组放疗前后E、A、E/A、Sa比较差异无统计学意义(P均>0.05),Ea减低(P<0.05),Aa、E/Ea升高(P均<0.05);B组放疗前后E、A、E/A比较差异无统计学意义(P均>0.05),Ea、Sa减低(P均<0.05),Aa、E/Ea升高(P均<0.05);放疗后B组与A组比较,Ea、Sa降低,Aa、E/Ea升高(P<0.05)。见表1。
3讨论
放疗是临床治疗肿瘤的重要手段之一,应用不同能量射线照射肿瘤,可达到抑制和杀灭肿瘤细胞的效果,但其照射野内的正常组织结构不可避免受到一定程度的放射性损伤。放射性心脏损伤是胸部放疗的重要并发症,是胸部肿瘤存活患者的首位非肿瘤性死因[3];其主要机制是毛细血管内皮细胞和冠状动脉内皮细胞损伤,导致血管破裂和阻塞,造成心肌缺血,最终引起心肌发生纤维化,心脏功能受损[4]。由于早期放射性心脏损伤常无明显症状,因此寻找快捷、敏感的检测方法评价早期放射性心脏损伤对临床治疗方案的制订及并发症的防治十分重要。
表1 两组放疗前后TDI参数比较( ± s)
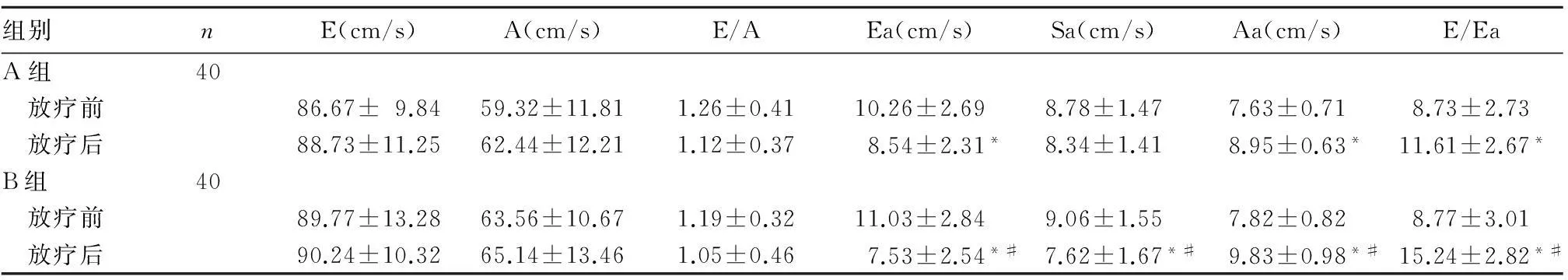
表1 两组放疗前后TDI参数比较( ± s)
组别nE(cm/s)A(cm/s)E/AEa(cm/s)Sa(cm/s)Aa(cm/s)E/EaA组40 放疗前86.67±9.8459.32±11.811.26±0.4110.26±2.698.78±1.477.63±0.718.73±2.73 放疗后88.73±11.2562.44±12.211.12±0.378.54±2.31*8.34±1.418.95±0.63*11.61±2.67*B组40 放疗前89.77±13.2863.56±10.671.19±0.3211.03±2.849.06±1.557.82±0.828.77±3.01 放疗后90.24±10.3265.14±13.461.05±0.467.53±2.54*#7.62±1.67*#9.83±0.98*#15.24±2.82*#
注:与同组放疗前比较,#P<0.05;与A组同期比较,#P<0.05。
TDI是近年兴起的一种对心脏功能进行评价的影像学检查技术,能够对运动功能进行定量分析,对于评价心脏功能具有更加可靠的效果。TDI能区分主动和被动的心肌节段性收缩,并且可以把心室功能的同步性进行量化从而评价心脏功能[5,6],更易被临床应用,可作为一种新的无创的检查方法应用于临床,更早更精确地对放疗导致的心脏功能损害进行评价。二尖瓣环是位于左心房室之间的纤维组织环,其运动为复杂的三维模式。二尖瓣环收缩期朝向心尖运动反映左心室长轴方向缩短、舒张期背离心尖运动反映其舒张[7],故二尖瓣环沿左心室长轴方向位移是评价左心功能的指标。王志斌等[8]研究表明,Ea与左室舒张功能分级之间存在良好的相关性,随着左室舒张功能损害程度的加重,Ea逐渐变小。E易受左室弛缓功能和前负荷的影响;而Ea只受左室弛缓功能的影响,不受左室充盈压的影响,E/Ea消除了左室弛缓功能的影响。同时,因为Ea反映多切面、多位点舒张早期二尖瓣环运动速度,E反映左室整体舒张功能指标,因此E/Ea可作为评价左室舒张功能不全的重要指标[9];其不受性别、心率、二维图像参数及左心室射血分数等因素影响,与左室舒张末压及肺毛细血管嵌压具有良好的相关性[10,11]。国外有文献报道[12,13],E/Ea是预测心肌梗死后心力衰竭及死亡的预测指标,E/Ea>15是最强的预测因子。Lee等[14,15]研究证明,在系统性红斑狼疮及硬皮病患者中E/Ea比E/A评价左室舒张功能更敏感。本研究发现,两组资料中放疗前后E、A、E/A差异均无统计学意义。在A组Ea减低,Aa、E/Ea升高,Sa差异无统计学意义,提示单纯放疗后左室功能早期损伤以舒张功能为主,收缩功能未见明显受累;而B组Sa较放疗前减低,E/Ea较单纯放疗组升高,提示放疗联合化疗左室舒张功能损伤更加明显,且左室收缩功能受累。分析可能的原因是:化疗剂与放疗对组织损伤具有协同作用;蒽环类化疗剂可以引起自由基介导的心肌细胞受损,导致心肌细胞空泡形成、水肿等;化疗与放疗结合的相加作用抑制亚致死性损伤修复。
综上所述,TDI测量的E/Ea是评价胸部放疗对心脏早期损害的一种无创有效手段。此外,放疗联合应用化疗对心脏损伤具有相加作用,可加速心脏收缩功能的损害。
参考文献:
[1] Heidenreich PA, Hancock SL, Vagelos RH, et al. Diastolic dysfunction after mediastinal irradiation[J]. Am Heart J, 2005,150(5):977-982.
[2] Su HM, Lin TH, Voon WC, et al. Impact of preload alterations by haemodialysis on the Tei index:comparison between pulsed flow and tissue Doppler analyses[J]. Acta Cardiol, 2007,62(1):25-30.
[3] Giraud P, Cosset JM. Radiation toxicity to the heart: Physiopathology and clinical data[J]. Bull Cancer, 2004,91(Suppl 3):147-153.
[4] Martin M, Lefaix J, Delanian S. TGF-beta1 and radiation fibrosis: a master switch and a specific therapeutic target[J]. Int J Radiat Oncol Bio Phys, 2000,47(2):277-290.
[5] Møller JE, Pellikka PA, Hillis GS, et al. Prognostic importance of diastolic function and filling pressure in patients with acute myocardial infarction[J]. Circulation, 2006,114(5):438-444.
[6] Yu CM, Sanderson JE, Marwick TH, et al. Tissue Doppler Imaging a new prognosticator for cardiovascular disease[J]. J Am Coll Cardiol, 2007,49(19):1903-1914.
[7] Gulati VK, Katz WE, Follansbee WP, et al. Mitral annular descent velocity by tissue Doppler echocardiography as an index of global left ventricular function[J]. Am J Cardiol, 1996,77(11):979-984.
[8] 王志斌,孙兆家,李艳,等.组织多普勒成像技术评价左室舒张功能的临床价值[J].山东医药,2003,43(11):1-3.
[9] 张琦,吴迪,范煜东,等.组织多普勒指标E/E′与B型钠尿肽在舒张性心力衰竭诊断中的临床意义[J].中国心血管病研究,2014,12(10):923-927.

