不稳定型心绞痛患者血液标本保存时间对血浆miRNAs检测水平的影响
不稳定型心绞痛患者血液标本保存时间对血浆miRNAs检测水平的影响
李云1,2,宋银宏2,吕云波1,秦琴1
(1三峡大学人民医院,湖北宜昌 443000;2三峡大学医学院)
摘要:目的探讨血液标本保存时间对不稳定型心绞痛患者血浆中miRNAs(miRNA-21、miRNA-24、miRNA-126、miRNA-146、miRNA-223)检测水平的影响,确定其检测时间窗。方法选取6例接受冠脉造影检查的不稳定型心绞痛患者,造影时抽取外周动脉血分装于6支EDTA抗凝管中,每管2 mL;其中3管立即离心分离血浆,4 ℃冰箱保存;余3管全血放入4 ℃冰箱保存。采用实时荧光定量聚合酶链反应方法,3管血浆分别于即刻(0 h)、24 h、1周后检测miRNAs水平,3管全血分别于4、24 h及1周后离心获得血浆再检测miRNAs水平,比较各时间段血浆miRNAs水平的差异。结果①与0 h时比较,血液标本即刻离心保存24 h后血浆miRNA-21、miRNA-24、miRNA-126、miRNA-223水平下降(P均<0.05),1周后血浆5种miRNA水平均明显下降(P均<0.05)。②与0 h时比较,全血保存4 h后离心分离检测血浆miRNA-21水平下降(P<0.05),24 h后血浆5种miRNA水平均下降(P均<0.05)。结论 不稳定型心绞痛患者保存不同时间血浆中miRNAs稳定性不一;其中血浆miRNA-21稳定性最差,需取血后即刻检测。
关键词:心绞痛,不稳定型;血液标本;保存时间;miRNAs
doi:10.3969/j.issn.1002-266X.2015.41.004
中图分类号:R541.1;R33
文献标志码:A
文章编号:1002-266X(2015)41-0010-03
Abstract:ObjectiveTo investigate the effect of blood-preserving time on the expression of miRNAs (miRNA-21, miRNA-24, miRNA-126, miRNA-146 and miRNA-223 ) in the plasma of patients with unstable angina pectoris (UAP), and to make sure the time window for checking their expression in plasma clinically. MethodsSix UAP patients who accepted coronary angiography were selected as subjects. The peripheral blood (PB) samples of the patients were collected in EDTA anticoagulant tubes and separated into 6 tubes (2 ML in each). During the six tubes, the plasma of 3 tubes were separated, and was preserved at 4℃, the other 3 tubes were preserved at 4 ℃.The levels of miRNAs were detected in the 3 tubes at the moment of centrifugation (0 h), 24 h and one week later by real-time fluorescent quantitative PCR. The same procedures were conducted in the other 3 tubes of whole blood after the plasma was collected. The levels of plasma miRNAs were compared at different time points.Results① The concentrations of miRNA-21, miRNA-24, miRNA-126 and miRNA-223 in plasma were decreased significantly after being stored for 24 h as compared with the moment of 0 h(all P<0.05). The concentrations of all the 5 miRNAs in plasma were decreased significantly after being stored for one week as compared with that of 24 h(P<0.05). ② The concentration of miRNA-21 in plasma was decreased significantly after being stored for 4 hours as compared with that of 0 h(P<0.05),and the concentrations of 5 miRNAs in plasma were decreased significantly after being stored for 24 h (P<0.05). ConclusionThere are differences among the stabilities of different miRNAs in plasma of UAP patients, and miRNA-21 must be examined immediately owing to its poor stability.
基金项目:三峡大学2013年青年科学基金资助项目(KJ2013A012)。
作者简介:第一李云(1977-),女,主治医师,硕士,研究方向为miRNA与心血管疾病。E-mail:2640217250@qq.com 通信宋银宏(1972-),女,副教授,博士,研究生导师,研究方向为肿瘤免疫。E-mail:2646561487@qq.com
收稿日期:(2015-08-03)
Effect of blood-preserving time on expression of miRNAs in plasma
of patients with unstable angina pectoris
LIYun1,SONGYin-hong,LYUYun-bo,QINQin
(1ThePeople′sHospitalofThreeGorgesUniversity,Yichang443000,China)
Key words: angina, unstable; blood specimens; preserving time; miRNAs
目前,许多关于microRNAs(miRNAs)作为临床疾病诊断标志物的研究,均要求标本2 h内送检;然而在实际临床工作中有时难以满足这一时间要求。为了明确血液标本保存时间对miRNAs检验结果的影响,我们分别观察获取血液标本立即离心分离血浆后保存不同时间血浆的miRNAs水平以及全血保存不同时间离心分离血浆的miRNAs水平,探讨不同检测时间对血浆miRNAs水平的影响。
1资料与方法
1.1临床资料选择 2014年10月~2015年1月宜昌市人民医院行冠状动脉(冠脉)造影检查不稳定型心绞痛患者6例,其中男4例、女2例,年龄(59.7±4.7)岁。入选患者均有典型的不稳定型心绞痛症状并冠脉造影检查阳性(单支主干血管或主要分支病变狭窄≥50%),并排除急性心肌损伤、急性感染、肝肾功能不全、肿瘤、风湿免疫性疾病及传染病。患者同意本研究并签署知情同意书,该研究获得宜昌市伦理委员会批准。
1.2检测方法
1.2.1实验设计冠脉造影时取患者外周动脉血14 mL,分装6支EDTA抗凝管中,每管2 mL。其中3管立即离心分离血浆,4 ℃冰箱保存;余3管全血放入4 ℃冰箱保存。3管血浆分别于即刻(0 h)、24 h、1周后检测miRNA水平。3管全血分别于4 h、24 h及1周后离心分离获得血浆再检测miRNA水平。
1.2.2血浆miRNAs检测分离血浆后用 Tiangen公司生产的提取分离试剂盒分离提取血浆RNA并加尾,逆转录为cDNA,严格按照说明书进行操作。RNA加Poly(A)尾反应体系为:总RNA 10μL、E coli Poly(A) 聚合酶0.4 μL (5 U/μL)、10×Poly(A) 聚合酶缓冲液 2 μL、5×rATP溶液 4 μL、无RNA酶水 3.6 μL;反应条件为37 ℃、60 min;逆转录合成cDNA的反应体系为:Poly(A)反应液2 μL、10×RT Primer 2 μL、10×RT 缓冲液 2 μL、超纯 dNTPs 1 μL、RNasin 1 μL(40 U/μL)、Quant Rtase 0.5 μL、无RNA酶水11.5 μL;反应条件为37 ℃、60 min。以miRNA-16作为内参[1~3],用实时定量PCR法检测不同保存时间血液标本中miRNA-21、miRNA-24、miRNA-126、miRNA-146、miRNA-223表达水平。miRNA-16的上游引物为5′-GATAGCAGCAGGTAAACATTGGCG-3′;miRNA-21的上游引物为5′-CGCCTACCTTATGAGACTGATGTTGAA-3′;miRNA-24的上游引物为5′-TGGCTCAGGTCAG CAGGAACAG-3′;miRNA-126的上游引物为5′-CCTCGTTCCGTGAGTAATAATGCG-3′;miRNA-146的上游引物为5′-CGATGAGAACTGAAATCCTTGGGTTA-3′;miRNA-223的上游引物为5′- TCCTGTCAGTCTGTCAAATACCCCA-3′;下游引物由试剂盒提供。反应条件:94 ℃预变性2 min,主循环为94 ℃变性20 s,60 ℃退火延伸34 s,共45个循环。计算3个复孔平均值作为每个样本实际 Ct 值,将同一样本 Ct 值减去其内参 Ct 值,得到ΔCt 值。运用miRNA表达倍数改变值2-ΔΔCt对定量结果进行分析[4,5],ΔΔCt=ΔCt处理样本-ΔCt对照样本,将最后得到的2-ΔCt值进行统计学分析。
1.3统计学方法采用 SPSS19.0 统计软件。检测数据以±s表示,不同时间段检测miRNAs数据比较采用单变量重复测量方差分析。P<0.05 为差异有统计学意义。
2结果
2.1即刻分离血浆后保存不同时间血浆miRNAs水平与0 h时比较,24 h血中miRNA-21、miRNA-24、miRNA-126、miRNA-223水平下降(P均<0.05),血浆miRNA-146水平改变无统计学意义(P>0.05);1周后血浆中5种miRNAs水平均明显下降(P均<0.05)。见表1。
表1 即刻分离血浆后保存不同时间血浆
miRNAs水平比较( n=6, ± s)

表1 即刻分离血浆后保存不同时间血浆
检测时间miRNA-21miRNA-24miRNA-126miRNA-146miRNA-2230h0.301±0.1030.060±0.0230.621±0.4300.090±0.0321.328±1.02324h0.153±0.080*0.025±0.011*0.104±0.085*0.048±0.0210.216±0.101*1周0.002±0.001*0.003±0.001*0.001±0.001*0.002±0.001*0.001±0.001*
注:与0 h相比,*P<0.05。
2.2全血保存不同时间分离血浆miRNAs水平与0 h时比较,4 h离心分离检测血浆miRNA-21水平下降(P<0.05),24 h血浆miRNA-24、miRNA-126、miRNA-146、miRNA-223水平下降(P均<0.05);1周后血浆miRNA-223水平回升,与0 h相比无统计学差异(P>0.05)。见表2。
表2 全血保存不同时间分离血浆miRNAs
水平比较( n=6, ± s)
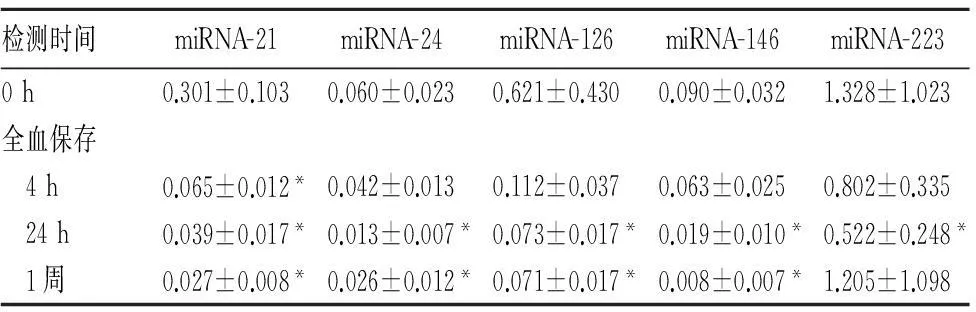
表2 全血保存不同时间分离血浆miRNAs
检测时间miRNA-21miRNA-24miRNA-126miRNA-146miRNA-2230h0.301±0.1030.060±0.0230.621±0.4300.090±0.0321.328±1.023全血保存 4h0.065±0.012*0.042±0.0130.112±0.0370.063±0.0250.802±0.335 24h0.039±0.017*0.013±0.007*0.073±0.017*0.019±0.010*0.522±0.248* 1周0.027±0.008*0.026±0.012*0.071±0.017*0.008±0.007*1.205±1.098
注:与0 h相比*P<0.05。
3讨论
miRNAs是近年来发现的一类高度保守的小分子单链RNA,广泛存在于人体的各种组织,能通过非特异性识别靶基因mRNA3′UTR 区域使 mRNA 降解、抑制或激活,从而调节细胞的多种生物功能。miRNAs的异常与人类多种疾病密切相关,如高血糖可通过下调miRNA-223、miRNA-146a促进动脉粥样硬化及血栓的形成。急性心肌梗死时血浆中miRNA-208a、miRNA-146、miRNA-1水平明显增高,并且增高的幅度与心肌梗死面积有关[6,7],提示miRNAs异常可以引起或预示相应的病理生理改变。研究发现,miRNAs不仅存在于细胞内还能释放入血,并在血液及体液中稳定存在。已知miRNAs能和微泡、蛋白质、脂蛋白复合体结合抵抗酸碱及核酸酶的破坏并能反复冻融,提示miRNAs可作为一种新的生物标志物[8~10]。
外周血中RNA的稳定性较差,极易被细胞内外的核酸酶降解。而血浆中的miRNAs由于和微泡、蛋白质、脂蛋白复合体结合在一起能抵抗核酸酶及酸碱的破坏,相对较稳定。但是这种结合并非一成不变,而是一个动态的平衡过程。故而血浆标本中的miRNAs随着时间的推移逐渐被降解。本实验数据显示不同的miRNAs的稳定性不一,5种miRNAs中miRNA-21的稳定性较差,考虑与其碱基系列及键能较低有关,5种成熟的miRNAs中miRNA-21的CG碱基水平最低。全血保存4 h后血浆中的miRNA-21水平即有明显改变,因此需及时(2 h内)离心分离检验。分离血浆后保存24 h后血浆miRNA-146的水平较0 h无差异,然而全血保存24 h后明显降低,提示实验结果误差与样本量偏小有关。血浆及全血保存24 h后血浆miRNA-21、miRNA-24、miRNA-126、miRNA-223水平均明显下降,推测4 ℃miRNAs的血浆保存时间不能超过24 h。同时我们发现分离血浆后保存与全血保存血浆中5种miRNAs水平随时间延长均为下降趋势,但全血保存1周后血浆miRNA-223的水平出现明显回升,提示血细胞能影响血浆miRNAs的水平。已知miRNA-21主要存在于血管平滑肌细胞内,miRNA-24、miRNA-126主要存在于血管内皮细胞内,miRNA-146主要存在于单核淋巴细胞内,而miRNA-223主要存在于血小板内。成熟的miRNAs主要存在于细胞的胞质内,细胞坏死时胞质内的miRNAs释放入血,导致血浆中的miRNAs水平升高。血管平滑肌细胞的寿命较长,而血小板的寿命较短,大约1周左右,不同细胞的寿命及稳定性不一致导致其对血浆miRNAs水平的影响不一。
冠脉病变及组织缺氧时细胞内miRNA-21、miRNA-24、miRNA-146的表达上调从而调节血管的增殖及新生内膜的形成,同时影响动脉斑块的稳定性[11~13]。而不稳定型心绞痛的病理学基础是冠脉的不稳定斑块,因此miRNA-21、miRNA-24、miRNA-146的水平直接影响不稳定型心绞痛患者的病程及预后。冠脉病变时血浆miRNA-126水平下降,miRNA-126或可作为冠心病血管损伤的生物标志物。miRNA-223富含于血小板中,可作用于受体蛋白相应的mRNAs从而参与血小板黏附、聚集、激活的过程,调节血小板的活化,在血栓性心脑血管疾病发生、发展的病理生理过程中起着非常重要的作用。因此血浆miRNAs的检测对不稳定型心绞痛患者的诊治意义重大。
参考文献:
[1] Raid G, Kirschner MB, van Zandwijk N. Circulating miRNAs: Association with disease and potential use as biomarkers[J]. Crit Rev Oncol Hrmatol, 2011,80(2):193-208.
[2] 刘益民,杜鲁涛,王丽丽,等,膀胱癌患者血清miRNA检测中内参基因的筛选及验证[J].山东大学学报 ( 医学版),2015,52(5):86-91.
[3] Song J,Bai Z,Han W,et al. Identification of suitable reference genes for qPCR analysis of serum miCroRNA in gastric cancer patients[J], Dig Dis Sci, 2012,57(4):897-904.
[4] Kin K, Miyagawa S, Fukushima S, et al. Tissue-and plasma-specific microrna signatures for atherosclerotic abdominal aortic aneurysm[J]. J Am Heart Assoc, 2012,1(5):e000745.
[5] Wang X, Sundquist J, Zoller B, et al. Determination of 14 circulating microRNAs in Swedes and Iraqis with and without diabetes mellitus type 2[J]. PLoS One, 2014,9(1):e86792.
[6] D′Alessandra Y, Devanna P, Limana F, et al. Circulating microRNAs are new and sensitive biomarkers of myocardial infarction[J],Eur Heart J, 2010,31(22):2765-2773.
[7] Fichtlscherer S, Zeiher AM, Dimmeler S. Circulating microRNAs: biomarkers or mediators of cardiovascular disease[J].Arterioscler Thromb Vasc Biol, 2011,31(11):2383-2390.
[8] Gibbings DJ, Ciaudo C, Erhardt M, et al. Multivesicular bodies associate with components of miRNA effector complexes and modulate miRNA activity [J]. Nat Cell Biol, 2009,11(9):1143-1149.
[9] Arroyo JD, Chevillet JR, Kroh EM, et al. Argonaute 2 complexes carry a population of circulating microRNAs independent of vesicles in human plasma [J]. Proc Natl Acad Sci U S A, 2011,108(12):5003-5008.
[10] Vickers KC, Palmisano BT, Shoucri BM, et al.MicroRNAs are transported in plasma and delivered to recipient cells by highdensity lipoproteins[J]. Nat Cell Biol, 2011,13(4):423-433.
[11] Ji R, Cheng Y,Yue J, et al. MicroRNA expression signature and antisense-mediated depletion reveal an essential role of microRNA in vascular neointimal lesion formation[J]. Circ Res,2007,100(11):1579-1588.
[12] Kulshreshtha R, Ferracin M, Wojcik SE, et al. A microRNA signature of hypoxia[J]. Mol Cell Biol, 2007,27(5):1859-1867.
[13] Yang K, He YS, Wang XQ, et al. MiR-146a inhibits oxidized low-density lipoprotein-induced lipid accumulation and inflammatory response via targeting toll-like receptor 4[J]. FEBS Lett, 2011,585(6):845-860.

