好氧颗粒污泥对水中橘黄的吸附特性
好氧颗粒污泥对水中橘黄的吸附特性*
张彦灼 李军†李芸 陈光辉卞伟
(北京工业大学 建筑工程学院∥水质科学与水环境恢复工程北京市重点实验室, 北京 100124)
摘要:利用好氧颗粒污泥(AGS)对碱性染料橘黄(SY)进行吸附试验,研究了不同pH值、吸附剂用量、SY初始浓度和温度对吸附过程的影响.发现:溶液的pH值是影响吸附效果的一个重要因素,pH值为2、AGS用量为2 g/L和温度为35℃时吸附效果最好;平衡吸附量与SY染料初始浓度呈正相关;Langmuir吸附模型能够较好地描述整个吸附过程,饱和吸附量为142.86 mg/L,吸附动力学符合准二级动力学模型.热力学分析表明吸附是一个自发的吸热过程,且低浓度比高浓度时的吸附亲合力好.实验结果表明AGS可以作为吸附SY染料的低成本吸附剂.
关键词:吸附;动力学;热力学;好氧颗粒污泥;橘黄
中图分类号:X703.1
doi:10.3969/j.issn.1000-565X.2015.03.019
文章编号:1000-565X(2015)03-0137-06
收稿日期:2014-09-15
基金项目:* 国家科技重大专项(2012ZX07403-001);住房和城乡建设部研究开发项目(2009-K7-4);国家自然科学基金资助项目(51178321)
作者简介:关小红(1977-),女,教授,博士生导师,主要从事水污染控制研究.E-mail: guanxh@tongji.edu.cn
染料在各个行业中都有广泛应用,如纺织、纸浆、纸张的生产、植物染色、油漆和油墨等的生产需要使用大量染料.染料废水处理难度大是因为染料脱色困难和遇光不易分解[1].偶氮类染料作为种类最多并且数量最大的有机染料,广泛应用于纺织、造纸和皮革工业[2].由于工业的快速发展,大量偶氮类染料废水排放对环境造成了严重污染,其污染程度已经超过了环境的自净能力.偶氮类染料及其分解产物可能通过水生环境使人类中毒、诱变或者致癌[3-5].因此,处理环境中的染料废水变得比以往任何时候都重要[6].橘黄(SY)是一种吡唑啉酮染料(阴离子染料),通常用于食品生产,如饮料、糖果、乳制品和面包等产品[1].处理环境中染料废水最困难的是对其色度的去除,利用传统的处理方法效果不显著[7].在众多的染料处理方法中(物理、化学、生物、电化学氧化和吸附法),吸附是最为有效的一种方法[8].吸附是一种常见和高效的废水处理技术,原理是基于溶质分子转移到一个活跃的吸附剂表面.吸附优于其他染料处理技术,其初始成本低,设计简单,操作便捷[9-10].
好氧颗粒被认为是由自固定化细胞组成的一种特殊生物膜,在过去20年,深入研究生物废水处理等领域的应用表明生物膜在污水净化方面比悬浮活性污泥更有效[11].与传统的活性污泥相比,好氧颗粒污泥具有良好的沉降性能,密集的微生物结构和孔隙度,这表明它满足生物吸附剂对染料去除的基本要求[12].Gao等[12]利用灭活好氧颗粒污泥吸附水中的酸性黄;Sun等[13]利用好氧颗粒污泥吸附水中的孔雀绿;Xu等[14]利用好氧颗粒污泥对水中重金属进行吸附.由于好氧颗粒污泥(AGS)的研究时间较短,国内外利用AGS对SY染料的吸附研究目前鲜有报道.鉴于此,为了SY染料废水的治理及AGS的应用,进一步加强以好氧颗粒污泥为吸附剂处理水中偶氮类染料的研究是非常必要的.文中利用实验室培养的好氧颗粒污泥作为吸附剂,用于吸附水溶液中阴离子型染料SY,通过该实验为吸附处理技术在偶氮类染料废水污染治理中的应用提供技术支撑.
1材料与方法1.1好氧颗粒污泥
实验用污泥为实验室培养的AGS.AGS的培养过程为:取北京某污水处理厂曝气池的活性污泥作为种泥装入序批式间歇(SBR)反应器中.SBR反应器特征为:圆柱形,高径比为6.5,有效体积为25L,容积交换率为50%;维持水温在25℃.SBR反应器在培养初期通过电磁式空气泵进行曝气,空气流量为0.2m3/h.每天运行4个周期,进水5min,曝气330min,沉淀20min,排水5min.1个周期为360min,静止沉淀时间随着培养时间梯度缩小至1min.稳定运行20天后,在反应器内获得AGS,65天后AGS成熟,颗粒尺寸约4.0mm,污泥浓度(MLSS)为3 000mg/L左右,污泥容积指数(SVI)平均为65mL/g(见图1(a)).

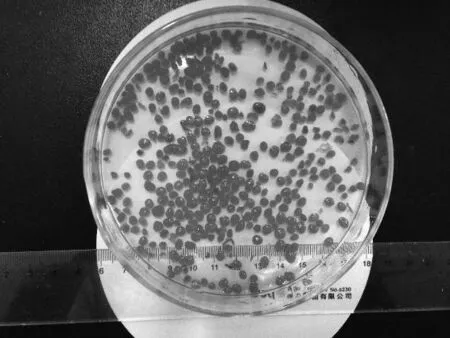
( a) AGS吸附 SY染料前 ( b) AGS吸附 SY染料后
Fig.1Imagesofaerobicgranularsludgebeforeandaftersunsetyellowadsorption
1.2 橘黄染料
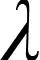
1.3实验方法
吸附前,AGS用去离子水洗涤3次,去除表面可溶性离子,吸附试验在一定温度下进行,在容量为1L的三角烧瓶中加入一定量的AGS吸附剂及SY染料溶液,然后放入恒温振荡培养箱中(BS-1E,金坛市医疗仪器厂),以150r/min的速度振荡,直至达到吸附平衡,AGS仍然能够保持较好的颗粒完整性(见图1(b)).
进行静态吸附,溶液的pH值用1mol/LHCl和1mol/LNaOH调节,将其放入恒温振荡器培养箱中振荡24h,为保证操作步骤的一致性,在每个时间点取样时,吸取上清液并且在3200r/min离心2min,用紫外分光光度法测量上清液的染料浓度.通过测定吸附前后溶液中的染料浓度,根据式(1)计算吸附量.
研究AGS用量对SY吸附量的影响,AGS用量为0.5~2.5g/L,SY质量浓度为175mg/L,pH值为2,确定AGS最优用量为2.0g/L用于后面的连续试验;研究在不同SY初始质量浓度下AGS对吸附的影响,AGS用量为2.0g/L,pH值为2,SY初始质量浓度为50~250mg/L.笔者进行了吸附等温线、吸附动力学及热力学分析.
1.4分析方法
染料浓度的测定:将待测溶液用高速离心机(52A型,河北省安新县白洋离心机厂)进行固液分离,取上清液用去离子水稀释到0~10mg/L,用紫外可见分光光度计(UV-765,上海精密科学仪器有限公司制造)在SY的最大吸收波长482nm处测吸光度,根据标准曲线计算染料溶液浓度.
pH值测定:采用便携式pH测定仪(WTWMTQ/TC2020,德国).
吸附量:AGS在吸附平衡时对染料SY的吸附量qe为
(1)
式中:ρ0为吸附质的初始质量浓度,mg/L;ρe为吸附质的平衡质量浓度,mg/L;V为溶液体积,L;m为吸附剂质量,g.
2结果与讨论2.1影响SY吸附的因素
2.1.1pH值的影响
图2(a)示出了qe和初始pH值之间的关系.其中SY初始质量浓度为150mg/L,吸附剂用量为1.5g/L,温度为35℃,试验时间为24h,振荡速度为150r/min.从图2(a)可以看出,当pH值从1上升到2时,AGS吸附能力明显增强,qe从81.88mg/g上升到94.12mg/g,而当pH值从2上升到6时,AGS的吸附能力显著降低,qe从94.12mg/g快速下降到27.33mg/g,当pH值从6上升到12时,qe几乎不变,其值在27mg/g左右.
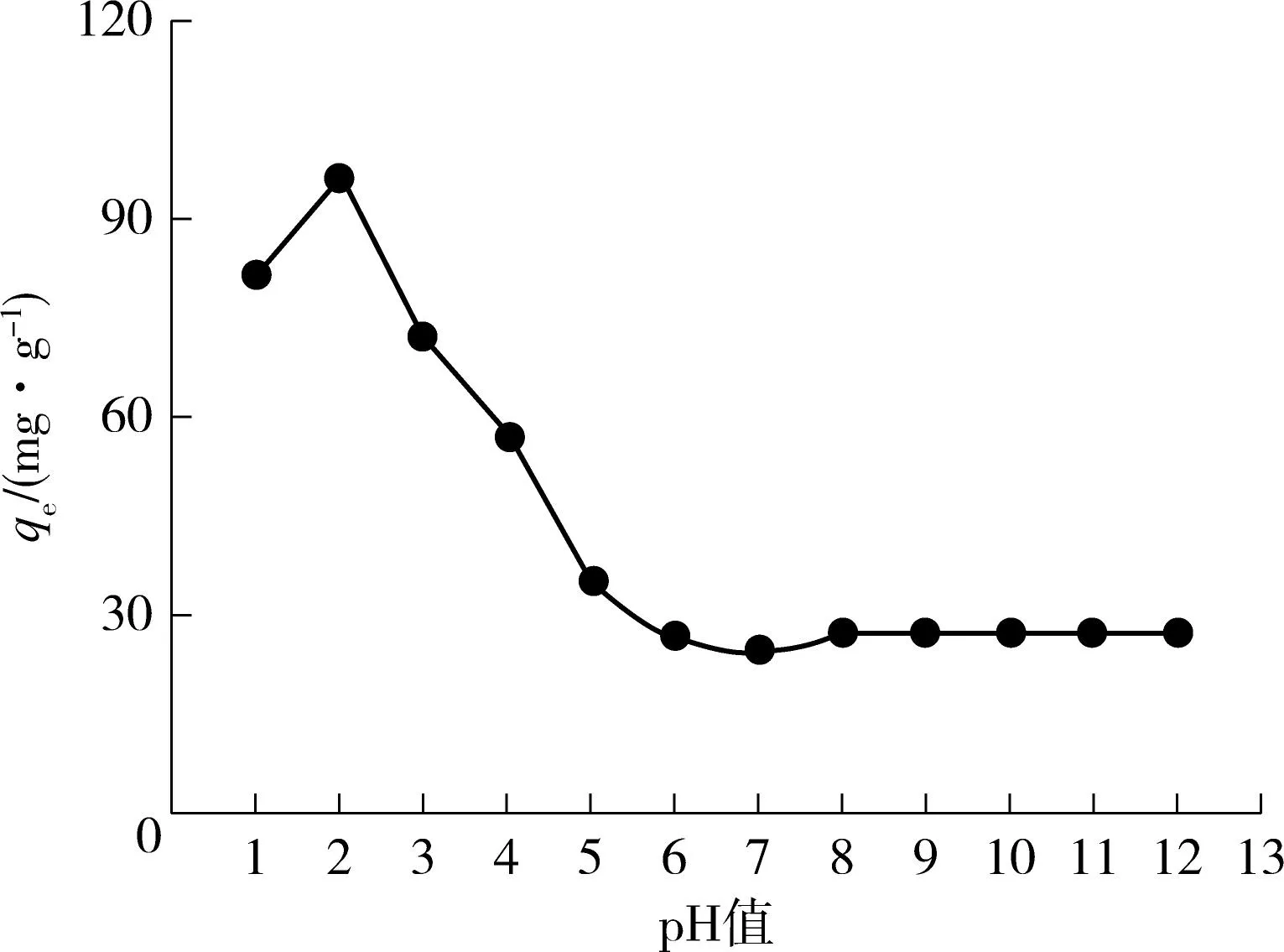
( a) pH值的影响
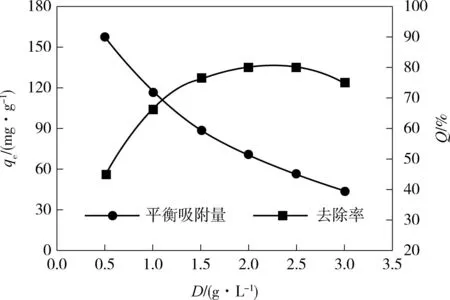
( b)吸附剂用量的影响
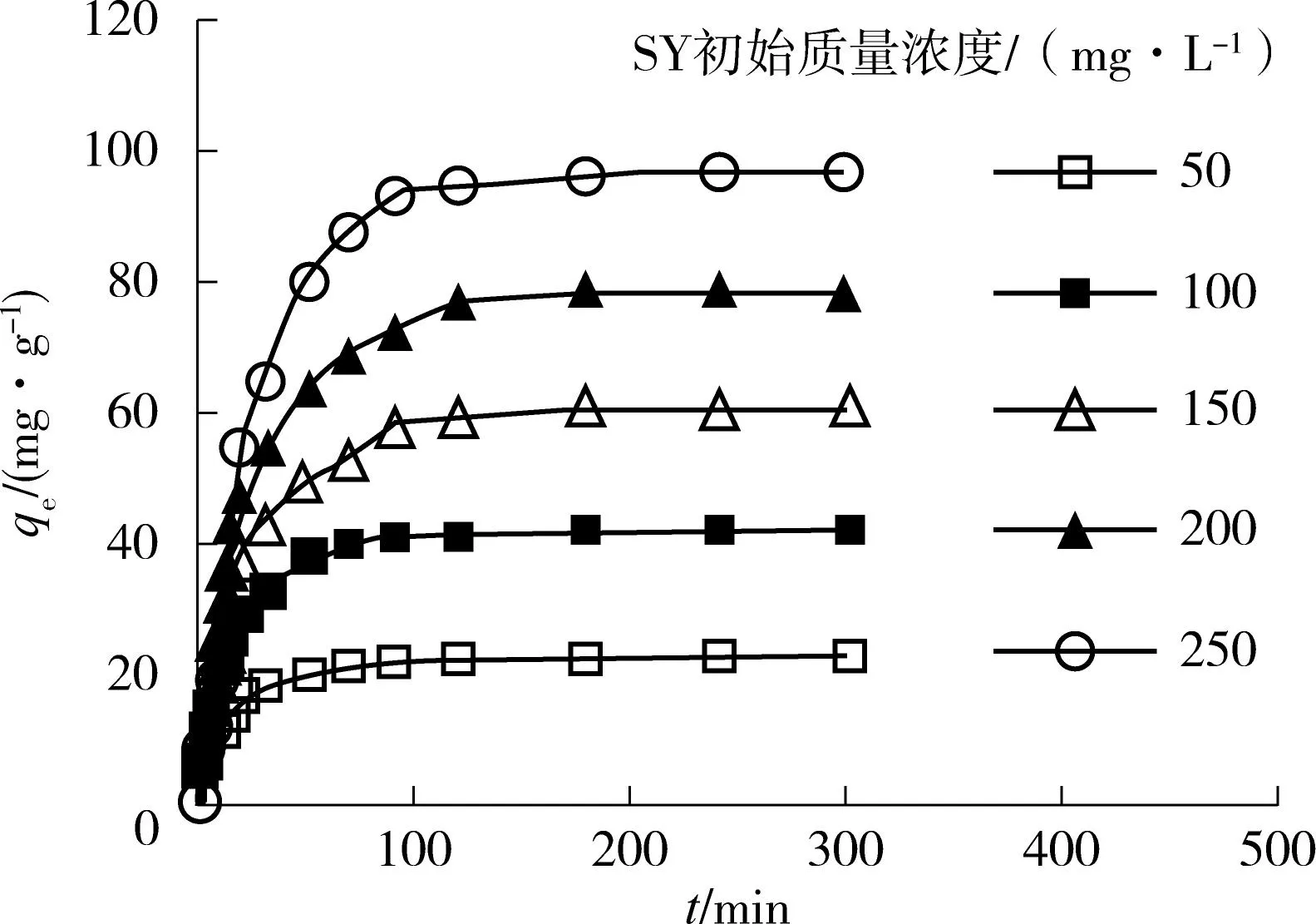
( c)染料初始浓度的影响
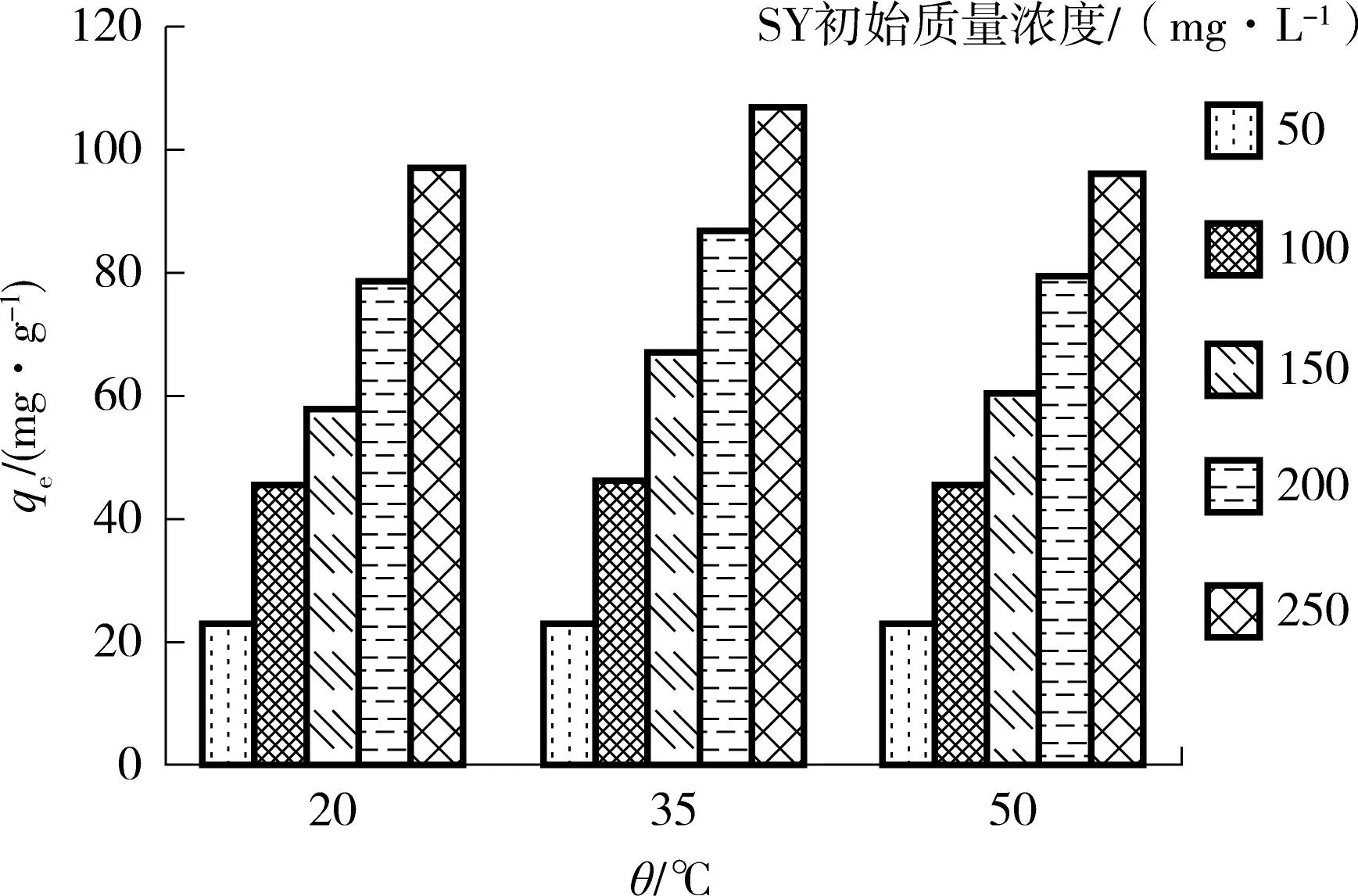
(d)温度的影响 图2 pH 值、吸附剂用量、染料初始浓度和温度对好氧颗粒污泥吸附橘黄的影响 Fig.2 Effects of pH value,adsorbent dosage,initial dye concentration and temperature on the adsorption of sunset yellow by aerobic granular sludge
在水溶液中,SY中的磺酸盐D-SO3Na在水中解离为阴离子形式[15]:
(2)
H+存在的条件下,AGS中的氨基被质子化[13]:
Biomass—NH2+H+
(3)
生物吸附过程可能是由于带负电荷的染料阴离子与带正电的细胞表面的静电吸引作用引起的.氢离子还可以在AGS和染料分子之间作为桥接配位体[16]:
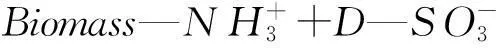
(4)
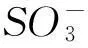
2.1.2AGS用量的影响
图2(b)示出了AGS吸附剂用量(D)对qe和去除率(Q)的影响,其中吸附剂用量分别为0.5~3.0g/L,pH值为2,温度为35℃,SY初始质量浓度为175mg/L,吸附时间为24h,振荡速度为150r/min.从图2(b)中可知,AGS吸附剂的qe随着用量的增加而减少;当AGS用量较少时,随着用量的增加SY染料的去除率呈现增加的趋势.这可能是因为在AGS用量较低时,颗粒与颗粒之间的距离较大,每一个颗粒周围就会有相对较多的SY分子聚集,有利于AGS与SY染料分子之间有效的表面吸附和离子交换,因此,颗粒的数量增加会提供更多的吸附点位来吸附SY染料,去除率随之增加;而当染料继续增加,其在溶液中的分布密度达到一定值时,颗粒与颗粒之间的距离会变小,能够利用的吸附点位减少,表面吸附和离子交换减少,从而对SY染料的吸附量减少,导致去除率下降.Vilar等[19]提出,高浓度的吸附剂外围会形成屏蔽效应,阻止吸附质与吸附位点的结合,导致吸附容量减小.Zheng等[20]认为:为加快吸附进程,染料分子会垂直地黏附在颗粒污泥的表面上,因为这个方向需要的能量最小,在污泥浓度较小时,较高的吸附容量可归结为染料分子垂直地吸附在颗粒污泥表面.此外,SY染料的qe随着AGS用量的增多而减小,单位质量上的吸附量趋于下降趋势,这可能是由于吸附位点的叠加或者堵塞导致吸附面积减少造成的[21].结果显示,该试验AGS最佳用量为2.0g/L.
2.1.3SY初始浓度的影响
图2(c)示出了SY染料在不同的初始质量浓度(50~250mg/L)下qe和时间t的关系,其中AGS吸附剂用量为2.0g/L,pH值为2,温度为35℃,吸附时间为24h,振荡速度为150r/min.从图2(c)中可知,SY染料在120min以前大部分被去除,180min达到吸附平衡.SY染料在50min前的吸附速率较大,50min以后吸附速率逐渐变小.随着SY染料的初始质量浓度从50mg/L增加到250mg/L,AGS的qe由22mg/L上升到97mg/L.吸附初期,AGS对SY染料的平衡吸附量和去除率上升较快,是因为AGS提供了巨大的表面积使得吸附的发生能够快速进行,使SY染料分子与AGS众多的吸附位点有更多接触的机会,所以前50min吸附速率较快,随着时间的推移,可吸附点位越来越少,吸附速率逐渐放缓.这种先快后慢的过程也可以通过浓度差来解释,由于SY染料刚加入时AGS表面和溶液中染料分子的浓度差最大,因此产生的吸附推动力也最大,随着时间的推移,AGS表面和溶液中SY染料分子的浓度差逐渐减小,因而吸附推动力减弱,吸附过程趋于缓慢,最终达到平衡.Njoku等[22]利用红毛丹果皮吸附酸性黄17染料时,酸性黄17染料的初始浓度对qe和时间t的关系也得到了相似的吸附曲线.
2.1.4温度的影响
图2(d)示出了SY染料在温度θ为20、35和50℃、SY染料初始质量浓度为50~250mg/L、AGS吸附剂用量为2.0g/L、pH值为2、吸附时间为24h、搅拌速度为150r/min的情况下各初始质量浓度的qe和温度θ的关系.从图中可知,随着温度θ的升高,qe呈现先增加后下降的趋势,在低浓度时(50~100mg/L)其吸附量基本相同,出现这种现象是因为AGS在50~100mg/L时对SY染料的去除率很高,平均去除率达到了90%以上,AGS的吸附容量较大,所以在较低浓度下温度对吸附量的影响较小;高浓度(150~250mg/L)时,AGS在35℃的qe均大于20℃和50℃,这种现象可以解释为:吸附过程可能是放热的,而且随着温度的升高染料分子和吸附剂官能团的物理结合力会降低.随着温度的升高,橘黄的溶解性增大,溶质跟溶剂之间的吸引力要大于溶质跟吸附剂之间的作用力,导致溶质更加难以吸附[23].
2.2吸附等温线
文中用Langmuir和Freundlich两种吸附等温式拟合实验数据寻找最合适的吸附等温线,等温线方程的适用性通过相关系数(r2)来评定.
2.2.1Langmuir吸附等温线
Langmuir等温式的线性形式如下:
(5)
式中:qm为最大吸附量,mg/g;b为Langmuir常数,L/mg.通过1/qe对1/ρe进行线性拟合,可得到Langmuir模型参数.表1列出了AGS在20~50℃时吸附SY染料的Langmuir参数qm、b和r2.在50~250mg/L范围内,实验数据在吸附过程中均符合Langmuir模型.在20~50℃时,SY染料最大吸附量qm分别为108.70、142.86和109.89mg/g,r2为0.9982~0.9994,其中35℃时qm最大,说明此时AGS吸附能力最强,Langmuir模型适合用来描述该实验中的数据.
2.2.2Freundlich吸附等温线
Freundlich等温式的线性形式如下:
(6)
式中:KF为代表吸附能力的Freundlich常数,(mg·g-1)·(L/mg)l/n.通过lnqe对lnρe进行线性拟合,可得到Freundlich模型中的常数.表1列出了AGS在20、35和50℃时吸附SY染料的Freundlich参数KF、n-1和r2.在50~250mg/L范围内,Freundlich模型拟合结果表明,虽然n-1均小于1,但r2较低,分别为0.9005、0.9426和0.9365.当n-1范围在0和1之间时,吸附容易进行[24].Freundlich模型的r2低于Langmuir模型,说明实验数据在整个浓度范围内使用Freundlich模型表述这些数据比Langmuir模型差.Freundlich模型表明,不同表面基团对各种吸附反应具有不同层次的活化能,吸附反应发生在不同的吸附位点上,例如胺基、羧基或者羟基等[25].
表1不同温度下AGS吸附SY的等温线常数
Table1Constantsofadsorptionisothermsofsunsetyellowonaerobicgranularsludgeatdifferenttemperatures
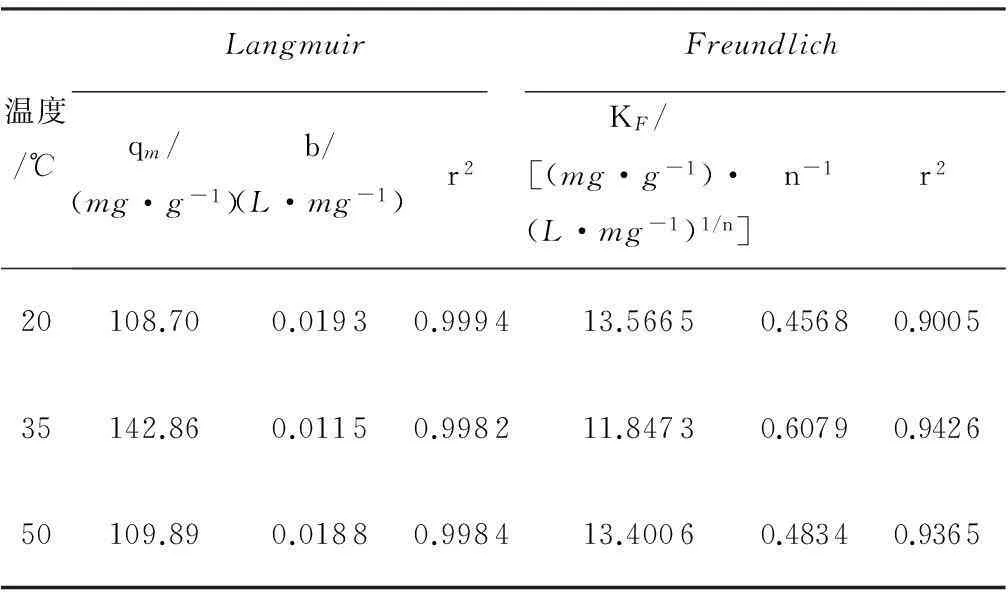
温度/℃LangmuirFreundlichqm/(mg·g-1)b/(L·mg-1)r2KF/[(mg·g-1)·(L·mg-1)1/n]n-1r220108.700.01930.999413.56650.45680.900535142.860.01150.998211.84730.60790.942650109.890.01880.998413.40060.48340.9365
2.3吸附动力学
为更好地从动力学观点来描述吸附现象,解释反应过程,确定控制原理,可建立多种动力学模型,主要应用的模型包括准一级动力学和准二级动力学模型,通过两种模型来研究AGS吸附SY染料的吸附机理.
2.3.1准一级动力学模型
准一级动力学模型由Lagergren提出,用于研究液相-固相体系的吸附过程[26].
准一级动力学模型线性形式如下:
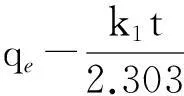
(7)
式中: qt为时间t时的吸附量,mg/g;k1为准一级动力学模型常数,min-1.如图3(a)所示,通过lg(qe-qt)对 t进行线性拟合,可得到准一级动力学模型中的常数.根据式(7)计算,可得到不同初始浓度下准一级动力学模型中的参数k1和r2,见表2.从表2可以看出,准一级动力学模型理论平衡吸附量(qe.cal)与实际平衡吸附量(qe.exp)差距较大且整个浓度范围内r2较低,说明该试验数据不适合描述准一级动力学模型.准一级动力学模型不能很好地描述整个吸附过程,它普遍应用于吸附的初始阶段[27].
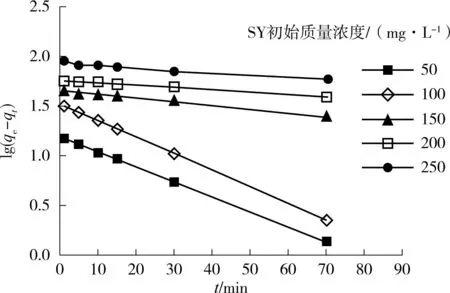
( a)准一级动力学模型
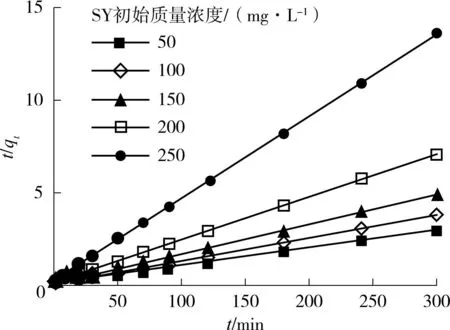
(b)准二级动力学模型 图3 AGS对SY在不同初始浓度下的吸附动力学模型 Fig.3 Kinetic models for adsorption of sunset yellow by aerobic granular sludge at different initial concentrations
2.3.2准二级动力学模型
准二级动力学模型由Ho和Mckay提出,可以更深入地分析动力学数据[28].准二级动力学模型线性形式如下:
(8)
式中:k2为准二级动力学模型常数,g/(mg·min).如图3(b)所示,通过t/qt对t进行线性拟合,可得到准二级动力学模型中的常数.根据式(8)计算,可得到不同初始浓度下准一级动力学模型中的参数k2和r2,见表2.从表2看出,准二级动力学模型理论平衡吸附量(qe.cal)与实验平衡吸附量(qe.exp)非常接近,其数值基本一致, r2在0.9957~0.9999之间,相关性非常高.通过比较qe.cal与qe.exp和r2可以看出准二级动力学模型比准一级动力学模型更适合该试验数据.表明AGS对SY染料的吸附是以化学吸附为速率控制步骤[28],即SY染料分子与AGS表面存在化学基团的作用,也进一步说明SY染料分子主要吸附于AGS表面.
表2AGS对SY在不同初始浓度下的吸附动力学模型参数
Table2Kineticmodelparametersforadsorptionofsunsetyellowbyaerobicgranularsludgeatdifferentinitialconcentrations
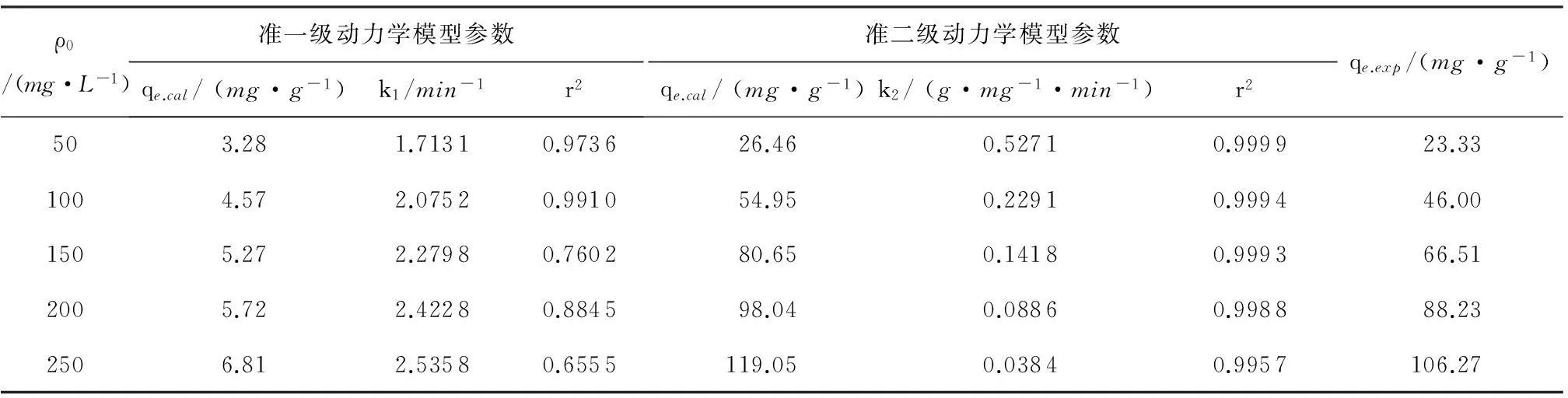
ρ0/(mg·L-1)准一级动力学模型参数qe.cal/(mg·g-1)k1/min-1r2准二级动力学模型参数qe.cal/(mg·g-1)k2/(g·mg-1·min-1)r2qe.exp/(mg·g-1)503.281.71310.973626.460.52710.999923.331004.572.07520.991054.950.22910.999446.001505.272.27980.760280.650.14180.999366.512005.722.42280.884598.040.08860.998888.232506.812.53580.6555119.050.03840.9957106.27
2.4吸附热力学
热力学参数是吸附过程实际应用中的重要指标,包括Gibbs自由能(ΔG0)、焓变(ΔH0)和熵变(ΔS0).
(9)
(10)
ΔG0=ΔH0-TΔS0
(11)
式中,R为气体常数,T为热力学温度,Kd为热力学平衡常数.根据式(9)-(10),绘制不同初始浓度下lnKd和1/T的线性关系图,通过直线的斜率和截距计算得到附热力学的参数ΔH0和ΔS0.根据式(11),通过ΔH0和ΔS0求出ΔG0.
由表3可以看出,ΔG0在整个温度范围内(293~323K)时均为负值,ΔH0均为负值,说明吸附是一个自发的放热过程.与前文所述随着温度的升高qe先增加后减少的现象是一致的.ΔS0为正值说明吸附过程中固液两相分界面混乱程度的升高,ΔS0为正值反映染料对AGS具有良好的亲和力[29].试验ΔS0在50~150mg/L时为正值,200~250mg/L时为负值,说明AGS对SY在低浓度时吸附亲合力较好.总的来说AGS吸附SY染料是一个自发的放热过程.
表3AGS吸附SY的热力学参数Table3ThermodynamicparametersofSYadsorptionbyaerobicgranularsludge
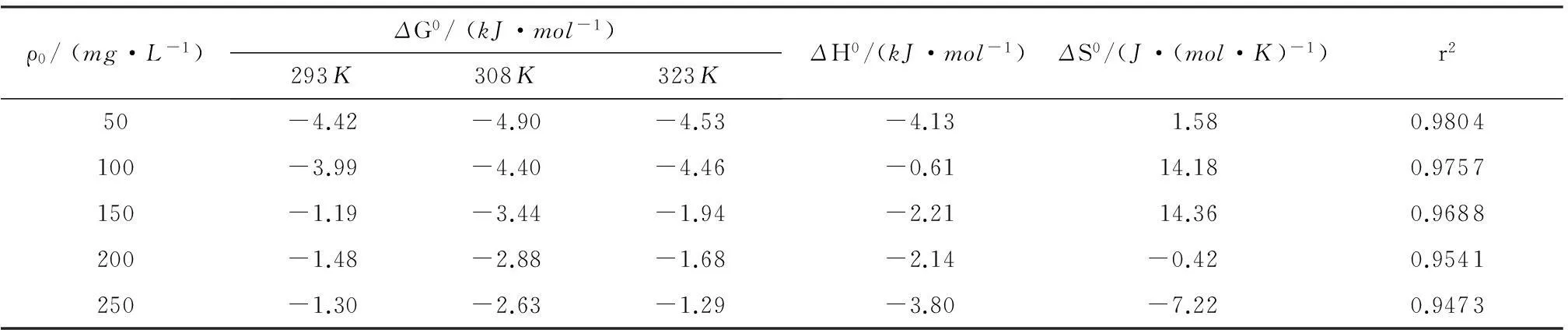
ρ0/(mg·L-1)ΔG0/(kJ·mol-1)293K308K323KΔH0/(kJ·mol-1)ΔS0/(J·(mol·K)-1)r250-4.42-4.90-4.53-4.131.580.9804100-3.99-4.40-4.46-0.6114.180.9757150-1.19-3.44-1.94-2.2114.360.9688200-1.48-2.88-1.68-2.14-0.420.9541250-1.30-2.63-1.29-3.80-7.220.9473
3结论
(1)溶液的pH值是影响AGS吸附剂对SY染料吸附效果的一个重要因素,阴离子型的SY染料在AGS用量为2g/L、温度为35℃和pH值为2时吸附量达到最大,qe随SY染料初始浓度的升高而升高,但随pH的升高而降低.
(2)通过比较r2可知,Langmuir模型比Freundlich模型更适合描述试验数据,qm为142.86mg/L.
(3)在整个试验过程中,AGS对SY染料的吸附过程符合准二级动力学模型,准二级动力学模型可以很好地表述AGS对于SY染料的吸附行为.
(4)吸附过程中ΔG0均小于0,说明吸附过程能够自发进行,ΔH0均小于0,说明吸附过程是放热的;浓度由低变高时,ΔS0由正值变为负值说明SY染料在浓度较低时对AGS具有良好的亲和力.
参考文献:
[1]GhaediaM,HekmatiJahA,KhodadoustS,etal.Cadmiumtelluridenanoparticlesloadedonactivatedcarbonasadsorbentforremovalofsunsetyellow[J].SpectrochimicaActaPartA:MolecularandBiomolecularSpectroscopy,2012,90:22-27.
[2]PathakH,PatelS,RathodM,etal.InvitrostudiesondegradationofsyntheticdyemixturebyComamonassp.VS-MH2andevaluationofitsefficacyusingsimulatedmicrocosm[J].BioresourceTechnology,2011,102(22):10391-10400.H,PatelS,RathodM,etal.InvitrostudiesondegradationofsyntheticdyemixturebyComamonassp.VS-MH2andevaluationofitsefficacyusingsimulatedmicrocosm[J].BioresourceTechnology,2011,102(22):10391-10400.
[3]ChungKT,StevensSE.Degradationazodyesbyenvironmentalmicroorganismsandhelminthes[J].EnvironmentalToxicologyandChemistry,1993,12(11):2121-2132.
[4]vanderZeeFP,VillaverdeS.Combinedanaerobic-aerobictreatmentofazodyes-ashortreviewofbioreactorstudies[J].WaterResearch,2005,39(8):1425-1440.
[5]ZhaoX,HardinR.HPLCandspectrophotometricanalysisofbiodegradationofazodyesbyPleurotusostreatus[J].DyesandPigments,2007,73(3):322-325.
[6]GaoHJ,KanTT,ZhaoSY,etal.Removalofanionicazodyesfromaqueoussolutionbyfunctionalionicliquidcross-linkedpolymer[J].JournalofHazardousMaterials,2013,261:83-90.
[7]RafatullahaM,SulaimanaO,HashimaR,etal.Adsorptionofmethyleneblueonlow-costadsorbents:areview[J].JournalofHazardousMaterials,2010,177(1):70-80.
[8]DottoGL,PintoLAA.Adsorptionoffooddyesacidblue9andfoodyellow3ontochitosan:stirringrateeffectinkineticsandmechanism[J].JournalofHazardousMaterials,2011,187(1):164-170.
[9]DemirbasA.Agriculturalbasedactivatedcarbonsfortheremovalofdyesfromaqueoussolutions:areview[J].JournalofHazardousMaterials,2009,167(1):1-9.
[10]HassaniA,AlidokhtL,KhataeeAR,etal.Optimizationofcomparativeremovaloftwostructurallydifferentbasicdyesusingcoalasalow-costandavailableadsorbent[J].JournaloftheTaiwanInstituteofChemicalEngineers,2014,45(4):1597-1607.
[11]AdavSS,LeeDJ,ShowKY,etal.Aerobicgranularsludge:recentAdvances[J].BiotechnologyAdvances,2008,26(5):411-423.
[12]GaoJF,ZhangQ,SuK,etal.Biosorptionofacidyellow17fromaqueoussolutionbynon-livingaerobicgranularsludge[J].JournalofHazardousMaterials,2010,174(1):215-225.
[13]SunXF,WangSG,LiuXW,etal.BiosorptionofMalachiteGreenfromaqueoussolutionsontoaerobicgranules:kineticandequilibriumstudies[J].BioresourceTechnology,2008,99(9):3475-3483.
[14]XuH,LiuY.MechanismsofCd2+,Cu2+andNi2+biosorptionbyaerobicgranules[J].Separationandpurificationtechnology,2008,58(3):400-411.
[15]WongYC,SzetoYS,CheungWH,etal.Equilibriumstudiesforaciddyeadsorptionontochitosan[J].Langmuir,2003,19(19):7888-7894.
[16]AksuZ,TezerS.BiosorptionofreactivedyesonthegreenalgaChlorellavulgaris[J].ProcessBiochemistry,2005,40(3):1347-1361.
[17]CriniG,BadotPM.Applicationofchitosan,anaturalaminopolysaccharide,fordyeremovalfromaqueoussolutionsbyadsorptionprocessesusingbatchstudies[J].ProgressInPolymerScience,2008,33(4):399-447.
[18]崔龙哲,吴桂萍,邓克俭.质子化剩余污泥吸附染料的性能及机理[J].化工学报,2007,58(5):1290-1295.
CuiLong-zhe,WuGui-ping,DengKe-jian.Adsorptionperformanceandmechanismofbindingofdyebyprotonatedcokewaste[J].JournalofChemicalIndustryandEngineering,2007,58(5):1290-1295.
[19]VilarVIP,BotelhoCMS,BoaventuraRAR.EquilibriumandkineticmodelingofCd(II)biosorptionbyalgaeGelidiumandagarextractionalgalwaste[J].WaterResearch,2006,40(2):291-302.
[20]ZhengYM,ZhaoQB,YuHQ.Adsorptionofacationicdyeontoaerobicgranules[J].ProcessBiochemistry,2005,40(4):3777-3782.
[21]GargVK,KumarR,GuptaR.Removalofmalachitegreendyefromaqueoussolutionbyadsorptionusingagro-industrywaste:acasestudyofProsopiscineraria[J].DyesandPigments,2004,62(1):1-10.
[22]NjokuVO,FooKY,AsifM,etal.Preparationofactivatedcarbonsfromrambutan(Nepheliumlappaceum)peelbymicrowave-inducedKOHactivationforacidyellow17dyeadsorption[J].ChemicalEngineeringJournal,2014,250(15):198-204.
[23]WongYC,SzetoYS,ChengWH,etal.Equilibriumstudiesforaciddyeadsorptionontochitosan[J].Langmuir,2003,19(19):7888-7894.
[24]FytianosK,VoudriasE,KokkalisE.Sorption-desorptionbehaviorof2,4dichlorophenolbymarinesediments[J].Chemosphere,2000,40(1):3-6.
[25]SarIA,TuzenM.KineticandequilibriumstudiesofbiosorptionofPb(II)andCd(II)fromaqueoussolutionbymacrofungus(Amanita rubescens)biomass[J].JournalofHazardousMaterials,2009,164(2):1004-1011.
[26]LagergrenS.Zurtheoriedersogenanntenadsorptiongelosterstoffe.KungligaSvenskaVetenskapsakademiens[J].Handlingar,1898,24:1-39.
[27]VimonsesV,LeiSM,JinB,etal.KineticstudyandequilibriumisothermanalysisofCongoRedadsorptionbyclaymaterials[J].ChemicalEngineeringJournal,2009,148(2):354-364.
[28]HoYS,MckayG.Pseudo-secondordermodelforsorptionprocesses[J].ProcessBiochemistry,1999,34(5):451-465.
[29]ChuHC,ChenKM.Reuseofactivatedsludgebiomass(I):removalofbasicdyesfromwastewaterbybiomass[J].ProcessBiochemistry,2002,37(6):595-600.
AdsorptionPropertyofAerobicGranularSludgeforSunsetYellow
inAqueousSolutions
Zhang Yan-zhuoLi JunLi YunChen Guang-huiBian Wei
(CollegeofArchitectureandCivilEngineering∥KeyLaboratoryofBeijingforWaterQualityScienceandWater
EnvironmentRecoveryEngineering,BeijingUniversityofTechnology,Beijing100124,China)
Abstract:The ability of aerobic granular sludge (AGS) to adsorb sunset yellow (SY) in aqueous solutions is investigated, and the adsorption process affected by pH value, adsorbent dosage, initial SY concentration and temperature is explored. The results show that (1) pH value is an important influencing factor of adsorption efficiency; (2) the best adsorption is achieved at a pH value of 2, an AGS dosage of 2 g/L and a temperature of 35℃; (3) the equilibrium adsorption capacity is positively correlated with the initial SY concentration; and (4) the equilibrium adsorption data accord the Langmuir model and the pseudo-second-order kinetic model well, with a saturated SY adsorption capacity of 142.86 mg/L. Thermodynamic analysis indicates that the adsorption process is spontaneous and endothermic for dye, and that low SY concentration benefits the adsorption affinity. Thus, it comes to the conclusion that AGS can be used as a low-cost adsorbent for the removal of SY dye from wastewater.

Foundationitems:SupportedbytheNationalScienceandTechnologyMajorProject(2012ZX07403-001),theResearchandDevelopmentProjectofMinistryofHousingandUrban-RuralConstructionofChina(2009-K7-4)andtheNationalNaturalScienceFoundationofChina(51178321)
†通信作者: 高乃云(1949-),女,教授,博士生导师,主要从事饮用水处理技术研究.E-mail:gaonaiyun@sina.com

