姜黄素通过下调p-NF-κB表达减轻大鼠带状疱疹神经痛
皮治兵,申邦利,蔡振,徐旭仲,林海
(1.温州医科大学附属第一医院 麻醉科,浙江 温州 325015;2.温州医科大学附属第二医院 疼痛科,浙江 温州 325027)
·基 础 研 究·
姜黄素通过下调p-NF-κB表达减轻大鼠带状疱疹神经痛
皮治兵1,申邦利2,蔡振1,徐旭仲1,林海1
(1.温州医科大学附属第一医院 麻醉科,浙江 温州 325015;2.温州医科大学附属第二医院 疼痛科,浙江 温州 325027)
目的:观察姜黄素对大鼠带状疱疹神经痛动物模型行为学及脊髓背角和背根神经节(DRG)的磷酸化核因子-κB(p-NF-κB)的影响,探讨姜黄素用于带状疱疹神经痛治疗的疗效及其机制。方法:选取雄性SD大鼠80只,随机分为4组(各20只):C组、D组、Dcur1组、Dcur2组。C组:后爪注射0.9%氯化钠溶液;D组:将单纯疱疹病毒-1(HSV-1)接种于大鼠后爪,5 d后行0.9%氯化钠溶液腹腔注射治疗。Dcur1组、Dcur2组:HSV-1接种大鼠5 d后行腹腔内姜黄素注射治疗,剂量分别为100 mg/kg、200 mg/kg。于造模前、造模后5 d(治疗前)、治疗结束后1、7、14 d,测定机械缩足阈值(MWT)、热缩足潜伏期(TWL);于治疗结束后14 d检测脊髓和DRG中p-NF-κB表达。结果:大鼠感染HSV-1后MWT从43.8降低到15.0,TWL从10.2降低到6.7,脊髓背角p-NF-κB表达从1.3增加到26.1,DRG中p-NF-κB表达从0.7增加到12.1。2组大鼠注射姜黄素后的MWT和TWL均明显增加,而p-NF-κB的表达均明显降低(Dcur1组脊髓背角和DRG分别降低到5.7和4.8,Dcur2组脊髓背角和DRG分别降低到3.1和2.0)。结论:姜黄素早期注射能明显缓解带状疱疹神经痛,其机制与下调脊髓背角和DRG的p-NF-κB过表达有关。
带状疱疹神经痛;姜黄素;磷酸化核因子-κB;大鼠
带状疱疹神经痛是指带状疱疹皮疹治愈后,仍残留的持续性、长期的疼痛,是一种顽固性的神经病理性疼痛[1],发病率高(9%~13%带状疱疹患者可出现带状疱疹神经痛,60岁以上患者带状疱疹神经痛发病率可高达50%~75%[2]),持续时间长,严重影响患者的生活质量,目前治疗药物主要有加巴喷丁等,但疗效及安全性尚值得评估[3-4]。姜黄为姜科植物姜黄的干燥根茎,中医认为其有破血行气、通经止痛的功效,而姜黄素作为姜黄的主要活性成分之一,具有抗炎、抗氧化等多种药理作用。本研究拟探讨姜黄素对大鼠带状疱疹神经痛的影响及其可能机制。
1 材料和方法
1.1 材料 雄性SD大鼠80只,体质量200~230 g,由温州医科大学实验动物中心提供,实验动物生产许可证:SCXK(浙)2010-0054,实验动物使用许可证:SYXK(浙)2010-0058。将80只大鼠随机分为4组(n=20):C组:后爪注射0.9%氯化钠溶液;D组:后爪注射单纯疱疹病毒-1(HSV-1),5 d后腹腔注射0.9%氯化钠溶液;Dcur1、Dcur2组:后爪注射HSV-1,5 d后分别腹腔注射姜黄素(批号:2142805,Sigma公司,美国,溶媒二甲基亚砜,配置成含姜黄素40 mg/mL的溶液备用)100、200 mg/(kg·d),每天1次,连续7 d。各组动物环境温湿度相同,均定期给予饮水摄食。
1.2 模型复制 采用Takasaki等[5]报道的方法,从-80 ℃冰箱中取出冻存的HSV-1株(批号:2013145,拜奥维克斯有限公司,英国),在流动的自来水中迅速融化,取病毒悬液(浓度为106/100 μL,注射容积50 μL)接种于大鼠后爪。5 d后引起带状疱疹样皮疹(玫瑰型疹子或透亮水疱)和疼痛相关反应(触痛异常和机械性痛觉过敏)。造模后5 d的痛阈值降低到基础值85%以下者进入下一步实验,否则将此动物剔除(造模的60只大鼠中,D组剔除8例,1例未出疹,2例无疼痛相关反应,5例可能因疱疹伴发严重感染而死亡;Dcur1组剔除6例,其中3例未出疹,3例可能因疱疹伴发严重感染而死亡;Dcur2组剔除6例,因1例未出疹,2例疼痛阈值无明显变化,3例可能因疱疹伴发严重感染而死亡。造模成功率为66.7%。实验动物剔除后根据随机数字表补充相应数目的动物到各组继续实验。
1.3 观察指标 所有组别造模前1 d,造模后5 d,治疗后1、7、14 d测定机械缩足阈值(mechanical withdrawal threshold,MWT)和热缩足潜伏期(thermal withdrawal latency,TWL)。MWT的测定:用IITC-2390型Electronic Von Frey触觉测痛仪垂直刺激大鼠双后趾,单次刺激时间≤1 s,刺激间隔10 s。记录测试时大鼠出现抬足或舔足行为时的刺激强度值,测5次取平均值即为其MWT。TWL的测定:用IITC336甩尾足底测试仪于上述各时点测定TWL。将大鼠置于3 mm厚的玻璃板上,使用热辐射照射其后趾相应部位,记录从照射到缩爪回避的时间,每只大鼠双足各测5次,每次间隔5 min,取后3次的平均值即为其TWL。
各组于治疗后14 d时取7只大鼠,取L4~5节段脊髓背角和背根神经节(dosal root ganglion,DRG),石蜡包埋切片,片厚4 μm,晾干。采用SP法免疫组织化学染色测定磷酸化核因子-κB(p-NF-κB)表达情况。兔抗p-NF-κB抗体购自美国Cell Signal公司,使用Nikon E-800型荧光显微照相系统采集图像。每只动物脊髓和DRG切片每隔5张顺序取1张,计数脊髓背角I、 II层Lissauer区和DRG中间区p-NF-κB的阳性细胞数。
1.4 统计学处理方法 采用SPSS11.5统计软件进行分析。所有计量资料以表示,组间比较采用单因素方差分析,方差齐性者采用LSD法,方差不齐者采用Dunnett’s T3检验;组内差异采用随机区组设计的方差分析Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 MWT的变化 与基础值和C组相比,D组造模后5 d MWT明显降低,差异有统计学意义(P<0.05)。治疗前D组和Dcur1组、Dcur2组MWT差异无统计学意义(P>0.05)。与D组相比,Dcur1、Dcur2组治疗后1、7、14 d的MWT明显升高(P<0.05)。治疗后1、7、14 d Dcur2组的MWT显著高于Dcur1组(P<0.05)。详见表1。
2.2 TWL的变化 与基础值和C组相比,D组造模后5 d TWL明显降低(P<0.05)。与D组比,Dcur1组、Dcur2组在治疗前和治疗后1 d TWL差异无统计学意义(P>0.05),而治疗后7、14 d Dcur1组、Dcur2组的TWL均高于D组(P<0.05)。治疗后7、14 d Dcur2组的TWL高于Dcur1组(P<0.05),见表2。
2.3 p-NF-κB表达的变化 与C组比,D组大鼠脊髓背角和DRG中的p-NF-κB的表达均明显增加(P<0.05)。与D组比,Dcur1组和Dcur2组p-NF-κB的表达均显著减少(P<0.05)。Dcur2组p-NF-κB表达低于Dcur1组(P<0.05)。见表3和图1-4。
表1 姜黄素对MWT的影响(n=20,,Gr)
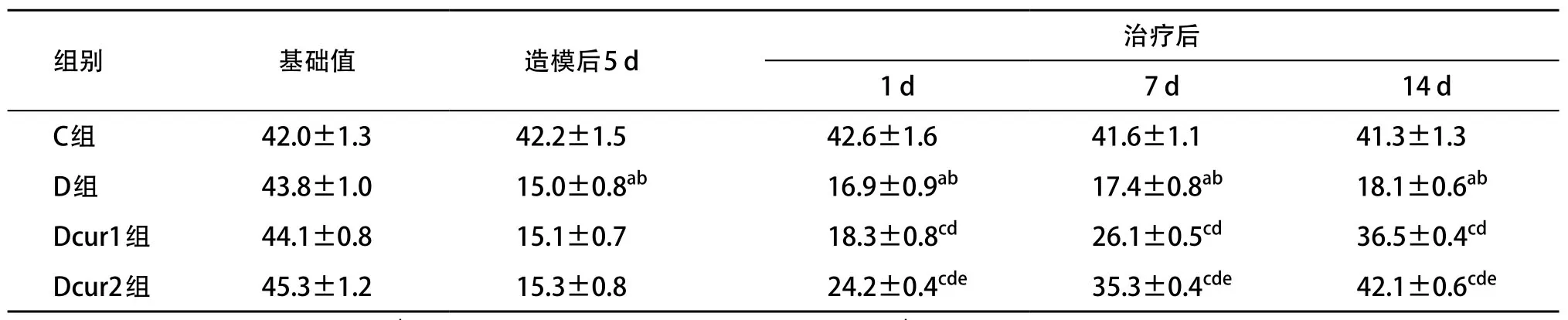
表1 姜黄素对MWT的影响(n=20,,Gr)
与D组基础值比:aP<0.05;与C组比:bP<0.05;与造模后5 d比:cP<0.05;与D组比:dP<0.05;与Dcur1组比:eP<0.05
组别基础值造模后5 d治疗后1 d7 d14 d C组42.0±1.342.2±1.5ba42.6±1.6aba41.6±1.1aba41.3±1.3abaD组43.8±1.015.0±0.8ab16.9±0.9aba17.4±0.8aba18.1±0.6abaDcur1组44.1±0.815.1±0.7ba18.3±0.8cda26.1±0.5cda36.5±0.4cdaDcur2组45.3±1.215.3±0.8ba24.2±0.4cde35.3±0.4cde42.1±0.6cde
表2 姜黄素对TWL的影响(n=20,,s)

表2 姜黄素对TWL的影响(n=20,,s)
与D组基础值比:aP<0.05;与C组比:bP<0.05;与造模后5 d比:cP<0.05;与D组比:dP<0.05;与Dcur1组比:eP<0.05
组别基础值造模后5 d治疗后1 d7 d14 d C组11.5±1.112.6±0.8ab11.1±1.2ab12.1±1.4eee11.4±1.3eeeD组10.2±1.2 6.7±1.5ab6.2±0.8ab6.2±1.5abe6.8±0.8abeDcur1组11.1±1.1 6.6±0.9ab6.1±0.8ab7.0±0.8cde8.1±0.5cdeDcur2组11.6±2.1 6.7±0.6ab6.3±0.8ab8.0±0.7cde9.4±0.7cde
表3 姜黄素对p-NF-κB表达的影响(n=7,)

表3 姜黄素对p-NF-κB表达的影响(n=7,)
与C组比:aP<0.05;与D组比:bP<0.05;与Dcur1组比:cP<0.05
组别 脊髓背角 DRG C组 1.3±0.2 0.7±0.2 D组26.1±1.1a12.1±1.0aDcur1组 5.7±1.2b4.8±0.7bDcur2组 3.1±0.7bc2.0±0.3bc
3 讨论
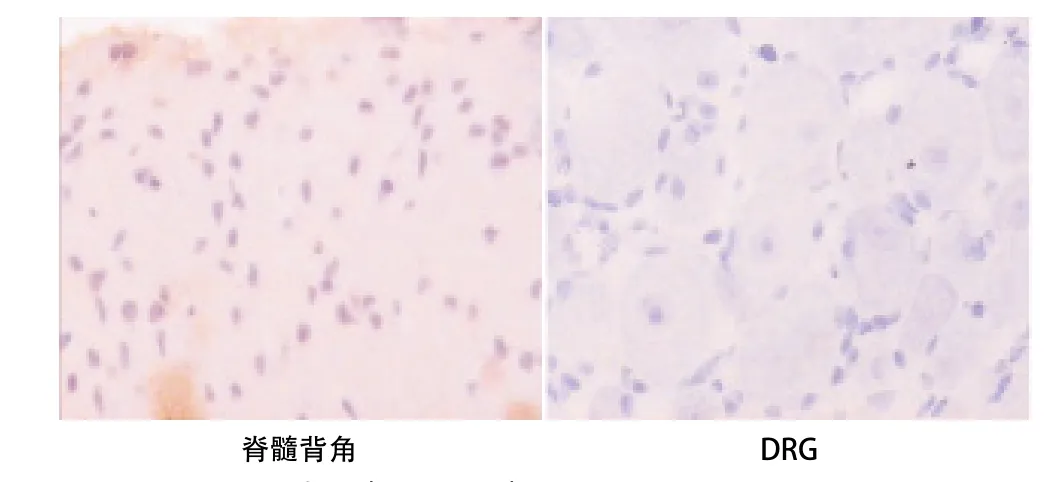
图1 C组p-NF-κB表达(SP,×200)
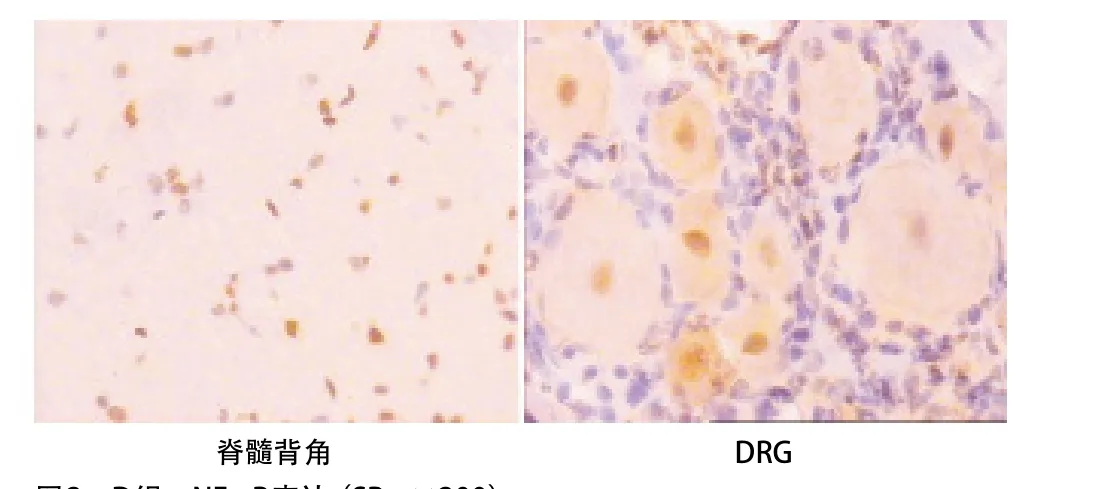
图2 D组p-NF-κB表达(SP,×200)
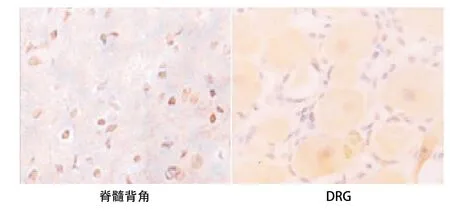
图3 Dcur1组p-NF-κB表达(SP,×200)
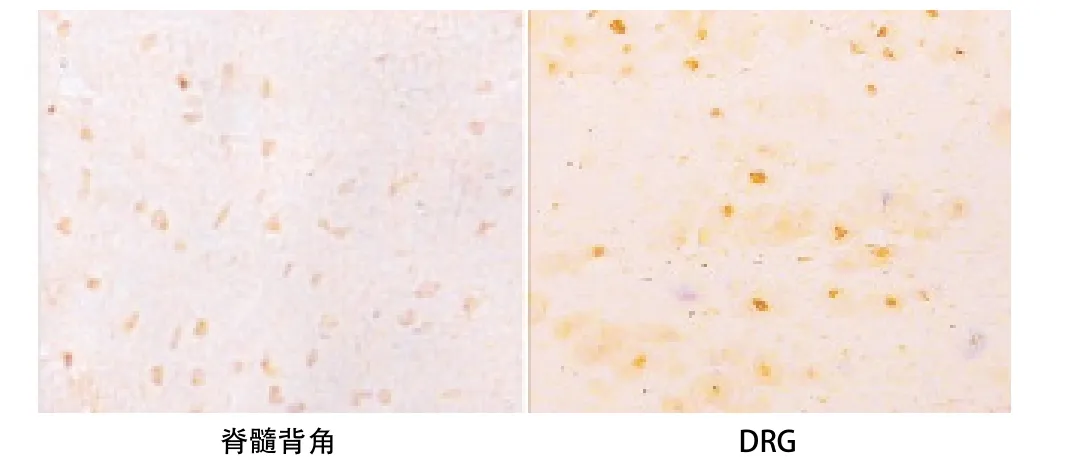
图4 Dcur2组p-NF-κB表达(SP,×200)
带状疱疹神经痛是带状疱疹感染皮区的持续性疼痛,急性期是由于水痘-带状疱疹病毒感染了感觉神经节和其分布的皮区,引起神经分布皮区的感染性疼痛,慢性期可有较明显的痛觉过敏及异常性疼痛,这可能与中枢的神经元细胞钠离子电流密度增加有关[6]。亦有研究者认为包括带状疱疹神经痛在内的神经病理性疼痛的特征是中枢神经系统的损害区域神经元兴奋性过高,这过高的兴奋性是由于外周伤害性感受器、DRG、脊髓后角和脑等多个水平的分子变化所造成的[2]。本研究也得出了类似的结果,感染了带状疱疹的大鼠其脊髓背角和DRG神经元p-NF-κB产生了过度表达。NF-κB是广泛存在于各种细胞胞浆中的一种转录因子,被活化时可激活并诱导其下游因子环氧化酶2(COX2)的表达,从而使脊髓背角和DRG神经元中重要的致痛物质—前列腺素E2(PGE2)的水平升高。这部分解释了感染了带状疱疹的大鼠为什么表现为痛觉过敏(MWT和TWL均降低)。
姜黄素是一种传统的中医药,药理作用广泛,具有抗炎、抗氧化、抗纤维化、抗癌、活血镇痛作用。有研究证明姜黄素能通过下调TNF-α和NF-κB表达而产生抗糖尿病性神经痛作用[7-9],或通过抑制TRPV1通道而产生抗神经病理性疼痛作用[10]。亦有研究证明姜黄素能增加大鼠海马的神经发生和神经可塑性及神经修复[11]。带状疱疹后遗神经痛可能与外周、脊髓及中枢等部位神经细胞炎性反应和神经细胞凋亡有关,亦与疱疹病毒神经破坏有关[12],这提示姜黄素对带状疱疹后遗神经痛可能有效。本实验中给予带状疱疹大鼠(据Takasaki等[5]报道,小鼠接种HSV-1 5 d后进入带状疱疹急性期,出现疼痛和疱疹。15 d后皮肤病损完全愈合,大约有一半的小鼠相当长的一段时间内存在疼痛相关反应,即慢性期—带状疱疹后遗神经痛)不同剂量的姜黄素2周,机械和热痛敏均显著减轻,且200 mg姜黄素作用较100 mg姜黄素治疗作用强,这与我们早前的研究[13]结果一致。而且带状疱疹神经痛大鼠脊髓背角和DRG中过度表达的p-NF-κB被姜黄素显著抑制,此抑制作用与其减轻机械和热痛敏作用平行,这提示姜黄素减轻带状疱疹神经痛作用可能与下调脊髓背角和背根神经元中p-NF-κB的过表达有关。
综上所述,姜黄素对实验大鼠带状疱疹神经痛具有良好的镇痛作用,其机制可能与姜黄素抑制脊髓p-NF-κB过表达有关。姜黄素药理作用广泛,是否存在其他机制尚待进一步研究。
[1] Hempenstall K, Nurmikko TJ, Johnson RW, et al. Analgesic therapy in postherpetic neuralgia: a quantitative systematic review[J]. PLoS Med, 2005, 2(7): e164.
[2] Odom RB, Berger TG, James WD. Andrews’diseases of skin[M]. 9th. Beijing:Science Press, 2001: 473-476.
[3] Pickering G. Antiepiletics for postherpetic neuralgia in the elderly; current and future prospects[J]. Drugs Aging, 2014, 31(9): 653-660.
[4] Fan H, Yu W, Zhang Q, et al. Efficacy and safety of gabapentin 1800 mg treatment for post-herpetic neuralgia: a meta-analysis of randomized controlled trials[J]. J Clin Pharm Ther, 2014, 39(4): 334-342.
[5] Takasaki I, Sasaki A, Andoh T, et al. Effects of analgestics on delayed postherpetic pain in mice[J]. Anesthesiology, 2002, 96(5): 1168-1174.
[6] Kennedy PG, Montague P, Scott F, et al. Varicella-zoster viruses associated with post-Herpetic neuralgia induce sodium current density increases in the ND7-23 Nav-1.8 neuroblastoma cell line[J]. PLoS One, 2013, 8(1): e51570.
[7] Li Y, Zhang Y, Liu DB, et al. Curcumin attenuates diabetic neuropathic pain by downregulating TNF-α in a rat model [J]. Int J Med Sci, 2013, 10(4): 377-381.
[8] Nishida M, Nishiumi S, Mizushina Y, et al. Monoacetylcurcumin strongly regulates inflammatory responses through inhibition of NF-kappaB activation[J]. Int J Mol Med, 2010, 25(5): 761-767.
[9] Huang G, Yang Y, Xu Z, et al. Down regulation of B lymphocyte stimulator expression by curcumin in B lymphocyte via suppressing nuclear translocation of NF-kappaB[J]. Eur J Pharmacol, 2011, 650(1): 451-457.
[10] Lee JY, Shin TJ, Choi JM, et al. Antinociceptive curcuminoid, KMS4034, effects on inflammatory and neuropathic pain likely via modulating TRPV1 in mice[J]. Br J Anaesth, 2013, 111(4): 667-672.
[11] 杨丽娟, 董军, 陆大祥, 等. 姜黄素对LPS激活小胶质细胞条件培养基诱导损伤的海马神经元保护作用及机制[J].中国病理生理杂志, 2010, 26(4): 742-747.
[12] Gilron I, Watson CP, Cahill CM, et a1. Neuropathic pain: a practical guide for the clinician[J]. CMAJ, 2006, 175(3): 265-275.
[13] 申帮利, 余相地, 曹红, 等. 姜黄素对大鼠糖尿病神经病理性痛的效应[J]. 中华麻醉学杂志, 2009, 29(7): 626-629.
(本文编辑:丁敏娇)
Curcumine attenuates herpetic neuralgia by down-regulated expression of p-NF-κB in a rat model
PI Zhibing1, SHEN Bangli2, CAI Zhen1, XU Xuzhong1, LIN Hai1. 1.Department of Anesthesiology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Pain, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective: To evaluate the effect of curcumin on herpetic neuralgia in rats and its mechanisms. Methods: Sixty rats with therpetic neuralgia induced by claw injection of HSV-1 and 20 healthy control (C group) rats whose claw were injected by normal saline were included. Twenty rats which had been injected HSV-1 were injected in intraperitoneal 100 mg/kg curcumin 5 days later (Dcur1 group), and 20 rats were injected 200 mg/kg curcumin (Dcur2 group), and the rest 20 rats were injected normal saline (D group ). We tested mechanical allodynia with electronic von frey and tested thermal hyperalgesia with radiant heat before HSV-1 injection, 5 days later after HSV-1 injection, on 1, 7, 14 days after curcumin or NS injection. p-NF-κB in lumbar spinal cord (L4~5) and DRG was estimated by immunohistochemistry at 14 d after NS or curcumine was given. Results: Compared to C group, Shingles rats exhibited significant pain hypersensitivity, as evidenced by decreased paw withdrawal threshold to electronic von Frey and decreased paw withdrawal latency to heat. After herpes infection, rat’s mechanical paw withdrawal threshold reduced from 43.8 to 15.0, and thermal withdrawal latencies reduced from 10.2 to 6.7. Phosphorylation of nuclear factor (p-NF)-κB expression in the spinal cord dorsal horn increased from 1.3 to 26.1, while phosphorylation of nuclear factor (p-NF)-κB expression in the dorsal root ganglion increased from 0.7 to 12.1. However, curcumine significantly attenuated the Shingles-induced allodynia and hyperalgesia and reduced the expression of p-NF-κB (Dcur1 spinal cord dorsal horn/dorsal root ganglion reduced to 5.7/4.8, Dcur2 spinal cord dorsal horn/dorsal root ganglion reduced to 3.1/2.0). Conclusion: Curcumine seems attenuate pain threshold in herpetic neuralgia rats, possibly through an inhibitory action on p-NF-κB expression in spinal dorsal horn and dorsal root ganglion.
herpetic neuralgia; curcumine; p-NF-κB; rats
R373.1
B
10.3969/j.issn.2095-9400.2015.07.010
2014-12-29
浙江省医药卫生平台骨干人才计划项目(2011RCB026)。
皮治兵(1977-),男,湖北通城人,主治医师,硕士。
林海,副教授,硕士生导师,Email:422133061@qq.com。

