三维斑点追踪成像评价小儿膜周部室间隔缺损左心室局部收缩功能
王珍,田新桥,付定虎,刘敏,詹坤高,吴道珠
(温州医科大学附属第二医院 超声科,浙江 温州 325027)
·论 著·
三维斑点追踪成像评价小儿膜周部室间隔缺损左心室局部收缩功能
王珍,田新桥,付定虎,刘敏,詹坤高,吴道珠
(温州医科大学附属第二医院 超声科,浙江 温州 325027)
目的:应用三维斑点追踪成像(3D-STI)技术定量评价小儿膜周部室间隔缺损(PmVSD)左心室局部收缩功能变化。方法:PmVSD小儿40例(PmVSD组),年龄、性别相匹配的对照组35例。采集左心室三维全容积图像,运用3D-STI技术测量2组对象收缩期左心室16节段的圆周、纵向、径向峰值应变,比较2组间各参数的差异性,并进一步分析其与左室射血分数、左室容量负荷参数的相关性。结果:PmVSD组左室各节段三个方向峰值应变测值大多数均较正常组增大,其中前、侧壁基底段和侧、后壁中间段的纵向峰值应变及侧壁、下间隔壁中间段的圆周峰值应变和侧壁、下间隔壁中间段及基底段的径向峰值应变差异有统计学意义(P<0.05);纵向、圆周、径向峰值应变均分别与左心室舒张末容积呈正相关。结论:3D-STI技术可敏感地检出PmVSD小儿左心室局部收缩功能的异常改变,具有一定的临床应用价值。
超声心动描记术;三维斑点追踪;室间隔缺损;心室功能,左
室间隔缺损(ventricular septal defect,VSD)是最常见的先天性心脏病之一,发生率为活产婴儿的1.35‰~6.5‰,占所有先天性心脏病的20%~33%[1],其中膜周部室间隔缺损(perimembranous ventricular septal defect,PmVSD)又是VSD中最常见类型。因主要存在心室水平的左向右分流,致肺循环血流量增加,导致左室前负荷过重和左室增大等改变,并影响左室功能。左心室功能的准确评价对多数心脏病患者的治疗指导和预后评估具有重要意义[2-4]。但目前主要通过常规超声测量VSD的心室内径和左室射血分数(left ventricular ejection fraction,LVEF)来随访、评估心功能变化,其敏感性较差,仅能检出病情较严重状态下左室整体功能的异常变化,同时易受心室负荷状态的影响,无法对心脏局部心肌运动特征进行全面分析。三维斑点追踪成像(three-dimensional speckle tracking imaging,3D-STI)技术是在实时三维超声心动图及二维斑点追踪成像基础上发展起来的新技术,能够从三维空间分析左心室心肌应变,无角度依赖性,可全面评价左心室整体及局部收缩功能,较传统超声心动图及二维斑点追踪技术更有优势。然而,迄今大多数学者的研究对象为成年人或青年患者,对于小儿VSD左室收缩功能早期改变的研究较少。本研究旨在应用3D-STI评估小儿PmVSD对左心室局部收缩功能的影响,并分析其相关参数与左室容量负荷参数、LVEF的相关性。
1 对象和方法
1.1 研究对象 PmVSD组:2014年2月至4月经温州医科大学附属第二医院超声科诊断为PmVSD的小儿40例,男22例,女18例,年龄30 d~7岁,平均(2.09±2.03)岁,基础心律为窦性心律。排除标准:①经询问患儿家属病史,行超声心动图、X线胸片、心电图及体格检查,排除患有及合并如房间隔缺损、动脉导管未闭、法洛四联症、肌部及双动脉下等其他类型室间隔、主动脉缩窄等心脏病;②图像质量差,不能进行3D-STI心内膜追踪者。
对照组:选取同期正常对照组35例,男20例,女15例,年龄4个月~8岁,平均(2.35±1.69)岁,均经X线胸片、心电图及超声心动图等检查除外心肺疾病。
1.2 仪器和方法 采用Philips iE33彩色多普勒超声显像诊断仪,配备二维超声探头S5-1(频率1~5 MHz,帧频50~70帧/s)和实时三维超声探头X5-1(频率1~3 MHz,帧频20~50帧/s)。图像采集:受检者取左侧卧位,同步连接心电图。先用探头S5-1行常规二维超声检查,于常规二维切面测量左心室舒张末期前后径(left ventricular end-diastolic diameter,LVEDD)及左心室收缩末期前后径(left ventricular end-systolic diameter,LVESD)(取三个心动周期所测的平均值),双平面Simpson法计
算LVEF;换用矩阵X5-1探头,将探头置于心尖部,显示心尖四腔心切面后,适当调节扇角与深度,同时调节帧频,使其>30帧/s,启用谐波及最佳优化模式,直至显示最佳的心尖四腔图,患者平静呼吸时,启动“Full volume”模式,连续采集4个心动周期,储存图像并进行脱机分析。将图像导入TomTec分析软件,运用“4DLV analysis”模式,系统自动转换成心尖两腔、三腔、四腔心切面及左室短轴观[包括心尖水平(apical A)、乳头肌水平(median M)、瓣环水平(basal B)],于心尖三个切面确定心尖与二尖瓣中点位置,系统自动描记心内膜轨迹,描记贴合不佳时手动微调,使追踪线与心内膜密切重叠,系统自动测量得出左室舒张末容积(left ventricularend-diastolic volume,LVEDV)、左室收缩末容积(left ventricular end-systolic volume,LVESV),并自动追踪分析得出R-R间期,左室16节段心肌峰值纵向应变(longitudinal strain)、圆周应变(circumferential strain)、径向应变(radial strain)。
1.3 统计学处理方法 采用SPSS19.0统计软件。所有数据以表示,两组间比较采用独立样本t检验,两参数间的相关性用Pearson相关分析。均采用双尾检验。P<0.05为差异有统计学意义。
1.4 重复性检验 随机选择10例正常对照组和10例PmVSD患儿,由2名熟练掌握上述三维斑点追踪分析软件的医师独自脱机分别分析左室三维圆周峰值应变平均值,两者间差异反映观察者间误差,然后由其中1名医师于2周后重复测量上述指标,2次测量结果的差异反映观察者内误差。观察者间及观察者内的一致性界限采用Bland-Altman分析。
2 结果
2.1 3D-STI分析结果 在40例PmVSD组患儿中,2例因为左心室明显增大,三维成像角度限制未能行斑点追踪分析,2例因三维图像质量欠佳未能追踪而排除。对照组中2例研究对象因为三维图像质量欠佳未能行斑点追踪分析而排除,3D-STI技术成功分析36例PmVSD患儿及33例对照组的三维图像。对照组与PmVSD患儿圆周应变-时间曲线见图1。
2.2 二维常规超声测量值比较 PmVSD组患儿与对照组比较,LVEDD、LVESD、LVEDV、LVESV、LVEF均有所增加,但差异均无统计学意义(P>0.05)(见表1)。
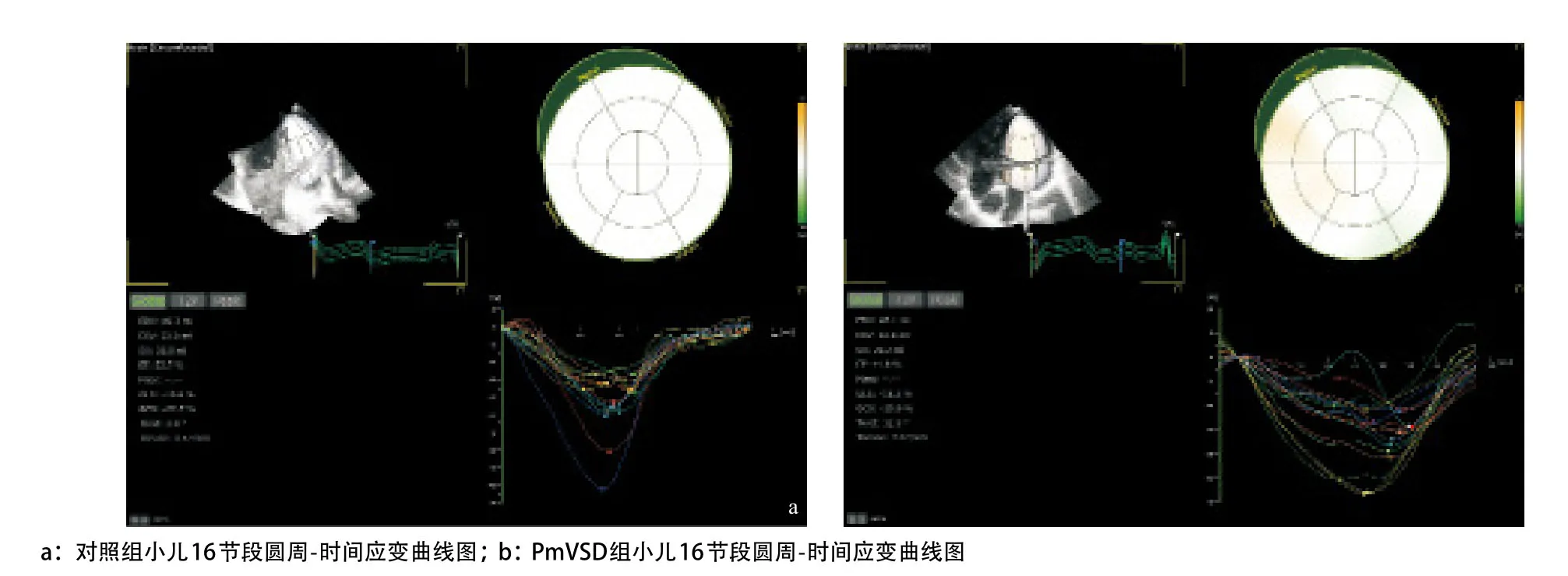
图1 对照组和PmVSD组小儿各节段圆周应变图
表1 PmVSD组与对照组常规超声相关测值比较()
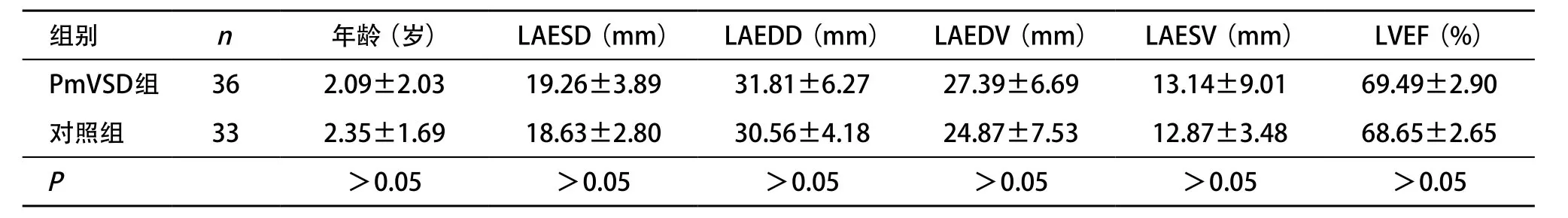
表1 PmVSD组与对照组常规超声相关测值比较()
2.3 PmVSD组与对照组3D-STI测值比较 PmVSD组与对照组16节段圆周应变、纵向应变、径向应变峰值结果见表2-4,其中VSD组前、侧壁基底段和侧、后壁中间段的纵向峰值应变及侧壁、下间隔壁中间段的圆周峰值应变和侧壁、下间隔壁中间段及基底段的径向峰值应变与对照组比较差异有统计学意义(P<0.05)。
2.4 PmVSD组左室16节段纵向、径向、圆周峰值应变及三个方向峰值应变平均值与LVEF、左心容量负荷参数的关系 Pearson相关分析表明,PmVSD组部分节段峰值应变值,如前、侧壁基底段纵向峰值应变及侧、下间隔壁中间段的圆周峰值应变和侧壁、下间隔壁基底段的径向峰值应变均与LVEF呈线性相关;纵向、径向、圆周峰值应变平均值分别与LVEDV呈正相关(纵r=0.68,P<0.001;径r=0.57,P<0.01;圆r=0.56,P<0.01)。
2.5 重复性检验结果 观察者内圆周峰值应变平均值平均差值为-0.341,95%置信区间为-2.13~1.45,观察者内变异度为(1.53±7.35)%(P>0.05);观察者间圆周峰值应变平均值平均差值为-0.333,95%置信区间为-3.62~2.25,观察者间变异度为(1.62±8.51)%(P>0.05)(见图2)。
表2 PmVSD组与对照组左心室16节段心肌纵向峰值应变的比较()

表2 PmVSD组与对照组左心室16节段心肌纵向峰值应变的比较()
与对照组同部位比:aP<0.05,bP<0.01
表3 PmVSD组与对照组左心室16节段心肌圆周峰值应变的比较()
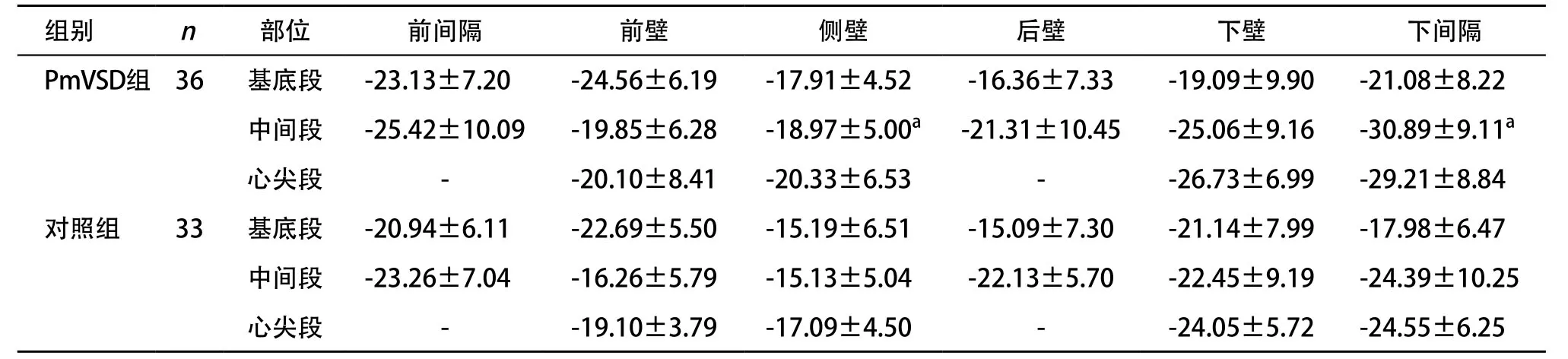
表3 PmVSD组与对照组左心室16节段心肌圆周峰值应变的比较()
与对照组同部位比:aP<0.05
表4 PmVSD组与对照组左心室16节段心肌径向峰值应变的比较()
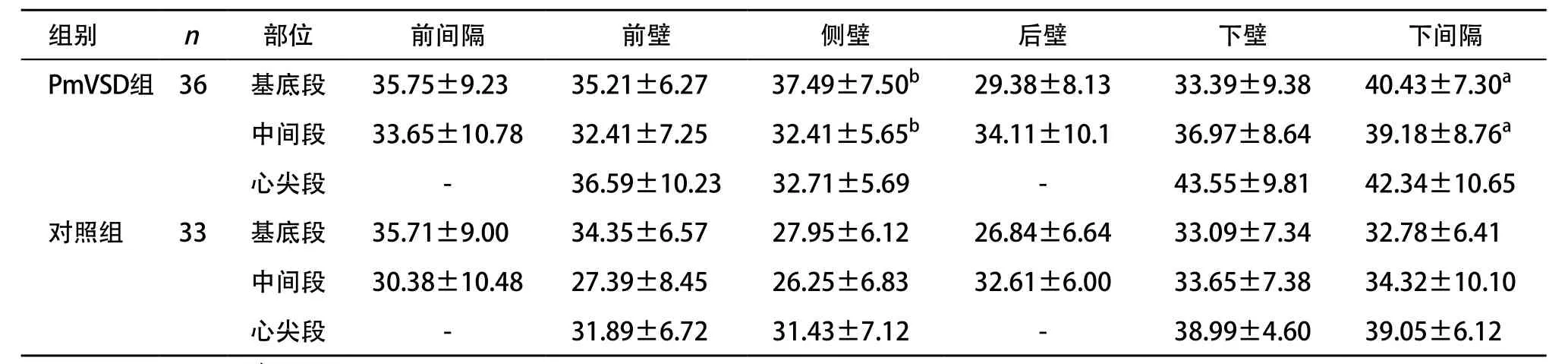
表4 PmVSD组与对照组左心室16节段心肌径向峰值应变的比较()
与对照组比:aP<0.05,bP<0.01
组别n部位前间隔前壁侧壁后壁下壁下间隔PmVSD组36基底段35.75±9.23035.21±6.27037.49±7.50b29.38±8.1333.39±9.3840.43±7.30a0中间段33.65±10.7832.41±7.25032.41±5.65b34.11±10.136.97±8.6439.18±8.76a0心尖段-36.59±10.2332.71±5.69a-43.55±9.8142.34±10.65a对照组33基底段35.71±9.00034.35±6.57027.95±6.12a26.84±6.6433.09±7.3432.78±6.410a中间段30.38±10.4827.39±8.45026.25±6.83a32.61±6.0033.65±7.3834.32±10.10a心尖段-31.89±6.72031.43±7.12a-38.99±4.6039.05±6.120a
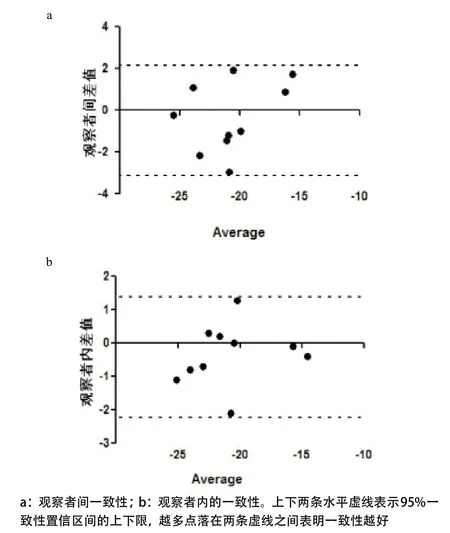
图2 PmVSD组与对照组圆周峰值应变平均值的一致性Bland-Altman分析图
3 讨论
心肌的形变发生在短轴和长轴方向上,短轴方向形变用径向(向心方向)及环向(圆周方向)应变表示,长轴方向形变用纵向应变表示[5]。因此通过三个方向应变的综合分析可以较全面地评价亚临床状态下的左室局部收缩功能[6]。超声二维斑点追踪技术(two dimensional speckle tracking imaging,2D-STI)逐帧追踪心动周期中组织的声学斑点,无角度依赖性,已有大量研究用于临床评价心肌缺血、室壁运动不同步及心脏旋转扭转运动,亦有较多学者运用该技术评价先天性心脏病的心功能变化[3,6-7]。但2D-STI依赖于二维灰阶图像,只能评估二维运动,不能准确地反映心脏复杂的三维运动。3D-STI融合了2D-STI及三维实时成像的优势,不受心肌运动方向的限制,无角度依赖性,可在三维空间内实时同步追踪心肌的运动轨迹。Saito等[8]对3D-STI和2D-STI测量正常人16节段三个方向应变结果进行比较,结果表明3D-STI所需测量时间较2D-STI更短,观察者间及观察者内的差异性更小。亦有学者如Nesser等[9]应用3D-STI和心血管磁共振成像(cardiac magnetic resonance imaging,CMR)的对比研究表明,3D-STI技术与被临床作为“金标准”的CMR所测数据一致性较高,同时3D-STI与声纳微测法也有良好的相关性[10]。因此3D-STI可更加全面评价小儿心脏收缩功能的改变,为选择手术时机及随访提供更好的参考指标。
本研究中发现,PmVSD组二维超声数据中LVEDD、LVESD、LVEDV、LVESV、LVEF均增大,但差异无统计学意义(P>0.05),考虑可能为选取的小儿病情较轻,尚未造成明显左室重塑和心功能变化。本研究PmVSD组患儿大部分节段应变值均增大,其中前、侧壁基底段和侧、后壁中间段的纵向峰值应变及侧壁、下间隔壁中间段的圆周峰值应变和侧壁、下间隔壁中间段及基底段的径向峰值应变较对照组差异有统计学意义(P<0.05),表明PmVSD患儿左室壁收缩运动较对照组代偿性增强。分析其原因,PmVSD患儿持续存在左向右分流,导致左室前负荷增加,左室舒张末容积增加,根据Frank-Starling 机制,左室壁张力增高,心肌收缩能力相应增强。与王庆慧等[4]及Zhuang等[11]的研究结果一致。但因本研究选取的研究对象年龄较小、病情轻,仅部分室壁节段收缩运动明显增大。同时Mizuguchi等[6]研究表明,在心肌三个方向形变中纵向应变在心脏疾病中最早受影响,可能与心内膜下主要为纵向心肌纤维有关,同时当左室代偿性收缩增强时圆周应变也相应增强以利于左室泵血功能,本研究结果与其一致。Seo等[10]研究发现心尖段应变与声纳微测法的相关性低于中间段和基底段,纵向应变、圆周应变较径向应变可更好地评估局部心肌应变,同时心尖段应变改变没有其他节段敏感。本研究发现与对照组比较,PmVSD组圆周、纵向应变中间段及基底段部分节段心肌应变值增大,与Seo等[10]的研究结果相似。本研究还发现PmVSD组部分节段峰值应变值与LVEF呈线性相关,左室纵向、径向、圆周峰值应变平均值均分别与LVEDV呈良好正相关,以纵向峰值应变平均值相关性最强,与Mizuguchi等[6]的研究结果一致。
综上所述,本研究结果表明PmVSD小儿左心室局部收缩运动增强,3D-STI可无创、敏感地检出这种变化,为临床VSD治疗和术后疗效评估提供客观依据,具有一定的临床应用价值。
[1] Moons P, Sluysmans T, De Wolf D, et al. Congenital heart disease in 111 225 births in Belgium: birth prevalence, treatment and survival in the 21st century[J]. Acta Paediatrica, 2009, 98(3): 472-477.
[2] 张华, 胡元平, 倪显达, 等. 应变和应变率成像评价肥厚型心肌病左室局部心肌收缩和舒张功能的研究[J]. 温州医学院学报, 2008, 38(6): 530-532.
[3] Laser KT, Haas NA, Fischer M, et al. Left ventricular rotation and right-left ventricular interaction in congenital heart disease: the acute effects of interventional closure of patent arterial ducts and atrial septal defects[J]. Cardiol Young, 2014, 24(4): 661-674.
[4] 王庆慧, 丁云川, 尹帆, 等. 三维斑点追踪技术评价先天性心脏病左心室收缩功能[J]. 中国超声医学杂志, 2013, 29 (3): 228-230.
[5] Torrent-Guasp F, Buckberg GD, Clemente C, et al. The structure and function of the helical heart and its buttress wrapping. I. The normal macroscopic structure of the heart [J]. Semin Thorac and Cardiovasc Surg, 2001, 13(4): 301-319.
[6] Mizuguchi Y, Oishi Y, Miyoshi H, et al. The functional role of longitudinal, circumferential, and radial myocardial deformation for regulating the early impairment of left ventricular contraction and relaxation in patients with cardiovascular risk factors: a study with two-dimensional strain imaging [J]. J Am Soc Echocardiogr, 2008, 21(10): 1138-1144.
[7] Rodriguez FH 3rd, Moodie DS, Parekh DR, et al. Outcomes of hospitalization in adults in the United States with atrial septal defect, ventricular septal defect, and atrioventricular septal defect[J]. Am J cardiol, 2011, 108(2): 290-293.
[8] Saito K, Okura H, Watanabe N, et al. Comprehensive evaluationof left vertricular strain using speckle tracking echocardiography in normal adults:comparison of three-dimensional and two-dimensional approaches[J]. J Am Soc Echocardiogr, 2009, 22(9): 1025-1030.
[9] Nesser HJ, Mor-Avi V, Gorissen W, et al. Quantification of left ventricular volumes using three dimensional echocardiographic speckle tracking: comparison with MRI[J]. Eur Heart J, 2009, 30(13): 1565-1573.
[10] Seo Y, Enomoto Y, Ishizu T, et a1. Validation of three-dimensionsl speckle tracking imaging to quantify regional myocardial deformation[J]. Circ Cardiovasc Imaging, 2009, 2(6): 451-459.
[11] Zhuang Y, Yong YH, Yao J, et al. Left ventricular rotation and torsion in patients with perimembranous ventricular septal defect[J]. Echocardiography, 2014, 31(3): 362-369.
(本文编辑:吴健敏)
Evaluation of regional left ventricular systolic function in pediatric patients with perimembranous ven-tricular septal defect using three-dimensional speckle tracking imaging
WANG Zhen, TIAN Xinqiao, FU Dinghu, LIU Min, ZHAN Kungao, WU Daozhu. Department of Ultrasonography, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective: To evaluate regional left ventricular (LV) systolic function in pediatric with perimembranous ventricular septal defect (PmVSD) using three-dimensional speckle tracking imaging (3D-STI). Methods: Transthoracic full-volume 3D images were obtained in 40 patients with PmVSD and 35 age-and sexmatched controls. The full-volume 3D datasets were recorded, 3D-STI analysis provided measures of peak circumferential, radial, and longitudinal strain in 16 LV segments (6 basal, 6 mid, and 4 apical), left ventricular end systolic and end diastolic volumes (LVESV and LVEDV) were automatic measured. The strain values were compared between the two groups. Correlation analysis between LVEDV, LVESV, LVEF and LV systolic strain values were made respectively. Results: Compared with the control group, multidirectional strains for almostly all segments strain values were higher in patients with PmVSD, especially the peak systolic longitudinal strain in LV anterior, lateral wall basal segments, lateral, posterior wall middle segments and the peak systolic circumferential strain in LV lateral, inferior-septum wall middle segments and peak systolic radial strain in LV inferiorseptum, lateral wall middle segments and basal segments were significantly higher than that of the control group (P<0.05). Among strain parameters, averege peak longitudinal strain exhibited the highest correlation with LVEDV. There were no significant differences between two groups in LVEF. Conclusion: 3D-STI is able to confirm regional LV dysfunction in pediatric patients with PmVSD.
echocardiography; three-dimensional speckle tracking; ventricular septal defect; ventricular function, left
R445.1
A
10.3969/j.issn.2095-9400.2015.07.009
2015-01-04
王珍(1989-),女,江西抚州人,硕士生。
田新桥,主任医师,硕士生导师,Email:tianxq2005@ 163.com。现工作单位:河南省人民医院超声科。

