沉默黏着斑激酶表达抑制大肠癌转移的体内研究
洪卫文,苏国强,应红安,林峰,梁卫东
(1.台州市第一人民医院 普外科,浙江 台州 318020;2.厦门大学附属第一医院 普外科,福建 厦门361000;3.台州市第一人民医院 特需VIP科,浙江 台州 318020)
·论 著·
沉默黏着斑激酶表达抑制大肠癌转移的体内研究
洪卫文1,苏国强2,应红安3,林峰1,梁卫东1
(1.台州市第一人民医院 普外科,浙江 台州 318020;2.厦门大学附属第一医院 普外科,福建 厦门361000;3.台州市第一人民医院 特需VIP科,浙江 台州 318020)
目的:通过裸鼠实验研究,证实沉默黏着斑激酶(FAK)的表达能有效抑制大肠癌的转移。方法:将24只裸鼠随机分成3组:实验组、阴性对照组、未处理组,分别注射FAK稳定沉默的结肠癌细胞、阴性对照组的结肠癌细胞、未特殊处理的结肠癌细胞,每组各8只裸鼠。在SPF条件动物实验室饲养6周后处死裸鼠,观察原位成瘤率、病死率、瘤体生长、肝肺转移情况,通过HE染色、免疫组织化学染色研究FAK微转移灶、蛋白表达情况。结果:各组成瘤率均为100%。与阴性对照组及未处理组相比,实验组转移率、病死率和FAK蛋白表达明显降低(P<0.05),且转移灶恶变程度更低、形态更好,而阴性对照组与未处理组差异无统计学意义(P>0.05)。结论:通过shRNA介导的FAK基因沉默对SW620原位移植后的裸鼠肝肺转移有明显抑制,FAK有望成为治疗大肠癌转移的新靶点。
黏着斑激酶;SW620;大肠肿瘤;裸鼠;转移
大肠癌是常见的恶性肿瘤,包括结肠癌和直肠癌,是西方国家的第二大恶性肿瘤,中国第三大恶性肿瘤,发病率逐年升高。每年约有50%的肠癌患者发生肿瘤转移。即使少数患者能早期发现,并予积极的手术治疗和化疗,其中仍有19%发生转移,5年生存率只有63%,而很多患者一经确诊已为晚期,5年生存率都不到10%[1-5]。大肠癌患者的主要死因在于肿瘤转移,近年来,各种靶向药物如贝伐单抗、西妥昔单抗和帕尼单抗等通过抑制肿瘤细胞的信号转导、黏附、迁移等途径抑制肿瘤转移,取得较好疗效[4]。而黏着斑激酶(focal adhesion kinase,FAK)介导的信号转导系统是最重要的肿瘤细胞信号转导途径之一。
本课题组前期体外实验研究已成功构建稳定FAK沉默的细胞株,并通过RT-PCR及Western blot技术证实FAK沉默能有效抑制人源结肠癌株SW620的增殖及侵袭[5]。为探讨其体内抑癌作用,本研究建立裸鼠盲肠原位移植癌模型,进一步研究shRNA(short hairpin RNA,短发夹RNA)沉默FAK基因表达对大肠癌侵袭转移的体内作用,该模型能很好地模拟人大肠癌的生物学行为,是研究大肠癌转移、治疗的理想动物模型。
1 材料和方法
1.1 实验动物 SPF级6周龄、体质量18~20 g雌性裸鼠24只购于上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2007-0005。
1.2 主要仪器和试剂 倒置显微镜(日本Olympus公司),质粒小抽试剂盒(美国Qiangen公司),新生小牛血清、DMEM、Polybrene、G418、NEAA、RMPI 1640(美国Gibco公司),氨苄青霉素、TEMED(美国Sigma公司),TurboFect(美国Fermentas公司),PVDF膜、鼠抗人FAK、Matrigel(美国Millipore公司),Tris(美国Boehringer Mannheim公司),羊抗鼠二抗(武汉博士德生物公司),FAK抗体一抗(上海吉凯公司),二抗(厦门鹭隆生物科技发展有限公司),免疫组织化学试剂盒(福州迈新生物科技有限公司)。
1.3 实验方法
1.3.1 稳定FAK沉默结肠癌细胞株SW620的建立:本课题组前期体外实验研究将已构建好插入FAK shRNA的慢病毒载体pLL3.7及插入无意义片段的阴性对照慢病毒载体pLL3.7,分别感染SW620结肠癌细胞,使用荧光倒置显微镜检测证实感染率>90%,成功构建稳定FAK沉默的细胞株,并通过RT-PCR及Western blot技术检测证实了实验组FAK mRNA及蛋白质的表达较阴性对照组显著下降,差异有统计学意义,FAK沉默能抑制人源结肠癌株SW620的增殖及侵袭[6]。
1.3.2 实验分组:将24只雌性裸鼠随机分成3组,即实验组、阴性对照组、未处理组,每组8只,在厦门大学抗癌研究中心动物实验室SPF条件下饲养,1周后接种,调整细胞密度至1×108,实验组于盲肠接种携带shRNA的FAK基因沉默的SW620细胞株;阴性对照组于盲肠接种携带阴性对照慢病毒载体的SW620细胞株;未处理组于盲肠注射未处理的SW620细胞株。
1.3.3 裸鼠接种、饲养观察及取材:取左下腹1 cm切口,逐层分离挑出小鼠盲肠,实验组、阴性对照组、未处理组各组接种相应的SW620细胞悬液0.1 mL至浆膜层,接种过程中实验组裸鼠死亡1只。接种后继续于SPF条件下动物实验室饲养,每天观察裸鼠的活动能力、进食情况、体质量、腹部触诊情况等。饲养6周后处死裸鼠,各实验组取盲肠、肺脏、肝脏行免疫组织化学、HE染色,以下实验均在厦门大学抗癌研究中心动物实验室完成。
1.3.4 HE染色、免疫组织化学染色:组织标本取材后常规固定、包埋、洗涤、脱水、透明、浸蜡与包埋、7 μm切片、贴片,将载玻片放入60 ℃恒温箱中烘烤2 h后,进行常规HE染色,免疫组织化学步骤参照迈新SP试剂盒说明书进行。免疫组织化学结果判定:利用Image Pro Plus 6.0图像分析系统软件测定每张照片中阳性区域的累积光密度(integrated optical density,IOD),取每张切片的5个视野所得IOD的平均值进行检测指标的半定量分析,IOD能反映选定区域的蛋白表达总量。
1.4 统计学处理方法 本研究采用随机对照设计。应用SPSS 13.0统计软件进行统计学分析。数据用表示,样本均数间比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 裸鼠死亡及原位成瘤率 注射结肠癌细胞6周后,实验组未出现死亡,体质量及状态均好于其他两组,阴性对照组死亡2只,未处理组死亡2只,均有消瘦、进食差。死亡裸鼠的原因考虑与感染、肿瘤生长等有关。各组成瘤率均为100%,大体标本表明各组盲肠均可见成瘤,大小数量不一,色稍白,呈圆形隆起(如图1箭头所示)。实验组较其他两组肿瘤体积更小,数量更少,盲肠形态更好,病理证实为接种的SW620癌细胞(见图1)。
2.2 各组盲肠、肝脏、肺脏转移及HE染色、免疫组织化学染色结果
2.2.1 各组盲肠、肝肺转移情况:实验组7只裸鼠1只肝转移,转移肿瘤结节小,且数量少,阴性对照组8只裸鼠死亡2只,存活的6只中4只发现肝转移,转移灶弥漫,未处理组8只裸鼠死亡2只,余6只裸鼠均发现肝多发转移。死亡裸鼠极度消瘦,呈恶液质,并有腹水,解剖肝脏糜烂,表面呈粗糙颗粒状,病理证实为肿瘤转移,肺部呈实变。肝脏转移率分别为:实验组14.29%,阴性对照组75.00%,未处理组100.00%,与阴性对照组及未处理组相比,实验组转移率明显降低,差异有统计学意义(P<0.05),阴性对照组与未处理组相比差异无统计学意义(P>0.05)。各组均未发生肺转移,肉眼均未见明显肿瘤结节,颜色较光泽,外观无明显差异(见图2)。
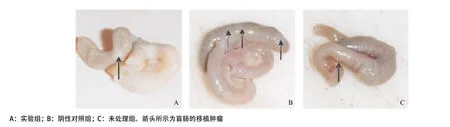
图1 各组盲肠原位肿瘤

图2 各组裸鼠肝脏
2.2.2 HE染色结果:各组盲肠HE染色显示满视野结肠癌细胞,细胞及组织极性紊乱,分化差,可见SW620细胞悬液注射到盲肠浆膜层后可成功成瘤。实验组肿瘤与正常肠管组织界限分明,而阴性对照组及未处理组中形成的肿瘤包块浸润周围组织,界限不清。各组肝脏HE染色结果显示实验组肿瘤较局限,界限较分明,周围肝脏组织完好,而阴性对照组及未处理组中形成的肿瘤包块浸润周围组织,界限不清。各组肺脏HE染色显示实验组肺脏形态较好,而阴性对照组和未处理组肺脏含大量红细胞(见图3)。

图3 各组肿瘤HE染色图片(×400)
2.2.3 免疫组织化学染色结果:FAK蛋白表达为棕色颗粒,箭头所示为转移灶,结果显示盲肠实验组、阴性对照组及未处理组IOD(×106)值分别为2.67± 0.60、4.89±0.55、5.12±0.36,实验组肝组织坏死明显少于阴性对照组和未处理组,肝脏实验组、阴性对照组及未处理组IOD(×106)值分别为1.96±0.39,2.73±0.16,2.80±0.21。盲肠及肝脏的实验组与阴性对照组及未处理组相比差异均有统计学意义(P<0.05),阴性对照组与未处理组相比差别均无统计学意义(P>0.05)。免疫组织化学染色结果显示实验组FAK蛋白表达明显降低,可见实验组肿瘤细胞在裸鼠体内生长时仍可稳定沉默FAK表达(见图4-5)。
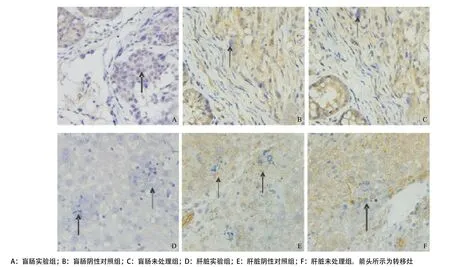
图4 各组肿瘤免疫组织化学染色图片(×400)
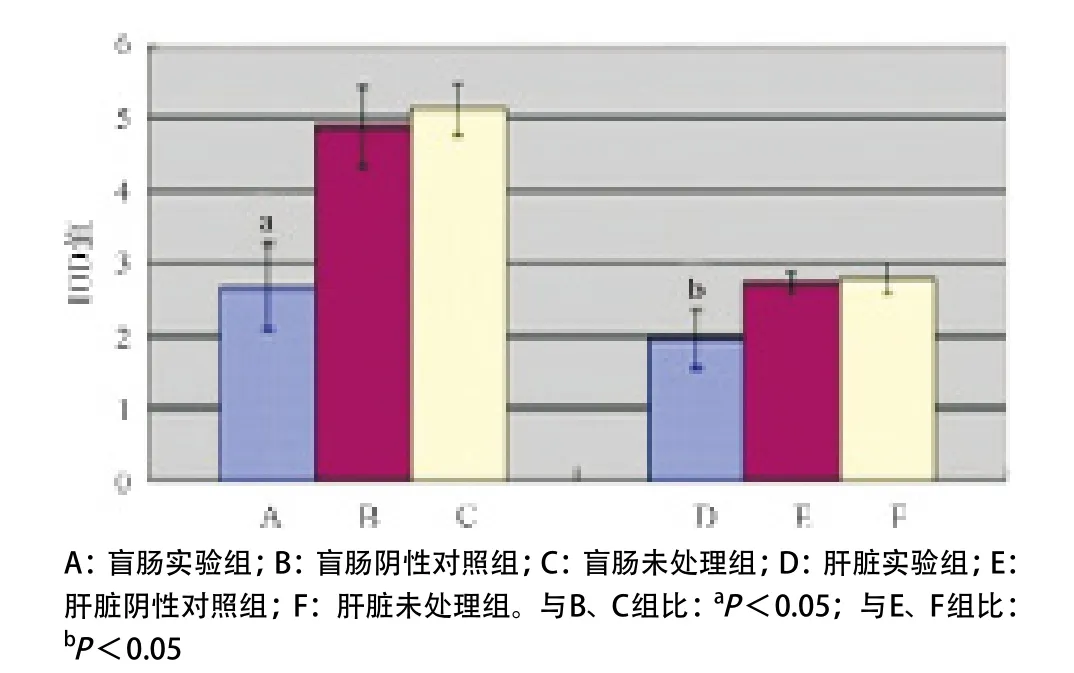
图5 各组FAK蛋白质表达条图
3 讨论
目前国内外大量研究表明FAK在很多恶性肿瘤如肠癌、肺癌、前列腺癌、子宫附件恶性肿瘤中都过度表达[6-8];FAK参与肿瘤细胞的增殖、抑制细胞的凋亡以及促进肿瘤细胞的黏附、迁移等。诸多研究已证实在大肠癌组织中,FAK在原发癌及肝转移癌中均较正常大肠黏膜表达增高;肠腺瘤伴不典型增生组织中较正常大肠黏膜表达率高[9]。FAK可能的调节通路包括增强Ras基因的活化,影响MAPK的级联激活,ERK活化后转位到细胞核内后使部分转录调控因子磷酸化,最终使细胞生长增强;同时,FAK下调CAS凋亡蛋白酶的表达,降低JNK、MMPs基因活性,使癌细胞凋亡减少,逐渐获得侵袭能力[10]。文献报道细胞实验证实抑制FAK的表达可有效地降低肿瘤细胞的黏附和侵袭[11-13],可见,如人为降低FAK蛋白的表达水平,可能有望控制肿瘤的转移及扩散。
本研究建立在前期实验的基础上,利用RNAi技术,通过稳定转染SW620结肠癌细胞,达到抑制结肠癌细胞FAK蛋白的表达,为大肠癌体内转移实验奠定基础。本研究采用原位移植肿瘤方法,真实模拟SW620结肠癌细胞在体内发生转移的生物学特征,研究FAK基因的沉默对SW620结肠癌细胞的转移的影响。实验挑取干扰效果好,生长旺盛的FAK抑制的单克隆细胞株,扩增培养,作为体内实验的实验组细胞,与阴性对照组和未处理组细胞分别异种移植到裸鼠。本研究建立原位盲肠移植动物模型,为大肠癌靶向基因治疗提供一新的方法,在肿瘤转移环节上给予干预或设法阻断,将大大提高临床疗效。临床研究表明,晚期大肠癌患者中20%~30%发生肝脏转移[14],10%~15%发生腹膜转移,10%~25%发生肺脏转移[15],而结直肠以外的部位者较少发生转移。本课题研究SW620结肠癌细胞的转移实验中,6周后处死裸鼠,取盲肠、肝脏、肺脏染色发现实验组裸鼠肝脏转移明显少于阴性对照组和未处理组,阴性对照组和未处理组差异无统计学意义,肝转移实验结果与体外实验相一致;各组均未见肺部转移情况。可能原因考虑为回盲部静脉回流至肠系膜上静脉后直接进入肝脏,容易早期发生肝脏的转移,也可能在实际回盲部种植结肠癌细胞时已破坏局部毛细血管,部分肿瘤细胞直接进入肠系膜上静脉,使得很早期即能发现肝脏转移灶,而发生肺部转移时肿瘤细胞必须从生长部位脱落后进入动脉血管,并在肺部定植后才能生长,可能需要较长的时间,在实际裸鼠饲养过程中,6周后裸鼠的病死率明显上升,长时间饲养裸鼠很难实现,此外肿瘤细胞本身对靶器官的亲和力可能也决定了容易发生肝脏转移;在肝转移的情况中,可知沉默FAK后的SW620结肠癌细胞转移实验组明显低于阴性对照组和未处理组,且转移脏器的形态、病理更好,进一步提示FAK在肿瘤转移中起着重要作用。
综上所述,本研究利用构建好的pLentilox3.7 FAK慢病毒载体在293FT细胞中包装成慢病毒,通过感染结肠癌细胞SW620建立稳定FAK沉默的细胞株,将细胞悬液异体移植到裸鼠体内,并测量肿瘤生长及裸鼠肝转移情况,在体内证实下调SW620结肠癌细胞FAK的表达,阻断了以FAK为主的信号传导通路,能有效抑制SW620的侵袭能力,为以后临床靶向治疗大肠癌提供了一种新的思路和方法。
[1] Ferlay J, Autier P, Boniol M, et al. Estimates of the cancer incidence and mortality in Europe in 2006[J]. Ann Oncol, 2007, 18(6): 581-592.
[2] Jemal A, Siegel R, Ward E, et al. Cancer statistics[J]. CA Cancer J Clin, 2009, 59(4): 225-249.
[3] Saletti P, Cavalli F. Metastatic colorectal cancer[J]. Cancer Treat Rev, 2006, 32(7): 557-571.
[4] Tol Jolien, Punt CJ. Monoclonal antibodies in the treatment of metastatic colorectal cancer: A review[J]. Clinical Therapeutics, 2010, 32(3): 437-453.
[5] 洪卫文, 苏国强, 应红安, 等. 稳定沉默黏着斑激酶结肠癌细胞株SW620的建立[J]. 温州医科大学学报, 2014, 44 (3): 201-204.
[6] 倪孔海, 翁志梁, 王思齐, 等. 粘着斑激酶在人良性前列腺增生组织中的表达及其意义[J]. 温州医学院学报, 2004, 34(4): 262-264.
[7] Seo CH, Jeong H, Feng Y, et al. Micropit surfaces designed for accelerating osteogenic differentiation of murine mesenchymal stem cells via enhancing focal adhesion and actin polymerization[J]. Biomaterials, 2013, 12(35): 2245-2252.
[8] 孙晓杰, 黄常志. PI3K-Akt信号通路与肿瘤[J]. 世界华人消化杂志, 2006, 14(3): 306-311.
[9] Yu HG, Tong SL, Ding YM, et al. Enhanced expression of cholecystokinin-2 receptor promotes the progression of colon cancer through activation of focal adhesion kinase[J]. Int J Cancer, 2006, 119(12): 2724-2732.
[10] Stoeck A, Gast D, Sanderson MP, et al. L1-CAM in a membrane-bound or soluble form augments protection from apoptosis in ovarian carcinoma cells[J]. Gynecol Oncol, 2007, 104(2): 461-469.
[11] Serrels A, Canel M, Brunton VG, et al. Src/FAK-mediated regulation of E-cadherin as a mechanism for controlling collective cell movement: insights from in vivo imaging[J]. Cell Adh Migr, 2011, 5: 360-365.
[12] 袁周, 郑起, 黄新余, 等. 抑制黏着斑激酶表达对人肝癌细胞转移潜能的作用[J]. 中华外科杂志, 2007, 45(19): 1350-1353.
[13] Figel S, Gelman I. Focal adhesion kinase controls prostate cancer progression via intrinsic kinase and scaffolding functions[J]. Anticancer Agents Med Chem, 2011, 11(7): 607-616.
[14] Simmonds PC, Primrose JN, Colquitt JL, et al. Surgical resection of hepatic metastases from colorectal cancer: a systematic review of published studies[J]. Br J Surg, 2006, 94 (7): 982-999.
[15] Iwasaki A, Shirakusa T, Yamashita Y, et al. Characteristic differences between patients who have undergone surgical treatment for lung metastasis or hepatic metastasis from colorectal cancer[J]. Thorac Cardiov Surg, 2005, 53(6): 358-364.
(本文编辑:吴健敏)
The effect of silenced focal adhesion kinase on colorectal cancer metastasis in vivo
HONG Weiwen1, SUGuoqiang2, YING Hongan3, LIN Feng1, LIANG Weidong1. 1.Department of General Surgery, the First People’s Hospital of Taizhou, Taizhou, 318020; 2.Department of General Surgery, the First Affiliated Hospital of Xiamen University, Xiamen, 361000; 3.Special Service Ward, the First People’s Hospital of Taizhou, Taizhou, 318020
Objective: Focal adhesion kinase gene silencing by Short Hairpin RNA can effectively inhibit colorectal cancer’s metastasis were confirmed through injection of FAK-knockdown colorectal cancer cells into nude mice. Methods: Twenty-four nude mice were randomly divided into three groups which were experimental group which inject FAK-knockdown colon cancer cells, negative control group whick inject negative control colon cancer cells and untreated group which inject untreated colon cancer cells. Nude mice were sacrificed after 6 weeks and tumor formation rate, mortality, tumor growth, liver and lung’s metastasis, miscrometastasis were observed and FAK protein expression were determined with HE staining and immunohistochemical staining. Results: Tumor formation rate was 100% in each group. Distant metastases, mortality and FAK protein expression of experimental group was significantly lower than that of the other two groups (P<0.05), meanwhile, the malignant lesion extent was lighter. While negative control group and untreated group were not significantly different (P>0.05). Conclusion: Lentiviral packaging shRNA-mediated FAK gene silencing can significantly inhibit liver and lung metastasis of colorectal cancer. FAK is expected to be a new target for treatment of colon cancer metastasis.
focal adhesion kinase; SW620; colorectal neoplasms; nude mouse; metastasis
R735.35
A
10.3969/j.issn.2095-9400.2015.07.007
2014-02-18
洪卫文(1983-),男,福建龙岩人,住院医师,硕士。

