低氧对无糖逆境中星形胶质细胞增殖和凋亡的作用
低氧对无糖逆境中星形胶质细胞增殖和凋亡的作用
李咏梅敖丽娟吴国瑞赵宁辉黄晓玮1徐蔚
(昆明医科大学第二附属医院,云南昆明650101)
摘要〔〕目的探讨星形胶质细胞对低氧的耐受程度;葡萄糖对其凋亡和增殖的影响及无糖逆境中低氧微环境对胶质细胞的是否具有保护作用及可能分子机制。方法通过三气培养箱构建低氧微环境,将星形胶质细胞(HAC)设为常氧常糖组(21%O2-G+)和常氧无糖组(21%O2-G-),低氧常糖组(0.1%O2-G+)和低氧无糖组(0.1%O2-G-)。分别在不同培养条件下培养24、48、72 h后通过MTT法及AnnexinV-FITC/PI染色流式细胞仪检测细胞增殖及凋亡情况,利用Western印迹法检测各组低氧诱导因子(HIF)-1α表达情况。结果在低氧常糖组星形胶质细胞各时间段无明显凋亡(P>0.05),但可缓慢增殖。常氧无糖组及低氧无糖组48 h细胞开始发生明显凋亡,增殖被显著抑制(P<0.05),48 h低氧无糖组细胞凋亡明显低于常氧无糖组(P<0.05),至72 h凋亡率高于常氧无糖组(P<0.05)。低氧可诱导HIF-1α表达水平增高,其中低氧常糖组HIF-1α表达水平最高,其次为低氧无糖组,常氧常糖及常氧无糖组表达量均较低。结论星形胶质细胞可耐受极度低氧;葡萄糖缺乏可诱导细胞发生明显的凋亡并抑制其增殖;低氧可在一定时限内部分对抗葡萄糖缺乏所诱导细胞凋亡。低氧可诱导HIF-1α的高表达,并且可能与低氧抗无糖逆境作用有关。
关键词〔〕低氧;葡萄糖;脑胶质细胞;凋亡;低氧诱导因子(HIF)-1α
中图分类号〔〕R743.3〔文献标识码〕A〔
基金项目:国家自然科学基金资助项目(81060208);国家自然科学基金资助项目(30660190)
通讯作者:徐蔚(1962-),男,博士生导师,教授,主要从事脑损伤研究。
1云南大学
第一作者:李咏梅(1975-),女,博士,讲师,主要从事神经康复研究。
Effect of hypoxia on astrocytes apoptosis in glucose-deprivation adversity
LI Yong-Mei,AO Li-Juan,WU Guo-Rui,etal.
Second Affiliated Hospital of Kunming Medical University,Kunming650101,Yunnan, China
Abstract【】ObjectiveTo explore the astrocytes tolerance to hypoxia microenvironment, the influence of glucose and glucose-free circumstances on astrocytes apoptosis and proliferation and whether hypoxia has the capacity of protection of astrocytes against apoptosis for glucose deprivation.MethodsThree gas incubator was employed to construct hypoxic micro-environment, then astrocyte (HAC cell-line)was placed in different cultured condition respectively at the same time: normaxia-glucose (21%O2-G+), normoxia glucose-free (21%O2-G-), hypoxia-glucose (0.1%O2-G+)and hypoxia glucose-free (0.1%O2-G-)for 24, 48, 72 h. By MTT method and Annexin V-FITC/PI staining cells to investigate cell proliferation and apoptosis at the corresponding time. Western blot method was used to detect HIF-1α expression level in the different condition. Compare the apoptosis and proliferation of astrocytes in different condition and the expression level of HIF-1α.ResultsThere were not obvious apoptosis when the oxygen concentration was very extremely low but in the presence of glucose (P>0.05). Moreover, the cells proliferated slowly. But glucose deprivation independently induced the apoptosis of the astrocytes and suppressed the proliferation rate of them. Whereas hypoxia decreased the effect of glucose deprivation(P<0.05). The hypoxia induced high level expression of HIF-1α protein. Under the condition of hypoxia at the presence of glucose, the expression level of HIF-1α was the most high.ConclusionsAstrocytes could tolerate extremely low oxygen. Glucose deprivation could independently induce the apoptosis and suppress the proliferation of the HAC. Hypoxia could decrease the apoptosis of the cells which glucose deprivation induced. The expression of HIF-1α could be induced by hypoxia. The expression of HIF-1αmay be associated with the effect of hypoxia anti-glucose deprivation adversity.
【Key words】Hypoxia; Glucose-deprivation;Astrocytes ; Apoptosis;HIF-1α
星形胶质细胞通过还原性谷胱甘肽(GSH)及红细胞生成素(EPO)的作用,保护神经元免于细胞毒性作用及氧化损伤,对维持神经元的生存微环境起着非常重要的作用〔1~3〕。在缺血性脑损伤中,周围的星形胶质细胞存活是神经元存活的必要条件〔4〕。目前研究发现预缺血可通过星形胶质细胞的介导提高脑的缺氧耐受能力〔5,6〕。但低氧也可诱导星形胶质细胞过度的增生,并产生一些有害的生物活性物质,引起星形胶质细胞损伤和功能障碍,形成胶质瘢痕作为机械屏障影响髓鞘和轴索的再生,从而影响周围神经组织的结构修复和功能恢复,最终影响神经元存活〔7〕。葡萄糖是脑内主要的能量物质来源,在低氧状态下,星形胶质细胞通过糖酵解来提供所需的能量〔8,9〕。在大部分的脑损伤中,缺血缺氧同时伴葡萄糖的缺乏是常见的病理生理状态〔10,11〕。已有大量的研究证实缺氧及葡萄糖剥夺可引起星形胶质细胞的功能受损并发生死亡,但对于星形胶质细胞耐受低氧的程度及时限以及葡萄糖缺乏对其在常氧和低氧下凋亡和增殖的影响的差异,低氧对星形胶质细胞对无糖逆境中的作用及可能机制尚未清晰阐明。低氧诱导因子(HIF)-1α可能具有抗凋亡和促凋亡的双重作用,在不同的细胞种类及其所处的特定微环境(如低氧环境),HIF-1α所调节的促凋亡因子和抗凋亡因子之间存在一种错综复杂的平衡关系,从而导致对凋亡过程的不同调控结果〔12~14〕。本研究探讨脑星形胶质细胞对低氧的耐受程度,葡萄糖对其凋亡和增殖的影响及无糖逆境中低氧微环境对脑胶质细胞的是否具有保护作用及可能分子机制。
1材料和方法
1.1细胞培养及实验分组将人小脑星形胶质细胞株HAC(购于中国科学院上海生命科学院),用基础培养基(DMEM/高糖+10%FBS+1%P/S,均购自Gibco)培养24 h,设为常氧常糖对照组(21%O2-G+)和常氧无糖(21%O2-G-)组,低氧(0.1%O2)常糖组和低氧(0.1%O2)无糖组。于三气培养箱及低氧培养箱中相应氧浓度及培养基中分别培养24、48、72 h后检测细胞凋亡和增殖。
1.2MTT实验检测细胞存活及增殖取对数HAC细胞,每组设5个复孔。以1.5×104个/ml密度接种于96孔板,每孔200 μl。按分组处理24、48、72、96及120 h后取出细胞,弃上清液,加入工作浓度为0.5 mg/ml的MTT(购自Sigma)溶液,放入培养箱继续孵育4 h;弃MTT溶液,每孔加入150 μl DMSO,微量振荡器振荡10 min将结晶完全溶解,利用酶标仪在492 nm波长下测定各孔吸光值(A值),纵轴绘制细胞生长曲线。
1.3AnnexinV/PI双染流式细胞仪检测细胞凋亡根据AnnexinV/PI凋亡试剂盒(购自Enzo Life Sciences)操作说明,按实验分组以8×104个/皿的密度种植细胞于6 cm2的培养皿,相应时间段处理及收集细胞;每个样本取总数约为(0.5~1)×106个细胞,预冷,4℃无菌的1×PBS充分洗涤细胞2次;用400 μl结合缓冲液(1×)重悬细胞;加入5 μl FITC标记的Annexin V,轻轻混匀后间隔5 min,再加入10 μl浓度为20 μg/ml的碘化丙啶(PI)溶液;混匀后室温避光孵育10 min;立即用FACScan进行流式细胞术定量检测,WinMDI 2.8系统绘制流式图并分析出凋亡率。
1.4HIF-1α表达的检测采用Western印迹法用细胞裂解液裂解细胞,分别提取各组相应时间段的细胞总蛋白,BCA法(碧云天)进行蛋白质浓度测定,各组样本取总蛋白20 g上样进行SDS-PAGE电泳后转聚偏二氟乙烯(PVDF)(Phamacia)膜。封闭1 h后HIF-1α一抗(BD,1∶800)孵育过夜,以β-actin做内参(1∶10 000)。于HRP标记的二抗室温孵育1 h,电化学发光(ECL)显影,凝胶成像系统行图像扫描后成像分析。
1.5统计学方法采用SPSS16.0软件进行单因素方差分析及q检验。
2结果
2.1MTT法检测常氧和低氧条件下HAC细胞增殖情况0.1%的低氧下,HAC细胞仍可缓慢增殖,但增殖率较常氧组细胞增殖减慢(P<0.05)。无糖常氧组及无糖低氧组细胞增殖均明显受到抑制(P<0.05),无糖低氧组细胞增殖抑制更为显著(P<0.05)。见图1。
2.2HAC细胞在不同培养条件下的凋亡率与常氧常糖组比较,低氧常糖组细胞各时间段未发现明显凋亡(P>0.05);无糖常氧及无糖低氧组48 h细胞凋亡显著(P<0.05),48 h低氧无糖组细胞凋亡明显低于常氧无糖组(P<0.05),72 h凋亡则显著高于常氧无糖组(P<0.05),见表1,图2。
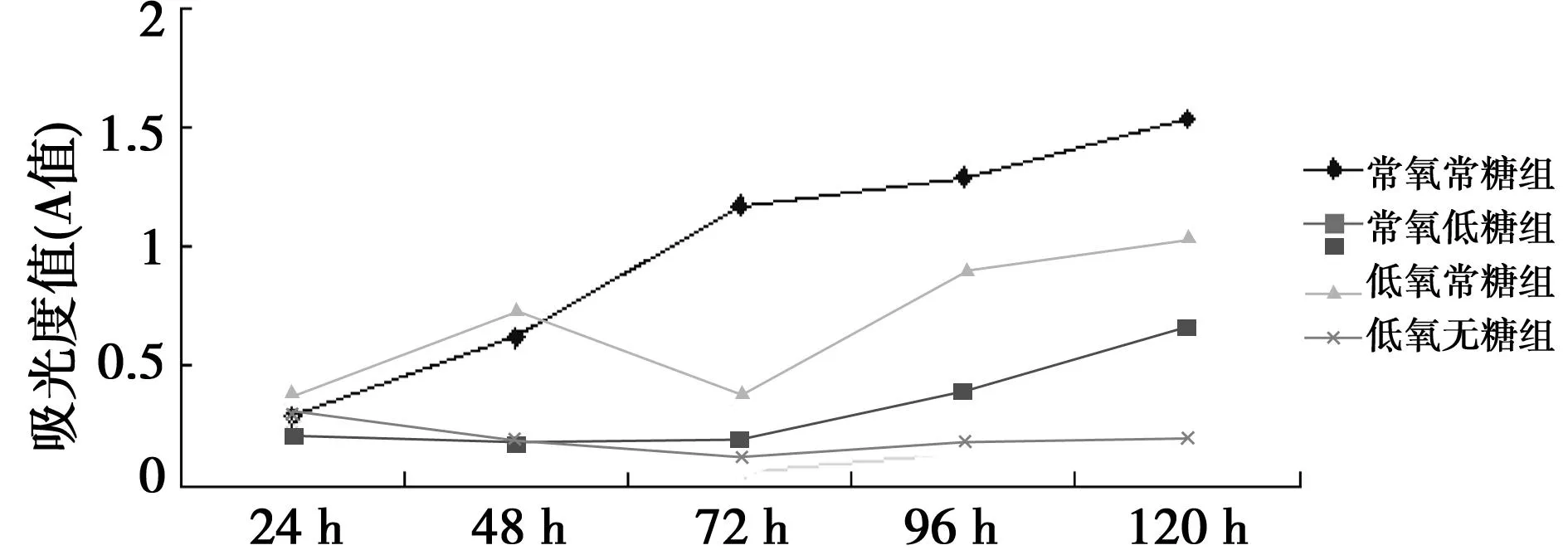
图1 HAC细胞在不同培养条件下的生长曲线

常氧常糖组常氧无糖组低氧常糖组低氧无糖组24p.97±0.344.86±0.573.26±0.143.52±0.4548p.06±0.4610.54±0.481)4.32±0.738.16±0.151)2)72p.13±0.715.11±0.181)5.08±0.2117.37±0.591)2)
与常氧常糖组比较:1)P<0.05;与常氧无糖组比较:2)P<0.05
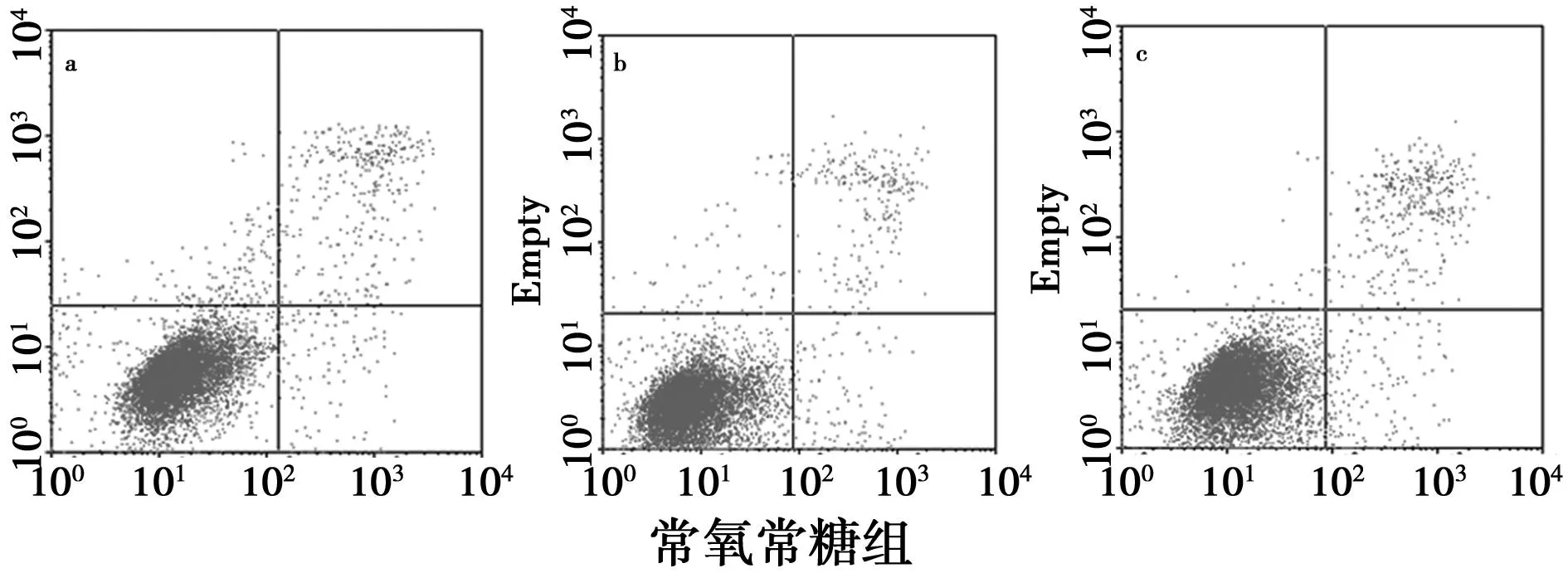

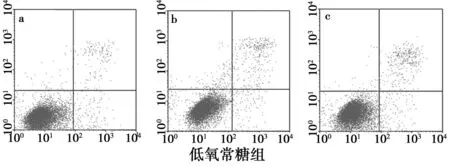

图2 各组HAC细胞凋亡率
2.3各组HIF-1α蛋白表达常氧下HAC细胞少量表达HIF-1α,低氧组HIF-1α表达量较常氧组明显增高;各个时段均以低氧常糖组表达量最高,其次为低氧无糖组,常氧无糖组及常氧常糖组表达量均较低。低氧无糖组在处理24 h后表达量开始增高,48 h达最高,72 h则逐渐降低。低氧常糖组24 h开始增高,并持续至72 h(图3)。

图3 各组HIF-1α蛋白表达差异
3讨论
星形胶质细胞在低氧下的反应与脑损伤后神经功能的恢复有着十分密切的关系,本文结果说明星形胶质细胞具有很强的耐低氧能力,当葡萄糖存在的条件下,即便是极度低氧下,星形胶质细胞可发生适应性改变,调整其生物学行为,减缓增殖速率,降低能量消耗,从而避免过度消耗内环境中的营养物质,维持细胞的生存状态,从而防止了细胞发生大量死亡。学者〔15〕研究了0.1%的低氧条件下培养8 h的星形胶质细胞可保持正常的细胞形态,仅表现为轻度的代谢障碍现象的表现:主要是细胞折光性变弱,轮廓加强,胞质内出现空泡、脂滴或颗粒样物质等,证明这些细胞对线粒体功能受限具有较强的耐受性。Schmid-Brunclik等〔15〕的研究也证实了在极度低氧下6 h星形胶质细胞无明显凋亡,但却显著促进细胞增殖。本研究延长了极度低氧的时限,发现极度低氧后,与之前的研究〔15,16〕一致的是星形胶质细胞的凋亡并未受到影响,相反还可发生增殖,但随时间的延长,增殖速度减慢。
低氧下星形胶质细胞的代谢方式由正常时有氧代谢为主转变为无氧糖酵解的能力加强,以便保证维持细胞在低氧下的能量代谢的需要。与此相适应的是星形胶质细胞在低氧下具有很高的内源性乳酸脱氢酶(LDH)活性,以提高无氧糖酵解的效率,以满足细胞在低氧下的能量代谢需要,最终拮抗细胞凋亡〔16〕。但脑组织在缺血缺氧的过程中却常常伴随无糖逆境的出现,有研究表明,低氧条件下葡萄糖含量的不同,引起组织损伤的程度也不同〔17〕。目前氧和葡萄糖剥夺模型已成为缺血缺氧的常用模型,基于这个模型进行大量对星形胶质细胞的能量代谢方式及神经保护作用及相关机制方面的研究,较为一致的结论是:氧和葡萄糖剥夺可引起星形胶质细胞的凋亡和坏死,而一些物质可以减轻由此引起的细胞损伤〔18〕。研究发现在常氧下葡萄糖剥夺可通过细胞毒性作用,即增加氧化物和氮化物及脂质体的影响星形神经细胞谷氨酸代谢并损害星形胶质细胞的功能〔19〕。Danilov等〔20〕研究了正常氧浓度葡萄糖剥夺和低氧(7%O2)葡萄糖剥夺4 h的星形胶质细胞死亡情况,结果发现较低的氧浓度下葡萄糖剥夺所诱发的细胞死亡反而更少,这提示了低氧可能保护了无糖逆境下所诱导的星形胶质细胞使其免于氧化应激损伤。本文提示葡萄糖缺乏可作为独立因素诱导星形胶质细胞的死亡,但极度低氧可在短期内部分逆转无糖逆境所引起的细胞凋亡和增殖,即低氧对无糖逆境中的星形胶质细胞具有保护作用。这种保护作用的存在可能得益于低氧下的糖酵解代谢方式的快速启动,星形胶质细胞利用细胞内残存的少量葡萄糖及乳酸等糖酵解的产物进行能量代谢。而越是耐受低氧的细胞其快速启动糖酵解的能力更强。由于常氧下培养的细胞主要的代谢方式为葡萄糖的氧化磷酸化,将蛋白质等物质转化呈氧化磷酸化产物的过程则需要一定的时间,因而出现了严重的能量代谢障碍,从而引起大量的细胞死亡。但在葡萄糖剥夺后72 h,结果却发生不同的改变,说明极度低氧对无糖逆境的保护作用在时间上是有限的,随时间的延长,细胞内葡萄糖等无氧酵解的产物耗竭,这种保护作用会逐渐消失。
HIF-1的生理活性主要取决于HIF-1α亚基的活性和表达,因其结构中还存在有氧依赖的降解结构域(ODD),因此HIF-1α极易在常氧下降解。在低氧下,HIF-1α趋于稳定,因而在某些低氧细胞和组织中大量表达。学者〔21〕就对慢性脑缺氧下星形胶质细胞内HIF-1α的表达进行了相关研究,结果发现在轻度低氧下星形胶质细胞内HIF-1α蛋白的表达快速增高,并且持续14 d,至21 d后HIF-1α才开始回落。在严重低氧下(0.1% O2)星形胶质细胞形态与正常氧浓度下细胞比较未发生明显改变,并且同时伴随HIF-1α表达的增高,当用HIF-1α抑制剂阻断其作用后,星形胶质细胞发生形态改变并出现死亡,说明了HIF-1α表达可能保护了低氧下的星形胶质细胞。低氧下GSH可增加HIF-1α的稳定性,上调HIF-1α的表达,阻断GSH的表达则降低HIF-1α的水平,从而减轻低氧诱导的谷氨酸毒性作用对星形胶质细胞的影响〔22〕。这些研究结果均提示星形胶质细胞低氧保护作用主要通过HIF-1α介导。去铁胺(DFX)预处理可明显减少氧和葡萄糖剥夺所引起的细胞凋亡和肿胀,并且减少LDH及ROS的释放,降低caspase-3的水平而上调HIF-1α的水平〔23〕,说明HIF-1α上调可能保护氧和葡萄糖剥夺引起的细胞损伤。本文发现低氧可对抗无糖逆境所诱导的星形胶质细胞凋亡,极度低氧下无论葡萄糖存在与否均可诱导HIF-1α表达水平增高。而在常氧条件下,无论葡萄糖存在与否,星形胶质内HIF-1α均呈低表达。可以推测低氧通过HIF-1α的作用可部分逆转葡萄糖剥夺所诱导的细胞凋亡,但其作用仅限于一定的时限内。综上,脑星形胶质细胞可耐受极度低氧;葡萄糖缺乏可诱导细胞发生明显的凋亡并抑制其增殖;低氧可对抗葡萄糖缺乏对细胞凋亡的影响。
4参考文献
1Coulter DA,Eid T.Astrocytic regulation of glutamate homeostasis in epilepsy〔J〕.Glia,2012;60(8):1215-26.
2Hertz L,Zielke HR.Astrocytic control of glutamatergic activity:astrocytes as stars of the show〔J〕.Trends Neurosci,2004;27(12):735-43.
3Ransom BR,Ransom CB.Astrocytes:multitalented stars ofthe central nervous system〔J〕.Methods Mol Biol,2012;814:3-7.
4Takano T,Oberheim N,Cotrina ML,etal.Astrocytes and ischemic injury〔J〕.Stroke,2009;40(3 Suppl):S8-12.
5Hirayama Y,Ikeda-Matsuo Y,Notomi S,etal.Astrocyte-mediated ischemic tolerance〔J〕.Neurochem Res,2012;37(3):527-37.
6Gong SJ,Chen LY,Zhang MJ,etal.Intermittenthypobarichypoxia preconditioning induced brain ischemic tolerance by up-regulating glial glutamate transporter-1 in rats〔J〕.Neuroscience,2015;35(9):3794-805.
7Wang R,Zhang X,Zhang J,etal.Oxygen-glucose deprivation induced glial scar-like change in astrocytes〔J〕.PLoS One,2012;7(5):e37574.
8Belanger M,Allaman I,Magistretti PJ.Brain energy metabolism:focus on astrocyte-neuron metabolic cooperation〔J〕.Cell Metab,2011;14(6):724-38.
9Allaman I,Belanger M,Magistretti PJ.Astrocyte-neuronmetabolic relationships:for better and for worse〔J〕.Trends Neurosci,2011;34(2):76-87.
10Gouix E,Buisson A,Nieoullon A,etal.Oxygen glucosedeprivationinduced astrocyte dysfunction provokes neuronal death through oxidative stress〔J〕.Pharmacol Res,2014;87:8-17.
11Huang Q,Zhang R,Zou Ly,etal.Cell death pathways in astrocytes with a modified model of oxygen-glucose deprivation〔J〕.PLoS One,2013;8(4):e61345.
12Huang XW,Zhao NH,Xu W,etal.The experimental study of hypoxia-inducible factor-1α and its target genes in spinal cord injury〔J〕.Spinal Cord,2006;44:35-43.
13Semenza GL.Hypoxia-inducible factor 1 and cancer pathogenesis〔J〕.IUBMB Life,2008;60(9):591-7.
14Greijer AE,van der Wall E.The role of hypoxia inducible factor 1 (HIF-1)in hypoxia induced apoptosis〔J〕.J Clin Pathol,2004;57(10):1009-14.
15Schmid-Brunclik N,Bürgi-Taboada C,Antoniou X,etal.Astrocyte responses to injury:VEGF simultaneously modulates cell death and proliferation〔J〕.Am J Physiol Regul Integr Comp Physiol,2008;295(3):R864-73.
16Marrif H,Juurlink BH.Astrocytes respond to hypoxia by increasing glycolytic capacity〔J〕.J Neurosci Res,1999;57(2):255-60.
17Poulsen RC,Knowles HJ,Carr AJ,etal. Cell differentiation versus cell death:extracellular glucose is a key determinant of cell fate following oxidative stress exposure〔J〕.Cell Death Dis, 2014;20(5):e1074.
18Danilov CA,Chandrasekaran K,Racz J,etal.Sulforaphane protects astrocytes against oxidative stress and delayed death caused by oxygen and glucose deprivation〔J〕.Glia,2009;57(6):645-56.
19Quincozes-Santos A,Bobermin LD,de Souza DG,etal.Glio preventive effects of guanosine against glucose deprivation in vitro〔J〕.Purinergic Signal,2013;9(4):643-54.
20Danilov CA,Fiskum G.Hyperoxia promotes astrocyte cell death after oxygen and glucose deprivation〔J〕.Glia,2008;56(7):801-8.
21Chávez JC,Agani F,Pichiule P,etal.Expression of hypoxia-inducible factor-1alpha in the brain of rats during chronic hypoxia〔J〕.J Appl Physiol,2000;89(5):1937-42.
22Badawi Y,Ramamoorthy P,Shi H.Hypoxia-inducible factor 1 protects hypoxic astrocytes against glutamate toxicity〔J〕.ASN Neurol,2012;4(4):231-41.
23Zhang R,Huang Q,Zou L,etal.Beneficial effects of deferoxamine against astrocyte death induced by modified oxygen glucose deprivation〔J〕.Brain Res,2014;1583:23-33.
〔2014-12-07修回〕
(编辑苑云杰)

