动态增强MRI相关参数对鼻咽癌放化疗患者预后的评估作用
动态增强MRI相关参数对鼻咽癌放化疗患者预后的评估作用
张菁菁周敬淳1蔡智杨媛媛郑世信
(北京大学深圳医院耳鼻喉科,广东深圳518000)
摘要〔〕目的探讨乏氧诱导因子(HIF)-α与预后状况和动态增强MRI(DCE-MRI)参数对鼻咽癌放化疗患者预后的评估作用。方法选取该院鼻咽纤维镜病理活检证实并行放化疗鼻咽癌患者75例,全部病理活检和放化疗前行DCE-MRI以采集相关参数(正性增强积分PEI、最大上升斜率MSI、最大下降斜率MSD、达峰时间TTP),免疫组化方法检测HIF-1α表达,Kaplan-Meier曲线分析预后状况。结果HIF-1α阳性率为78.67 %,与HIF-1α阴性组比较,HIF-1α阳性组总缓解率、局部控制率、总生存率亦明显降低,而远处转移率明显增高(P<0.05),Kaplan-Meier曲线分析显示,HIF-1α阳性组1、2、3年无瘤生存率明显低于HIF-1α阴性组(P<0.05);且HIF-1α阳性组PEI、MSI、MSD、TTP明显高于HIF-1α阴性组(P<0.05)。结论HIF-1α阳性表达预示鼻咽癌放化疗患者预后不良,且与DCE-MRI相关参数紧密相关,DCE-MRI参数对鼻咽癌预后具有评估作用。
关键词〔〕动态增强MRI;鼻咽癌;放化疗
中图分类号〔〕R445〔文献标识码〕A〔
基金项目:深圳市科技计划项目技术开发技术创新计划多方合作项目(CXZZ20140509151403304)
通讯作者:周敬淳(1981-),男,硕士,主治医师,主要从事耳鼻咽喉-头颈肿瘤研究。
1深圳市人民医院耳鼻喉科
第一作者:张菁菁(1981-),女,硕士,主要从事咽喉头颈方向的研究。
鼻咽癌是头颈部常见的恶性肿瘤类型之一,同步放化疗和放射治疗是鼻咽癌的主要治疗手段,但肿瘤局部复发或残存是死亡的重要原因〔1〕。同步放化疗受个体差异、肿瘤病理特征和治疗方法等多因素影响,同时治疗效果与疾病预后紧密相关〔2〕。动态增强MRI(DCE-MRI)是微创MRI成像技术,经时间-信号强度曲线(TIC)反映肿瘤血流灌注特征〔3〕。本研究探讨DCE-MRI相关参数与鼻咽癌放化疗患者预后状况的关系。
1资料与方法
1.1临床资料回顾性分析2010年1月至2014年8月我院以及深圳市人民医院鼻咽癌患者75例,纳入标准:全部患者行DCE-MRI检查,检查后电子鼻咽镜活检病理诊断证实鼻咽癌〔4〕,实施放化疗辅助治疗措施,男54例,女21例,年龄30~76〔平均(46.97±10.67)〕岁;低分化鳞癌70例,中分化鳞癌2例,未分化鳞癌1例,肉瘤样癌1例,泡状核细胞癌1例;有淋巴结转移55例,无淋巴结转移20例;Ⅱ期25例,Ⅲ期26例,Ⅳ期24例。
1.2方法①放化疗方法:全部患者采用调强放疗(IMRT),直线加速器6 MV X线,2 Gy/d,5次/w,总辐射剂量70~76 Gy,放疗开始1 d时行单用化疗药物(顺铂100 mg/m2)化疗,静脉注入顺铂,21 d为1个化疗周期,放射治疗和化疗同期结束。②DCE-MRI检查方法:采用Signa Excite HD 1.5 T超导型MRI系统八通神经血管阵列线圈,采用快速恢复自旋回波序列行横断面、矢状面和冠状面脂肪抑制序列扫描,横断面采用扩散加权成像,再行动态增强MRI扫面,静脉注射0.2 ml/kg Gd-DTPA 2.5 ml/s,联合0.9%生理盐水20 ml冲入,横断面、矢状面和冠状面快速扰相梯度回波序列的动态增强MRI扫描,调节参数如下:TR:3.8~4.8 ms,TE 1.5 ms,采集带宽125,3.6 mm×40层,层间距0,矩阵320×224,扫描时间16~18 s,范围14.4 cm,于Gd-DTPA注射前20 s和注射后20~240 s,每隔20 s,获取DCE-MRI图像。图像输入ADW工作站,经Functool软件,选取3个感兴趣区(ROI),根据TIC曲线,自动计算正性增强积分(PEI)、最大上升斜率(MSI)、最大下降斜率(MSD)与达峰时间(TTP)。③预后因子检测方法:电子鼻咽镜病理活检采集鼻咽癌组织,10%甲醛固定,石蜡包埋,4 μm切片,脱蜡,3%H2O2处理10 min,蒸馏水洗涤6 min,放于乙二胺四乙酸(EDTA)缓冲液,微波炉高温抗原修复15 min,采用鼠抗人二氧诱导因子(HIF)-1α多克隆抗体(Abcam公司),二氧基联苯胺(DAB)显色,苏木素-伊红(HE)复染,严格按照免疫组化试剂盒说明说操作。
1.3观察指标(1)参照世界卫生组织实体肿瘤疗效评估标准〔5〕,完全缓解(CR):肿瘤病灶组织完全消失并维持4 w以上;部分缓解(PR):肿瘤病灶最大径、最大垂直直径(两径)乘积下降幅度超于25%;疾病稳定(SD)肿瘤病灶两径下降或升高幅度低于25%,未见新病灶;疾病进展(PD)肿瘤病灶两径升高幅度超于25%或新肿瘤病灶形成。总缓解率=(CR+PR)/研究例数×100%。(2)HIF-1α检测:细胞核见棕黄色颗粒状物质为阳性产物,其中以染色强度积分与和染色面积积分之和评定,不染色为0分,轻度染色为1分,中度染色评定为2分,强度染色评定为3分;染色面积<10%评定为0分,染色面积11%~25%为1分,染色面积26%~50%为2分,染色面积>50%为3分;两者之和>2分为阳性表达,反之为阴性表达。
1.4统计学方法应用SPSS18.0软件行t、χ2检验。
2结果
2.1HIF-1α表达与放化疗疗效的关系HIF-1α阳性率为78.67 %(59/75),总缓解率为74.67% (56/75),HIF-1α阳性组放化疗总缓解率(69.49%,CR13例,PR28例,SD10例,PD8例)明显低于HIF-1α阴性组(93.75%,CR10例,PR5例,SD1例,PD0例)(P<0.05)。见图1。
2.2HIF-1α表达与预后的关系HIF-1α阳性组1、2、3年无瘤生存率(84.74%、79.66%、69.49%)明显低于HIF-1α阴性组(100.00%、93.75%、81.25%);HIF-1α阳性组3年局部控制率、无瘤生存率、总生存率明显低于HIF-1α阴性组,HIF-1α阳性组远处转移明显高于HIF-1α阴性组(P<0.05)。见表1。
2.3HIF-1α表达与DCE-MRI参数关系HIF-1α阳性组PEI、MSI、MSD、TTP明显高于HIF-1α阴性组(P<0.05)。见表2。
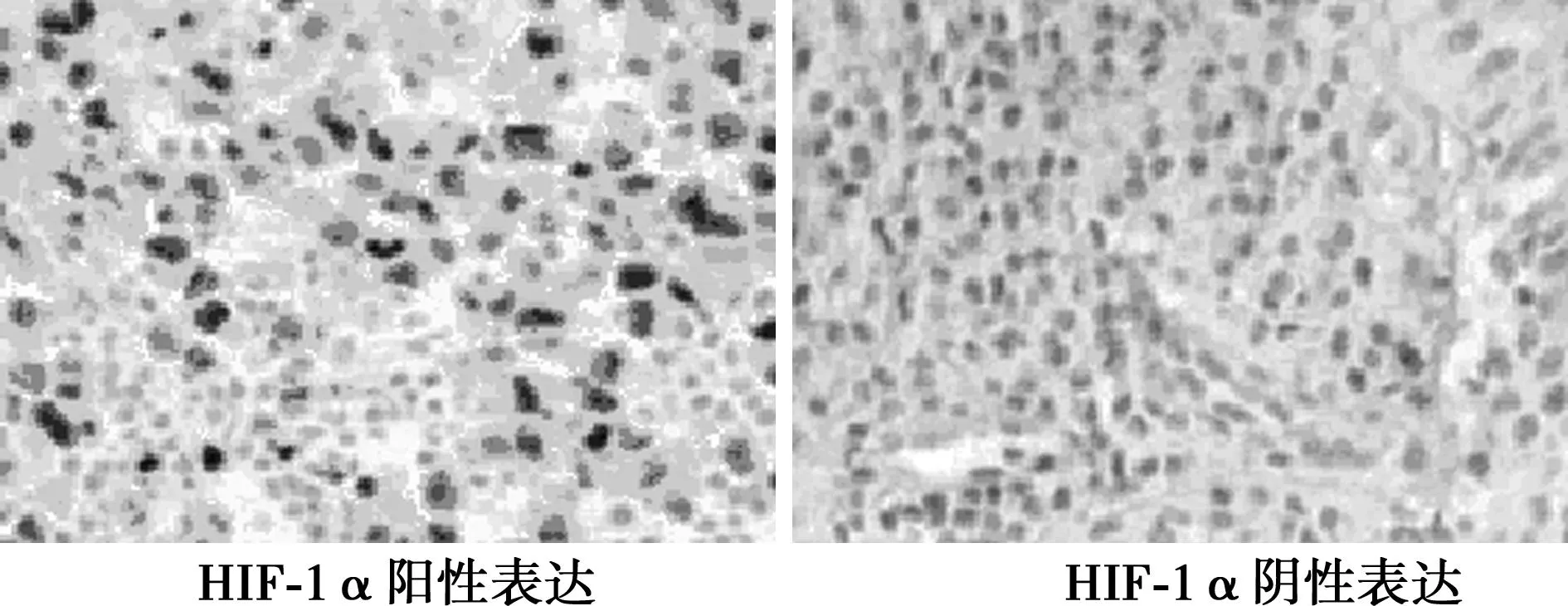
图1 鼻咽癌组织HIF-1α免疫组化检测图(×400)

组别n3年局部控制无瘤生存远处转移总生存HIF-1α阳性组5947(79.66)1)41(69.49)1)17(28.81)1)42(71.19)1)HIF-1α阴性组1615(93.75)13(81.25)2(12.50)14(87.50)
与HIF-1α阴性组比较:1)P<0.05
表2 HIF-1α表达与DCE-MRI参数的关系
3讨论
细胞对电离辐射效应有赖于氧存在,富氧条件下放射线照射占位性病变组织形成氢氧自由基,增强放射线对肿瘤细胞的损伤程度。肿瘤细胞缺氧主要由微循环短期波动、血流灌注不足和氧弥散功能异常导致,其中肿瘤富氧细胞放射治疗临床疗效显著优于肿瘤缺氧细胞。同时多数研究证实,恶性肿瘤广泛存在缺氧现象,肿瘤缺氧细胞是肿瘤细胞恶性病变、恶性肿瘤侵袭转移能力增强和肿瘤细胞放化疗抗体形成的重要原因〔6〕。HIF-1α是HIF重要的氧调节因子之一,其在正常氧气状态下,HIF-1α羟基化产物与VHL蛋白相结合发生泛素化,蛋白降解,而在缺氧条件下,羟脯氨酸表达缺失抑制羟基化,抑制HIF-1α转录,HIF-1α在细胞核内积聚,与HIF-1β形成HIF-1复合体,后者通过激活HIF-1α靶基因表达,从而促进肿瘤新生血管形成,降低放化疗敏感性,严重影响放化疗预后状况〔7〕。因此,HIF-1α表达程度可作为恶性肿瘤放化疗患者预后的重要因子。DCE-MRI显示微循环组织高灌注状态的肿瘤区域。理论上,DCE-MRI下高灌注肿瘤区域病理上主要由肿瘤富氧细胞组成,其血液供应丰富,微循环组织灌注量高,氧含量高,其对放化疗敏感性较高;反之,DCE-MRI下低灌注肿瘤区域病理上主要由肿瘤缺氧细胞组成,其血液供应缺乏,微循环组织灌注量低,氧含量低,其对放化疗敏感性较低〔8〕。因此,DCEIAMRI检查具有反映微循环组织灌注量和氧含量以评估肿瘤细胞放化疗临床疗效,预示恶性肿瘤预后状况。
本研究结果揭示了HIF-1α阳性表达行鼻咽癌放化疗患者预后不良〔9〕;另一方面,不同HIF-1α表达者DCE-MRI相关参数(PEI、MSI、MSD、TTP)差异显著,体现在:①DCE-MRI对肿瘤组织的强化方式主要取决于血管化程度(早期强化)、血管通透性和细胞外间隙(后期强化);早期强化反映血管化程度和血流灌注量,早期强化者血流高灌注量,处于富氧状态,HIF-1α阴性表达,强化信号达峰时间TTP越短,放化疗预后状况佳〔10〕。后期强化由对比剂流入与流出细胞外间隙平衡状态决定,其中细胞外间隙小则流出大于流入,时间-信号强度曲线呈下降趋势,细胞外间隙大则对比剂蓄积导致TIC曲线上升;中等大则TIC处于平台期。MSI、MSD是指TIC曲线上升段和下降段的最大斜率,是反映对比剂血流灌注量和细胞外间隙,当血流低灌注量或细胞外间隙较大者,MSI、MSD值增高,肿瘤细胞缺氧程度加重,HIF-1α阳性表达,放化疗预后欠佳。PEI是指TIC曲线下面积总和,受不同TIC类型影响,其中速升速降型与速升平台型TIC曲线PEI越高,HIF-1α阳性表达率增加,预后状况较差,但与相关研究显示PEI对预测放化疗敏感程度及其预后状况价值有限〔11〕。因此,DCE-MRI相关参数可能通过影响肿瘤细胞缺氧程度及其HIF-1α表达导致鼻咽癌预后的差异,其对疾病放化疗预后程度具有重要的评估意义。
4参考文献
1卢小迪,朱小东,赵伟,等.抑制磷酸腺苷激活的蛋白激酶活性增强人鼻咽癌细胞放射敏感性〔J〕.重庆医学,2014;43(22):2900-2.
2林蒙,余小多,赵燕风,等.扩散加权成像表观扩散系数预测鼻咽癌同步放化疗疗效〔J〕.中国医学影像技术,2014;30(7):986-90.
3林蒙,余小多,罗德红,等.MR 扩散加权成像预测鼻咽癌患者同步放化疗疗效的可行性〔J〕.中华放射学杂志,2014;48(6):467-71.
4余意,黄瑜芳,陈冬平,等.鼻咽癌患者营养干预时机的初步研究〔J〕.实用医学杂志,2014;30(13):2090-2.
5宋亚颀.多西他赛单药同步放化疗治疗局部晚期鼻咽癌疗效研究〔J〕.南京医科大学学报:自然科学版,2014;34(3):343-5.
6胡建新,古伟光,贺志仁,等.同步放化疗联合尼妥珠单抗对局部晚期鼻咽癌的近期疗效观察〔J〕.广东医学,2013;34(13):2094-6.
7Yun JW,Son MJ,Abdelmegeed MA,etal.Binge alcohol promotes hypoxic liver injury through a CYP2E1-HIF-1α-dependent apoptosis pathway in mice and humans〔J〕.Free Radical Biol Med,2014;77(2):183-94.
8谢国丰,黄赖机,叶家才,等.时辰化疗对鼻咽癌同步放化疗患者生活质量的影响〔J〕.广东医学,2014;35(3):393-5.
9林蒙,余小多,李琳,等.MRI动态增强对鼻咽癌同步放化疗敏感性的预测研究〔J〕.临床放射学杂志,2014;33(5):689-94.
10李梦颖,代光政,李智勇.动态增强MRI在肺癌的预后及放化疗疗效评价中的研究进展〔J〕.CT理论与应用研究,2012;21(4):781-6.
11余小多,林蒙,黄曼妮,等.动态增强MRI评估子宫颈鳞癌同步放化疗疗效〔J〕.临床放射学杂志,2014;33(1):54-8.
〔2014-11-15修回〕
(编辑袁左鸣)

