肾上腺髓质素对大鼠肢体缺血再灌注后心肌损伤和细胞凋亡的影响
肾上腺髓质素对大鼠肢体缺血再灌注后心肌损伤和细胞凋亡的影响
(唐山职业技术学院基础医学部生理学教研室,河北唐山063000)
摘要〔〕目的观察大鼠肢体缺血再灌注后心肌细胞凋亡情况,探讨外源性肾上腺髓质素(ADM)对大鼠肢体缺血再灌注(LIR)后心肌损伤的保护机制。方法健康雄性Wistar大鼠30只,随机分成对照组(Control组)、肢体缺血再灌注4 h组(LIR组)和ADM+ LIR组(ADM组),每组10只。生化法检测血浆心肌酶含量;比色法测定心肌组织丙二醛(MDA)和超氧化物歧化酶(SOD)含量的变化;免疫组织化学法检测心肌组织凋亡蛋白酶Caspase-3蛋白表达情况;原位末端脱氧核糖核苷酸转移酶标记(TUNEL)技术检测心肌凋亡细胞。结果与LIR组比较,心肌酶含量下降,心肌组织MDA含量减少,SOD活性增强(P<0.01);心肌组织Caspse-3蛋白表达下降,心肌细胞凋亡指数明显下降(P<0.01)。结论ADM可减轻大鼠LIR后心肌损伤,其机制可能与抑制心肌氧化应激与细胞凋亡有关。
关键词〔〕再灌注损伤;心肌;凋亡;肾上腺髓质素;氧化应激
中图分类号〔〕R363〔文献标识码〕A〔
基金项目:唐山市科学技术研究与发展项目(No.12130239b)
1唐山市开滦总医院ICU
第一作者:朱娜(1977-),女,硕士,讲师,主治医师,主要从事肢体缺血再灌注损伤的防治及机制研究。
肢体缺血再灌注(LIR)可造成肢体以外远隔器官损伤。再灌注后氧自由基和炎性因子大量生成,细胞过度凋亡等因素相互关联,共同影响着远隔器官的病理生理过程〔1,2〕。LIR后可造成心肌形态结构及代谢改变。寻找防治再灌注后损伤的有效药物是近年热点之一。肾上腺髓质素(ADM)是内源保护性调节肽,具有舒张阻力血管、抑制细胞凋亡、降低氧化应激等作用。文献证实外源性应用可减轻心肌细胞死亡,改善心功能〔3〕。本实验观察外源性ADM对LIR大鼠心肌损伤及细胞凋亡的影响,探讨ADM对心肌的保护作用。
1材料与方法
1.1 动物及分组由河北联合大学医学院动物实验中心提供,健康成年雄性Wistar大鼠30只。实验大鼠随机分为对照组(Control组)、肢体缺血再灌注组(LIR 组)和ADM+ LIR组(ADM组),每组10只。
1.2 试剂和仪器TUNEL试剂盒、Caspase-3一抗、即用型免疫组化试剂盒等购自北京中山生物制剂公司;丙二醛(MDA)、超氧化物歧化酶(SOD)检测试剂盒由南京建成生物工程研究所提供;ADM试剂由北京康肽生物有限公司提供。Nikon摄影生物光学显微镜:日本日立公司生产;Motic 医学图像分析系统:麦克奥迪仪器仪表有限公司;DF-205恒温干燥箱:北京西城区医疗器械二厂。
董登新指出,其实大多数公司停牌的理由都是一样的:拟筹划重大事项。其实,股民也心知肚明,其目的就是躲避股灾,不过后来复牌仍躲不过“补跌”,因为股价变动是有比价效应的。
1.3 模型制备采用本室常规方法建立大鼠LIR模型,即用橡皮圈环绕结扎大鼠双后肢根部,阻断血流4 h后松解,恢复灌注4 h,于松解前15 min以20%乌拉坦腹腔注射麻醉,固定于解剖台上,颈正中部切口分离左侧颈外静脉插管,注入肝素(1 000 U/kg)抗凝血。ADM组按模型操作,松解前15 min经颈外静脉插管缓慢推注1.0 nmol/kg ADM生理盐水溶液。Control组双后肢松弛环绕橡皮圈,不阻断血流,LIR组按模型操作,松解前15 min均通过颈外静脉插管推注4 ml/kg生理盐水。结扎时双下肢皮肤苍白,温度降低触之冰冷,松开止血带,皮肤逐渐变红,局部温度升高,双下肢肿胀。经激光多普勒血流仪检测肢体血流情况证实模型成功。
1.4 标本采集与检测
1.4.1 血清心肌酶测定从腹主动脉放血处死动物并收集血液,常温离心后取血浆,HI-TACHI7200全自动生化分析仪测定肌酸激酶(CK)和肌酸激酶同工酶(CK-MB)含量。
1.4.2 心肌组织氧化应激指标的测定取心肌组织加冷生理盐水制备10%组织匀浆,离心10 min,收集上清液,比色法检测心肌组织MDA和SOD含量。
1.4.3 心肌组织Caspase-3蛋白水平的测定 心脏经滤纸吸干血迹,取心尖部心室肌组织,4%多聚甲醛固定石蜡包埋切片,按免疫组化常规操作。细胞质呈棕黄色染色者为阳性细胞。采用Motic医学图像分析系统软件对各组大鼠心肌组织切片进行分析,镜下以相同外部条件摄取图像,每张随机选择6个视野,取平均值。
1.4.4 TUNEL法心肌细胞凋亡的测定 检测方法严格按说明书操作。细胞核呈棕黄色颗粒者为阳性细胞,即凋亡细胞,计算6个高倍视野下的凋亡细胞数及凋亡指数(AI)。
1.5 统计学分析采用SPSS13.0统计软件进行单因素方差分析。
2结果
2.1各组大鼠血清心肌酶含量的变化LIR组与Control组比较,血浆CK和CK-MB含量均明显升高(P<0.01);给予ADM后,血浆CK和CK-MB含量较LIR组降低(P<0.01)。见表1。

表1 各组大鼠血清CK和CK-MB
与Control组比较:1)P<0.01;与LIR组比较:2)P<0.01;下表同
2.2 各组大鼠心肌组织MDA和SOD含量的变化 LIR组与Control组比较,心肌组织MDA含量升高,SOD含量降低(P<0.01);给予ADM后,MDA含量较LIR组明显降低(P<0.01),但仍高于Control组,SOD含量增高 (P<0.01)。见表2。

表2 各组大鼠心肌组织MDA和
2.3 各组大鼠心肌凋亡的情况变化TUNEL染色可见阳性细胞核呈棕黄色改变,形态不规整。Control未见TUNEL阳性细胞。心肌细胞Caspase-3免疫组化染色阳性细胞主要表现为,心肌细胞胞质或胞膜呈棕黄色颗粒或匀质状。Control组呈弱阳性表达。LIR组与对照组比较,凋亡细胞增多,凋亡指数明显升高,心肌细胞Caspase-3表达明显上调(P<0.01)。ADM组与LIR组比较,凋亡细胞减少,凋亡指数明显下降,心肌细胞Caspase-3表达明显下调(P<0.01),见表3,图1、图2。
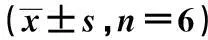
表3 各组大鼠心肌组织Caspase-3表达和
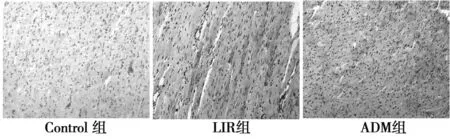
图1 各组大鼠心肌组织Caspase-3蛋白表达(DAB,×100)
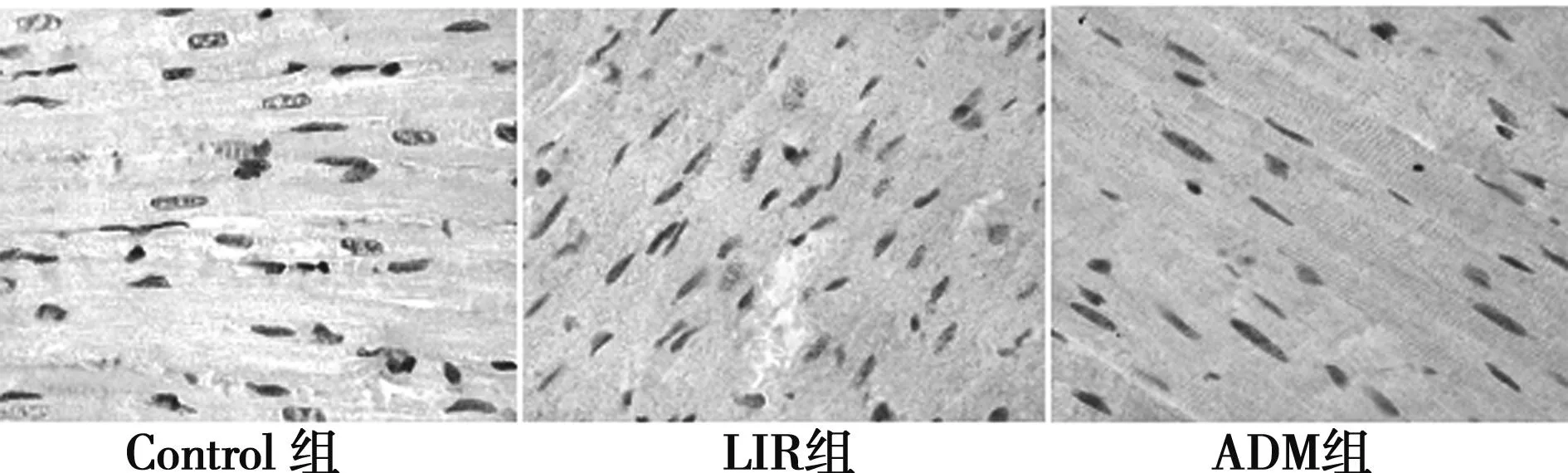
图2 各组大鼠心肌细胞凋亡(TUNEL,×400)
3讨论
LIR损伤是一种多因素综合作用的复杂病理过程,再灌注后大量自由基的产生和细胞凋亡是造成肢体以外远隔器官损伤发生的主要机制〔1〕。MDA是膜脂质过氧化的代谢终产物,其含量反映脂质过氧化程度并间接反映自由基的水平。SOD作为体内自由基的防御系统,能有效清除氧自由基。本研究表明肢体再灌注后大量氧自由基产生,造成膜脂过氧化,损伤生物膜,心肌酶漏出增多,与文献报道的结果相符〔4〕,氧化应激是LIR后器官损伤的重要形式。氧自由基的大量生成除直接引发组织损伤破坏之外也可能作为凋亡诱导的主要因素之一〔5〕。
研究已证实活性氧可诱导细胞凋亡〔6〕。活性氧参与核转录因子的活化,被激活后转位进入细胞核内,促进基因转录〔7〕;降低线粒体膜电位,调节信号转导通路,引起细胞凋亡〔8,9〕。凋亡是由Caspase家族介导呈级联化学反应的过程,调节机体细胞增殖与更新间的平衡,维持组织器官正常生理功能及细胞数量的稳定。凋亡是一种基本生理机制,Caspase-3是细胞凋亡发生的关键酶。但凋亡过度则可引起细胞损伤。本研究显示再灌注后心肌细胞Caspase-3蛋白表达增强,细胞发生凋亡样改变,凋亡细胞明显增多。推测肢体缺血再灌注后自由基大量产生并诱导心肌细胞凋亡加剧,二者共同参与了LIR后心肌损伤过程。
ADM是从人类嗜铬细胞瘤组织中提取的一种血管活性肽,具有多种生物学功能。研究发现〔10,11〕ADM可抑制细胞凋亡,ADM基因转染可减少过氧化物的产生和密度,增加心肌cGMP水平提高Bcl-2水平,可通过抑制氧化应激减少细胞凋亡。本实验观察到再灌注前给予ADM进行干预,血浆中心肌酶漏出减少,心肌组织MDA含量降低,SOD活性升高,心肌细胞Caspase-3蛋白表达下降,凋亡细胞减少,提示ADM能够通过降低心肌脂质过氧化反应,抑制氧化应激,从而减少心肌细胞凋亡。
综上,LIR后给予ADM可减轻心肌损伤,这一效应可能通过改善心肌氧化应激状态,抑制心肌细胞的过度凋亡有关。但具体细胞凋亡的相关蛋白及信号转导通路尚需探讨。
4参考文献
1成兰云,门秀丽,张连元,等. 内质网应激诱导的细胞凋亡在大鼠肢体缺血再灌注后肺损伤的作用及牛磺酸的影响〔J〕.中国病理生理杂志,2010;26(9):1776-80.
2李喆,覃晓,张江峰. 大鼠肢体缺血再灌注后不同时相血清TNF-α、IL-1β、IL-6水平变化及意义〔J〕.广西医学,2012;34(2):172-4.
3Okumura H,Nagaya N,Itoh T,etal. Adrenomedullin infusion attenuates myocardial ischemia/reperfusioninjury through the phosphatidyinositol3-kinase/Akt-dependent pathway〔J〕.Circulation,2004;109(2):242-8.
4赵利军,董淑云,段国贤,等. 氧化应激在大鼠肢体缺血/再灌注心肌损伤中的作用〔J〕.解放军医学杂志,2006;31(8):802-3.
5Edrees WK,Lau LL,Young IS,etal. The effect of lower limb ischemia-reperfusion on intestinal permeability and the systemic infammatory response〔J〕.Eur J Vasc Endovasc Sury,2003;25(4):330-5.
6Von Harsdorf R,Li PF,Dietz R,etal. Signaling pathways in reactive oxygen speeies-induced cardiomyocyte apoptosis〔J〕.Circulation,1999;99(22):2934-41.
7Yue TL,Ma XL,Wang XK,etal. Possible involvement of stress activated protein kinase signaling pathway and Fas receptor expression in prevention of ischemia/reperfusion-induced cardiomyocyte apoptosis by carvedilol〔J〕.Circ Res,1998;82(2):166-74.
8Wang CC,Liu TY,Cheng CH,etal. Involvement of the mitochondrion-dependent pathway and oxidative stress in the apoptosis of murine splenocytes induced by aveca nut extract〔J〕.Toxicol In Vitro,2009;23(5):840-7.
9潘奇正,张蕾,吴金义.线粒体氧化应激在心肌缺血性损伤中的作用〔J〕.中国老年学杂志,2011;31(16):3119-21.
10Kato K,Yin H,Agata J,etal.Adrenomedullin gene delivery attenuates myocardial infarction and apoptosis after ischemia and reperfusion〔J〕.Am J Physiol Heart Circ Physiol,2003;35(2):1024-6.
11蔡文钦,苏津自,俞登及.肾上腺髓质素基因转染改善缺氧培养骨髓间充质干细胞的抗凋亡能力〔J〕.中国组织工程研究与临床康复,2010;14(32):5913-7.
〔2013-12-13修回〕
(编辑安冉冉/曹梦园)

