siRNA干扰缺氧诱导因子2α对乳腺癌细胞侵袭能力的影响及相关机制
siRNA干扰缺氧诱导因子2α对乳腺癌细胞侵袭能力的影响及相关机制
李娜王洪兴张洁李永真千新来
(新乡医学院,河南新乡453003)
摘要〔〕目的探讨缺氧诱导因子(HIF)-2α siRNA对乳腺癌细胞MCF-7侵袭能力的影响及相关机制。 方法采用RNA干扰(RNAi)技术沉默已建立的缺氧细胞模型MCF-7细胞中HIF-2α的表达;RT-PCR方法检测转染后MCF-7细胞中HIF-2α mRNA的表达;采用划痕实验和侵袭实验探讨细胞侵袭能力的变化;采用Western印迹和RT-PCR方法检测基质金属蛋白酶(MMP)-2的表达。结果RNAi结果显示,缺氧+siRNA组HIF-2α mRNA的表达与单纯缺氧组相比均明显降低(P<0.05);转染后划痕实验结果显示,缺氧+siRNA组与单纯缺氧组相比细胞伤口愈合速度明显减慢。Transwell侵袭实验显示,缺氧+siRNA组与单纯缺氧组相比穿膜细胞数显著减少(P<0.05);Western印迹和RT-PCR结果显示,缺氧+siRNA组与单纯缺氧组相比,MMP-2蛋白及mRNA表达均下调(P<0.05)。结论HIF-2α siRNA抑制乳腺癌MCF-7细胞侵袭能力的机制之一可能与MMP-2基因的表达下调有关。
关键词〔〕缺氧诱导因子2α;基质金属蛋白酶-2;RNA干扰;乳腺癌;侵袭
中图分类号〔〕R73-37〔文献标识码〕A〔
基金项目:河南省科技厅科技攻关资助项目(112102310206);河南省教育厅自然科学资助项目(2011A310005);河南省高校青年骨干教师资助项目(2012GGJS-136)
第一作者:李娜(1977-),女,博士,副教授,主要从事恶性肿瘤分子病理学研究。
侵袭和转移是恶性肿瘤最显著的生物学特性,是恶性肿瘤顽固性、难治性和患者死亡的根本原因。有研究显示约90%的恶性肿瘤患者死于转移。目前,对于恶性肿瘤侵袭和转移的复杂机制仍不十分清楚。缺氧诱导因子(HIF)是低氧微环境中对肿瘤的发生发展起关键性作用的主要调节因子。近年来国内外学者的研究多集中于HIF-2α与肿瘤发生的关系,而关于HIF-2α与乳腺癌侵袭和转移的关系,目前国内外研究较少〔1,2〕。本研究以乳腺癌细胞MCF-7缺氧模型为研究对象,采用RNA干扰(RNAi)技术,探讨HIF-2α siRNA对乳腺癌细胞MCF-7侵袭能力的影响及相关机制。
1材料与方法
1.1 材料SuperScriptTMFirst-Strand Synthesis System for RT-PCR 试剂盒、lipofectamineTM2000均为Invitrogen公司产品。HIF-2α siRNA(2对)由广州市锐博生物科技有限公司合成,引物由上海生物工程公司合成。人低转移乳腺癌细胞系MCF-7购于中科院上海细胞库。
1.2 细胞培养与基因转染建立好的缺氧模型乳腺癌细胞在含有10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的完全培养基中37℃、5%CO2条件下培养,待细胞长至80%融合时,按Invitrogen公司lipofectamineTM2000说明书进行转染,设置亲本对照组、单纯缺氧组(加100 μmol/L CoCl2)、缺氧+siRNA 1组(序列:gcaaauguacccaaugauadTdT)、缺氧+siRNA 2组(序列:cagcaucuuugauagcagudTdT)、缺氧+无义siRNA组(序列:cagcaggguugauagcaugdTdT)、缺氧+转染试剂组,转染9 h后,更换新鲜完全培养基。
1.3 RT-PCR方法检测转染后各组细胞中HIF-2α mRNA的表达RNA提取过程按照Trizol RNA提取试剂盒说明书进行,体外逆转录合成cDNA的第一条链,以cDNA为模板,通过PCR方法扩增HIF-2α mRNA。引物序列上游:5′-tgaaaacgagtccgaagcc-3′,下游:5′-gtggctgacttgaggttga-3′;GAPDH上游:5′-attcatctctcctctccca-3′,下游:5′-gttggtggttggtactgt-3′,预期扩增片段大小分别为342 bp和580 bp。PCR反应条件:94℃×2 min,94℃×1 min、55℃×1 min和72℃延伸1 min,共30个循环;72℃延伸10 min。取5 μl用1.5%琼脂糖凝胶电泳,在凝胶成像仪上成像及测定分析。
1.4 划痕实验常规消化对数生长期的MCF-7亲本对照组细胞、单纯缺氧组细胞、缺氧+HIF-2α siRNA1组细胞、缺氧+HIF-2α siRNA2组细胞,计数后接种24孔板,37℃,5% CO2孵箱中常规培养,共5组,各组均设3个复孔。培养至80%汇合态时,在单层细胞上划一个“十”字,24 h更换新正常培养基,分别在0、6、12、24、48 h时间段观察并照相。
1.5 细胞体外侵袭力测定加含10%FBS的完全培养基于24孔板(600 μl/孔),取出小室放入24孔板中,膜上铺人工基底膜Matrigal胶。取单细胞悬液400 μl接种入小室,常规培养24 h。取出小室,结晶紫染色。通过倒置显微镜下机计数6个视野穿膜细胞数,每组设3个平行样本,共重复三次计算平均值。侵袭指数=实验组穿膜细胞数/对照组穿膜细胞数×100%;细胞侵袭力抑制率=(对照组穿膜细胞数-实验组穿膜细胞数)/对照组穿膜细胞数×100%。
1.6 Western印迹检测各组细胞中MMP-2蛋白的表达按照试剂盒说明书提取各组细胞质、细胞核蛋白,蛋白上清经SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移至硝酸纤维素膜,用含1%脱脂奶粉的TBST (Buffered Saline Tween-20)封闭30 min,加Ⅰ抗4℃孵育过夜,TBST洗涤;辣根过氧化物酶标记的Ⅱ抗室温孵育2 h,TBST洗涤,膜与化学发光底物孵育5 min,经X线片曝光、显影、定影。显色结果用软件Total Lab2.0进行灰度分析,并计算蛋白的相对表达水平。
1.7 MMP-2 mRNA表达RT-PCR方法检测各组细胞中MMP-2 mRNA的表达。

2结果
2.1 转染24 h后各组细胞中HIF-2α mRNA的表达HIF-2α mRNA的相对表达量在缺氧+siRNA1组(0.411±0.018)和缺氧+siRNA2组(0.385±0.001)分别与单纯缺氧组(0.737±0.007)、缺氧+无义siRNA组(0.652±0.009)和缺氧+转染试剂组相比显著降低(0.683±0.004,P<0.05)。缺氧+无义siRNA组和缺氧+转染试剂组分别与单纯缺氧组相比无显著差异(P>0.05)。单纯缺氧组较对照组(0.414±0.015)明显增加(P<0.05)。
2.2 划痕实验结果缺氧+HIF-2α siRNA1组和缺氧+ HIF-2α siRNA2组细胞伤口愈合速度明显慢于单纯缺氧组细胞,见图1。
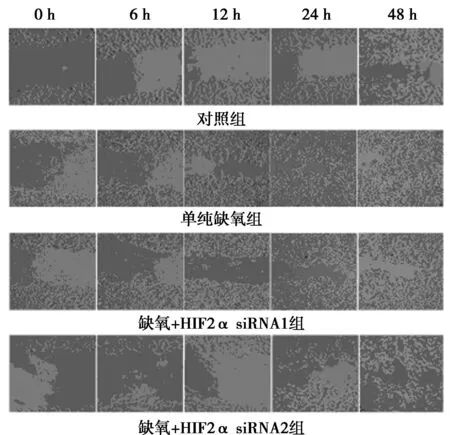
图1 划痕实验结果(×100)
2.3 Boyden-chamber侵袭实验结果缺氧+HIF-2α siRNA1组和缺氧+HIF-2α siRNA2组与单纯缺氧组相比穿过小室底膜的细胞数显著减少(P<0.05),见图2。

图2 Boyden-chamber侵袭实验结果
2.4 转染24 h后各组细胞中MMP-2 蛋白和mRNA的表达缺氧+HIF-2α siRNA1组和缺氧+HIF-2α siRNA2组与单纯缺氧组相比,MMP-2蛋白和mRNA表达均下调(P<0.05);缺氧+ HIF-2α siRNA1组、缺氧+ HIF-2α siRNA2组与对照组相比,MMP-2基因表达无明显变化(P>0.05),见表1,图3。
表1 转染24 h后各组细胞中MMP-2
与单纯缺氧组比较:1)P<0.05

1:对照组;2:单纯缺氧组;3:缺氧+HIF-2α siRNA1组;4:缺氧+HIF-2α siRNA2组 图3 转染24 h后各组细胞中MMP-2 mRNA和 蛋白的表达
3讨论
肿瘤发生和发展过程中的侵袭性和转移性是影响其预后的重要因素,目前肿瘤转移抑制基因在肿瘤侵袭和转移中的作用受到了普遍关注。HIF-2α是1997年由Tian等克隆出的HIF家族新成员,定位于人染色体2p16-21,是由HIF-2α和HIF-1β两种亚基组成的异源二聚体〔3〕;研究证实,除巨噬细胞外,HIF-2α蛋白在正常组织中表达较低或无表达,但可在多种肿瘤组织或细胞中表达,不同的肿瘤中其表达程度不一,并调节其生物学行为。最近有研究显示〔4,5〕,在肾癌、滋养细胞肿瘤中应用RNAi技术和反义寡核苷酸技术沉默HIF-2α表达后细胞增殖能力变化不明显,但细胞侵袭、转移能力明显降低。在乳腺浸润性导管癌组织中HIF-2α呈高表达,并且其表达与病理分期,组织内微血管的密度,P53等蛋白的表达及患者的存活年限有显著关系,这提示在乳腺癌的发生发展过程中,HIF-2α可能通过促进新生血管形成而起作用〔6〕。这些发现使得HIF-2α有可能成为乳腺癌治疗的一个切入点。
本研究结果显示,HIF-2α siRNA能够明显抑制MCF-7细
胞中HIF-2α的表达,说明细胞转染成功,并与Zimmer等〔7〕通过运用靶向HIF-2α的shRNA取得了实验性肿瘤抑制的研究结果相符。本文结果表明HIF-2α能够促进乳腺癌细胞MCF-7的侵袭和转移能力,并且HIF-2α siRNA 能有效抑制MCF-7细胞侵袭能力。Petrella等〔8〕在肾细胞癌的研究中亦证实了缺氧诱导因子2α可通过上调MTI-MMP的表达而增强细胞的体外侵袭能力。
MMP-2又称Ⅳ型胶原酶或明胶酶,作为MMPs家族中降解细胞外基质和基底膜中Ⅳ型胶原三螺旋结构的关键酶,在恶性肿瘤的侵袭转移及间质血管生成过程中起重要作用〔9〕。本研究结果提示HIF-2α促进的侵袭﹑转移可能与MMP-2表达上调有关。
综上,本研究采用RNAi技术初步证实了HIF-2α siRNA可能通过下调MMP-2的表达从而抑制MCF-7细胞侵袭和转移能力,该研究结果为HIF-2α作为乳腺癌基因治疗靶点的选择提供了理论和实验依据,本课题组拟对HIF-2α与MMP-2的作用关系进行深入研究。
4参考文献
1Majmundar AJ,Wong WJ,Simon MC,etal.Hypoxia inducible factors and the response to hypoxic stress〔J〕.Mol Cell,2010;40(2):294-309.
2Jolly M,Michele MH,Dhruv KP,etal. HIF-2α deletion promotes Kras-driven lung tumor development〔J〕.Proc Natl Acad Sci U S A,2010;107(32):14182-7.
3Weijun L,Hong X,David TE,etal.Hypoxia and cell cycle regulation of the von Hippel-Lindau tumor suppressor〔J〕.Oncogene,2011;30(1):21-31.
4Sandlund J,Ljungberg B,Wikström P,etal. Hypoxia-inducible factor-2 alpha mRNA expression in human renal cell carcinoma〔J〕.Acta Oncol,2009;48(6):909-14.
5Eliza SM,Yula YM,Seth G. Role of hypoxia-inducible transcription factors 1α and 2α in the regulation of plasminogen activator inhibitor-1 expression in a human trophoblast cell line〔J〕.Placenta,2007;28(10):1010-2.
6Mardilovich K,Shaw LM. Hypoxia regulates insulin receptor substrate-2 expression to promote breast carcinoma cell survival and invasion〔J〕.Cancer Res,2009;69(23):8894-901.
7Zimmer M,Doucette D,Siddiqui N,etal. Inhibition of hypoxia-inducible factor is sufficient for growth suppression of VHL-/-tumors〔J〕.Mole Cancer Res,2004;2(2):89-95.
8Petrella BL,Lohi J,Brinckerhoff CE. Identification of membrane type-1 matrix metalloproteinase as a target of hypoxia-inducible factor-2 alpha in vonHippel-Lindau renal cell carcinoma〔J〕.Oncogene,2005;24:1043-52.
9Joelle H,Lisa JW,Mita M,etal. Up-regulation of MMP-2 by HMGA1 promotes transformation in undifferentiated,large cell lung cancer〔J〕.Mol Cancer Res,2009;7(11):1803-12.
〔2014-01-28修回〕
(编辑安冉冉/曹梦园)

