灯盏乙素对局灶性脑缺血再灌注损伤大鼠缺血侧脑组织热休克蛋白70表达的影响
灯盏乙素对局灶性脑缺血再灌注损伤大鼠缺血侧脑组织热休克蛋白70表达的影响
王龙梓
(淄博职业学院药学系,山东淄博255314)
摘要〔〕目的观察灯盏乙素对局灶性脑缺血再灌注损伤大鼠缺血侧脑组织热休克蛋白(HSP)70表达的影响。方法采用大脑中动脉栓线阻断法制备大鼠局灶性脑缺血再灌注损伤模型,免疫组化和RT-PCR检测灯盏乙素对大鼠缺血损伤脑组织HSP70蛋白和mRNA表达的影响。结果灯盏乙素可明显增强缺血再灌注损伤大鼠缺血侧脑组织HSP70蛋白和mRNA的表达。结论灯盏乙素可明显增强大鼠局灶性脑缺血再灌注损伤脑组织HSP的表达,这可能与其脑保护作用有关。
关键词〔〕灯盏乙素;脑缺血;热休克蛋白(HSP)70;HSP70 mRNA
中图分类号〔〕R749〔文献标识码〕A〔
第一作者:王龙梓(1976-),男,硕士,讲师,主要从事心脑血管药理学研究。
灯盏花素是从灯盏细辛中提取的黄酮类成分,灯盏乙素为灯盏花素的主要药效成分。灯盏乙素和灯盏花素的脑保护作用机制复杂,至今尚不清楚。热休克蛋白(HSP)70为急性脑损伤后脑组织表达的一种应激保护蛋白,可抑制神经细胞凋亡和死亡,维持神经细胞功能,具有多种脑保护作用。刘萍等〔1〕发现脑保护药黄芩苷可使局灶性脑缺血再灌注损伤大鼠脑组织海马部位HSP70表达明显增加。灯盏乙素又名野黄芩苷,与黄芩苷结构相似(黄芩苷4′位引入一个羟基即为灯盏乙素,见图1),但其治疗用药对脑缺血后HSP70表达的影响未见文献报道。本研究拟应用大脑中动脉栓线阻断法构建大鼠局灶性脑缺血再灌注损伤模型,检测灯盏乙素治疗给药对缺血脑组织HSP70蛋白和mRNA表达的影响。
1材料与方法
1.1药品与试剂灯盏乙素,云南玉溪万方天然药物有限公司,批号:020509;尼莫地平,山东健康药业有限公司,批号:0401402-H;多聚甲醛:浙江菱湖振兴助剂厂,批号:960508。兔抗大鼠HSP70多克隆抗体:美国Newmark公司产品,福州迈新生物技术开发有限公司提供。即用型第二代免疫组化ElivisionTMplus试剂盒(Kit-9901)、DAB显色试剂盒:福州迈新生物技术开发有限公司。Trizol:上海生工生物工程技术服务有限公司产品。

图1 灯盏乙素与黄芩苷分子式
1.2仪器C-5050ZOOM数码照相机:日本OLYMPUS公司。医学形态学图像分析系统:江苏捷达科技发展有限公司。MiniCyclerTM 扩增仪:美国PERKIN ELMER(PE)公司。DY-600 中压电泳仪:美国BECTON DICKINSON(BD)公司。
1.3动物分组与模型制备Wistar大鼠,健康雄性,体重270~300 g,山东大学实验动物中心提供,实验动物合格证号:SCXK(鲁)20030004。随机分为6组:即假手术组,缺血再灌注损伤组(IR组),尼莫地平组(尼莫地平0.4 mg·kg),灯盏乙素低、中、高剂量组(灯盏乙素12.5 、25 和50 mg/kg)。实验动物经水合氯醛300 mg/kg腹腔注射麻醉后,采用大脑中动脉内栓线阻断法(CAO)制备大鼠左侧大脑中动脉阻塞模型,1 h后拔线实现再灌注。按上述剂量分别于缺血后和再灌注后立即静脉给药1次(每次给半量)。
1.4逆转录聚合酶链反应检测HSP70 mRNA的表达脑缺血1 h再灌注24 h后处死大鼠,取大鼠缺血侧海马区脑组织50 mg,应用Trizol法进行组织总RNA的提取,冰上逆转录合成cDNA,然后进行PCR扩增反应。以β-actin为内参照,引物参照文献〔2〕,由上海生工生物工程技术服务有限公司合成。以目的基因和内参照(β-actin)基因谱带的积分光密度比值表示目的基因的相对表达水平。
1.5免疫组织化学法检测HSP70蛋白表达大鼠脑缺血1 h再灌注24 h麻醉后仰卧固定,快速剪开腹腔和胸腔前壁,清晰暴露出心脏和升主动脉,用连有输液管的预处理为钝圆的针头由心尖处插入左心室,并通过心腔插入升主动脉,应用4℃ pH=7.4的4%多聚甲醛进行快速全身灌流固定。灌流结束后断头取脑,常规梯度脱水,透明,石蜡包埋。取缺血侧背侧海马常规4 μm连续冠状切片。切片进行HSP70蛋白免疫组织化学检测。以Elivision两步法染色,参照试剂盒说明书进行。胞质或胞核内有棕黄色颗粒者为阳性细胞。利用医学形态学图像分析系统测定海马CA1区阳性染色的平均光密度与阳性细胞数,并计算大鼠神经细胞阳性表达指数(PEI):PEI=平均光密度×阳性细胞百分率。
1.6统计学处理采用SPSS11.0软件进行单因素方差分析。
2结果
2.1灯盏乙素对大鼠缺血侧脑组织HSP70 mRNA表达的影响假手术组HSP70 mRNA表达弱(0.27±0.03),IR组HSP70 mRNA表达明显增加(0.71±0.13,P<0.001);低、中、高剂量灯盏乙素组和尼莫地平组HSP70 mRNA表达进一步升高,均明显高于IR组(0.90±0.03、0.98±0.05、0.95±0.07、0.81±0.97,P<0.001)。见图2。
2.2灯盏乙素对大鼠缺血侧脑组织HSP70蛋白表达的影响假手术组棕黄色HSP70蛋白表达阳性细胞少见,且胞质着色淡(PEI为3.87%±2.51%)。IR组缺血侧脑组织可见棕黄色HSP70蛋白表达阳性细胞,主要分布于皮层、海马及纹状体等区域,其中海马区表达最强(PEI为19.14%±3.14%)。低、中、高剂量灯盏乙素组及尼莫地平组棕黄色HSP70蛋白表达进一步增强,海马区阳性细胞密集分布,且阳性细胞质着色深(PEI分别为31.90%±7.03%、37.97%±4.65%、50.40%±4.94%、30.76%±4.31%)。各用药组HSP70蛋白表达在模型组基础上进一步明显升高(P<0.001)。见图3。
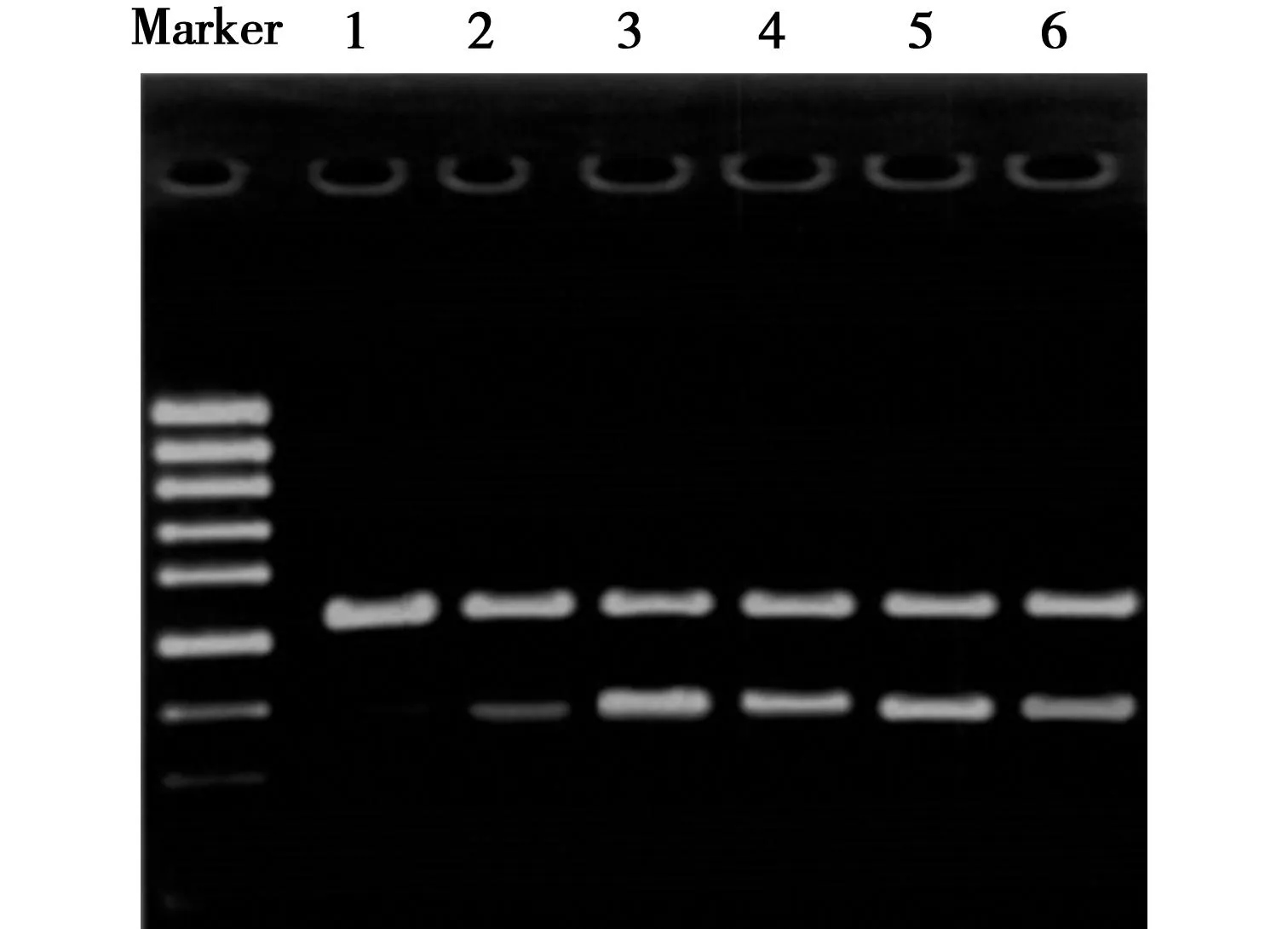
1:假手术组,2:IR组,3:灯盏乙素低剂量组,4:灯盏乙素中剂量组,5:灯盏乙素高剂量组,6:尼莫地平组 图2 灯盏乙素对大鼠脑缺血侧海马CA1区 HSP70 mRNA表达的影响
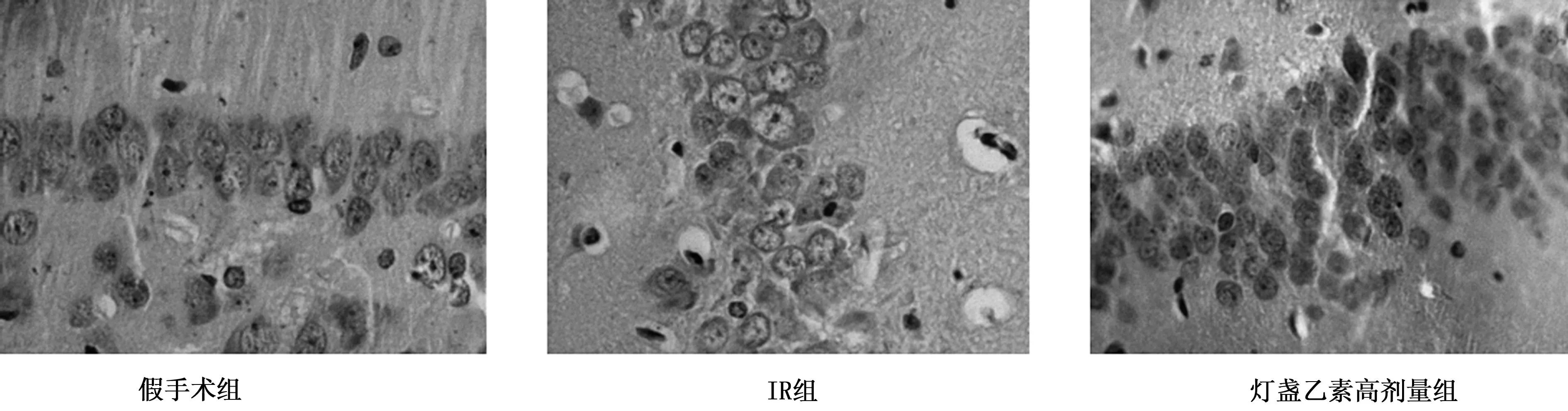
图3 免疫组织化学法检测大鼠脑缺血侧海马CA1区HSP70蛋白的表达(DAB,×400)
3讨论
HSP被称为分子伴侣,参与蛋白质的正常折叠,使其成为功能蛋白质。HSP中以热休克蛋白70(HSP70)进化最为保守,在大多数生物中含量高。正常情况下HSP70 mRNA在细胞内稳定表达,但很快降解,故HSP70 mRNA在正常细胞表达水平低,HSP70合成较少。脑缺血可诱导HSP70 mRNA的表达,组织学检查显示预缺血能够显著减少大鼠全脑缺血模型脑缺血敏感区海马CA1区神经元死亡数量。研究显示, 预缺血诱导海马CA1区神经元内蛋白伴侣HSP70 在再灌注后24 h表达,提示预缺血可能通过诱导蛋白伴侣HSP70的表达减少再缺血引起的神经元死亡〔3〕。为了使外源性的HSP70发挥作用,有人将HSP70与分子转运体重组,制备Fv-HSP70,用于脑缺血再灌注损伤SD大鼠,具有明显脑保护作用〔4〕。
HSP70的脑保护作用机制主要是其分子伴侣作用,多基于HSP70基因敲除,通过基因转导或热应激制备的基因过表达模型。HSP70可通过抑制氧自由基,抑制细胞凋亡等机制产生脑保护作用,HSP70也调节炎症通路。研究显示,几种药物能抑制HSP90,诱导HSP70的表达,影响神经系统炎症反应来保护脑率中和脑损伤〔5〕。
多种化学药物可促进脑缺血损伤后HSP70的表达。抗癫痫药丙戊酸具有神经保护作用。有学者制备大鼠短暂性全脑缺血再灌注损伤模型,给予丙戊酸治疗,全脑缺血再灌注7 h后指标检测发现,丙戊酸可明显改善大鼠认知功能缺损,明显增加大鼠全脑缺血再灌注后大脑海马CA1区神经元密度,而诱导大鼠大脑海马组织HSP70表达是上述脑保护作用的重要机制〔6〕。去卵巢大鼠慢性脑组织灌注不足14 d,缺血敏感区海马组织神经细胞数量减少,丙二醛(MDA)增加,HSP70表达增加,超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH)活性降低。而褪黑素应用后,与缺血模型组相比,SOD,GSH活性水平恢复,诱导HSP70表达增加,提示褪黑素可有助于血管性痴呆和脑灌注不足的治疗〔7〕。
关于植物药活性成分促进HSP70表达的研究不少学者关注黄芩苷。将沙鼠双侧颈动脉阻断5 min,阻断时立即腹腔注射黄芩苷200 mg/kg,再灌注7 d后,结果显示黄芩苷明显改善神经功能缺损,明显增加增加海马部位HSP70表达,提示黄芩苷可通过增加HSP70的表达对沙鼠全脑缺血产生保护作用〔8〕。刘萍等〔1〕将黄芩苷用于局灶性脑缺血1 h,再灌注24 h大鼠,发现脑组织海马部位HSP70表达明显增加。但黄芩苷剂量需用至100 mg/kg,脑组织海马部位HSP70表达方明显强于模型组。本研究提示灯盏乙素促进缺血脑组织作用HSP70表达的作用可能强于黄芩苷。所以本研究认为,需要进一步深入研究HSP70表达保护脑缺血损伤的机制,进一步研究灯盏乙素等天然药物促进脑缺血再灌注损伤后HSP70表达强度不同的原因,从而为找到理想的脑缺血损伤保护药提供思路。
4参考文献
1刘萍,王菊英,李倩,等.黄芩苷对大鼠脑缺血再灌注损伤后海马神经元HSP70表达的影响〔J〕.药学学报,2006;41(7):619-24.
2Gress TM.Differentice expression of heat shock proteins in ancretic carcinoma〔J〕.Cancer Res,1994;54(2):547-51.
3Ge PF,Luo TF,Zhang JZ,etal.Ischemic preconditioning induces chaperone hsp70 expression and inhibits protein aggregation in the CA1 neurons of rats〔J〕.Neurosci Bull,2008;24(5):288-96.
4Zhan XH,Ander BP,Liao IH,etal.Recombinant Fv-Hsp70 protein mediates neuroprotection after focal cerebral ischemia in rats〔J〕.Stroke,2010;41(3):538-43.
5Kim N,Kim JY,Yenari MA.Anti-inflammatory properties and pharmacological induction of Hsp70 after brain injury〔J〕.Inflammopharmacology,2012;20(3):177-85.
6Xuan A,Long D,Li J,etal.Neuroprotective effects of valproic acid following transient global ischemia in rats〔J〕.Life Sci,2012;90(11-12):463-8.
7Ozacmak VH,Barut F,Ozacmak HS.Melatonin provides neuroprotection by reducing oxidative stress and HSP70 expression during chronic cerebral hypoperfusion in ovariectomized rats〔J〕.J Pineal Res,2009;47(2):156-63.
8Dai J,Chen L,Qiu YM,etal.Activations of GABAergic signaling,HSP70 and MAPK cascades are involved in baicalin's neuroprotection against gerbil global ischemia/reperfusion injury〔J〕.Brain Res Bull,2012;90C:1-9.
〔2013-11-17修回〕
(编辑赵慧玲/曹梦园)

