瑞舒伐他汀对大鼠心肌梗死后细胞凋亡及对线粒体融合素2表达的影响
瑞舒伐他汀对大鼠心肌梗死后细胞凋亡及对线粒体融合素2表达的影响
周炜陈玲周逸陈曼华
(武汉市中心医院心血管内科,湖北武汉430014)
摘要〔〕目的研究不同剂量瑞舒伐他汀对大鼠心肌梗死后细胞凋亡及线粒体融合素2蛋白表达的影响。 方法选取雄性SD大鼠48只,随机分为假手术组(Sham),心肌梗死组(MI),瑞舒伐他汀1组(Statin 1)和瑞舒伐他汀2组(Statin 2),每组12只。Statin 1组术前7 d开始每日给予瑞舒伐他汀5 mg/kg灌胃,Statin 2组药物剂量为每日20 mg/kg,MI组以蒸馏水灌胃,随后制备心肌梗死模型。术后24 h采用脱氧核苷酸末端转移酶介导的缺口末端标记法(TUNEL)检测细胞凋亡,免疫印迹法检测磷酸化蛋白激酶B(p-Akt)的表达,免疫组化法检测线粒体融合素2的表达。 结果与Sham组相比,MI组及Statin 1组、2组心肌细胞凋亡显著增加,p-Akt表达显著下降,线粒体融合素2表达显著增加(P<0.01);与MI组相比,Statin 1组、2组心肌细胞凋亡和线粒体融合素2表达均显著降低(P<0.05),而p-Akt表达显著增高(P<0.05),且Statin 2组较1组变化更显著(P<0.05)。结论瑞舒伐他汀可抑制大鼠心肌梗死后的细胞凋亡,其作用可能与抑制线粒体融合素2表达有关。
关键词〔〕瑞舒伐他汀;心肌梗死;凋亡;线粒体融合素2基因
中图分类号〔〕R541.4〔文献标识码〕A〔
基金项目:武汉市卫生局临床医学科研项目(WX12B03);武汉市科技局关键技术攻关计划(2013060602010256)
通讯作者:陈曼华(1962-),女,主任医师,主要从事冠心病的介入治疗研究。
第一作者:周炜(1979-),男,博士,主治医师,主要从事动脉粥样硬化的发病机制及基因治疗研究。
心肌细胞凋亡是引起心肌梗死后心功能不全、心室重塑及心律失常的重要原因〔1〕。目前发现,他汀类药物可通过原癌基因Ras法尼基化的相关机制诱导磷脂酰肌醇-3激酶/蛋白激酶B(PI3K/Akt)信号通路激活,发挥其调节细胞增殖和凋亡、抗动脉粥样硬化、心肌保护等调脂外作用〔2,3〕。线粒体融合素2(Mfn2)是利用差异显示法从自发性高血压大鼠体内克隆获得的基因,其表达产物可负向调控PI3K/Akt信号通路,诱导细胞凋亡〔4〕。目前关于他汀类药物对Mfn2的调节作用尚不明确。因此,本实验建立大鼠急性心肌梗死模型,观察瑞舒伐他汀对心肌细胞凋亡及Mfn2表达的影响,进一步阐明其抗心肌细胞凋亡的机制。
1材料与方法
1.1主要仪器和试剂小动物呼吸机(HX-300S型,成都泰盟科技有限公司),倒置相差显微镜(日本Olympus公司),高清晰度数字视屏显微镜(日本Nikon公司);凋亡检测(TUNEL)试剂盒(德国Roche公司);Mfn2抗体(英国Abcam公司),p-Akt抗体、Akt抗体、α-肌动蛋白(α-actin)抗体,辣根过氧化物酶标记的二抗(美国Cell signaling公司)。免疫组化试剂盒、二氨基联苯胺(DAB)显色液(武汉博士德公司);瑞舒伐他汀(阿斯利康制药有限公司)。其他的试剂采用国产分析纯试剂。
1.2实验分组选取健康雄性SD大鼠48只,体重(250±30)g,购自华中科技大学同济医学院实验动物中心。实验分为假手术组(Sham);心肌梗死组(MI);瑞舒伐他汀1组(Statin 1);瑞舒伐他汀2组(Statin 2),共4组,每组12只。Statin 1组术前7 d开始每日给予瑞舒伐他汀5 mg/kg灌胃,Statin 2组药物剂量为20 mg/kg,剂量的选择参考文献〔5〕。Sham组及MI组予等量蒸馏水灌胃。
1.3建立大鼠MI模型参照文献进行〔1〕。3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉大鼠,小动物呼吸机鼻面罩辅助通气。调整呼吸机参数:潮气量6~8 ml/kg,呼吸频率70~80次/min,吸呼比1∶2。开胸后分离胸膜、心包,在左心耳下缘、肺动脉圆锥水平结扎左前降支。造模成功的标准为:①心电图标准Ⅱ导联ST段呈弓背向上型抬高,②结扎动脉远端心肌出现苍白。假手术组开胸后于左前降支下穿线,不结扎。各组存活至术后24 h的动物数量分别为Sham组(12只),MI组(9只),Statin 1组(10只),Statin 2组(10只)。处死大鼠后取心脏标本,4%多聚甲醛固定24 h,梯度酒精脱水,石蜡包埋后切片。
1.4缺口末端标记法(TUNEL)染色检测心肌细胞凋亡按试剂盒操作说明染色,以细胞核染成棕黄色为阳性,每张切片在梗死边缘区域(Sham组在左室前壁)随机取5个高倍镜视野,记录阳性细胞数,计算凋亡指数(AI),AI(%)=凋亡细胞核数/总细胞核数×100%,每张切片取5个视野求均值。
1.5免疫组化法检测Mfn2蛋白表达按试剂盒说明操作检测Mfn2蛋白表达。每张切片在梗死边缘区域(Sham组在左室前壁)随机选取5个高倍镜视野,虚拟显微镜拍摄图像,使用Image pro-Plus图像分析软件测定Mfn2蛋白表达平均光密度值(MOD)。
1.6免疫印迹法检测p-Akt的表达提取组织总蛋白,测定蛋白浓度。蛋白上样量为50 μg,经电泳、转膜、封闭后,将膜在一抗(抗β-actin、抗p-Akt、抗Akt)中4℃孵育过夜。缓冲液洗脱后放入辣根过氧化物酶标记的二抗中室温孵育2 h后进行检测。Quantity One软件测定条带灰度值,进行半定量分析。
2结果
2.1各组心肌细胞凋亡的分布经TUNEL染色及苏木素复染后凋亡细胞核呈棕黄色,正常细胞核呈蓝色。Sham组心肌细胞未见明显凋亡;与MI组比较,瑞舒伐他汀1组、2组AI均显著下降(P<0.05),且瑞舒伐他汀2组较1组AI降低更显著(P<0.05),见图1和表1。
2.2各组心肌组织p-Akt的表达及灰度分析免疫印迹法显示,与Sham组比较,MI组及Statin1组、2组心肌组织中p-Akt蛋白表达均显著降低(P<0.01);与MI组比较,Statin1组、2组p-Akt表达显著增加(P<0.05),且Statin2组较1组表达更高(P<0.05),见图2和表1。
2.3各组心肌组织Mfn2蛋白的表达及光密度分析Sham组未见明显梗死区域,Mfn2蛋白少量表达;与Sham组比较,MI组及Statin1组、2组在心肌梗死边缘区域Mfn2蛋白表达均显著增加(P<0.01);与MI组比较,Statin1组、2组Mfn2表达显著降低(P<0.05),且Statin2组较1组表达更低(P<0.05),见图3和表1。

图1 各组TUNEL染色结果(×400)
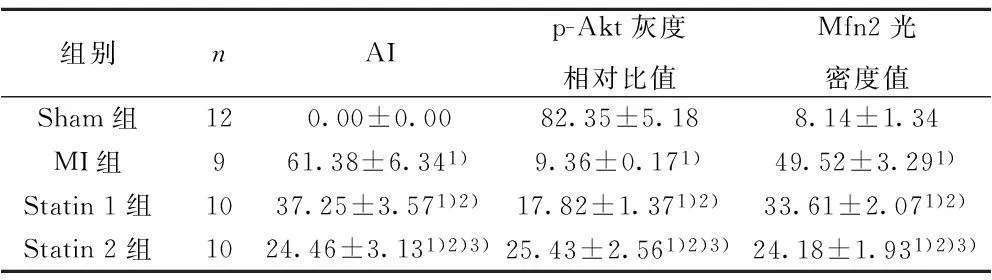
组别nAIp-Akt灰度相对比值Mfn2光密度值Sham组120.00±0.0082.35±5.188.14±1.34MI组961.38±6.341)9.36±0.171)49.52±3.291)Statin1组1037.25±3.571)2)17.82±1.371)2)33.61±2.071)2)Statin2组1024.46±3.131)2)3)25.43±2.561)2)3)24.18±1.931)2)3)
与Sham组比较:1)P<0.01,与MI组比较:2)P<0.05,与Statin 1组比较:3)P<0.05

A.Sham组;B.MI组;C.Statin 1组;D.Statin 2组 图2 各组免疫印迹法检测结果

图3 各组免疫组化染色结果(DAB,×200)
3讨论
心肌细胞凋亡是急性心肌梗死早期细胞丢失的重要形式,并参与慢性心力衰竭的病理生理过程。急性心肌梗死发生时,缺血、缺氧以及活性氧(ROS)产生增加等多种因素激活促凋亡基因,通过调控相关的信号通路诱导心肌细胞凋亡。其中,Ras-PI3K/Akt信号通路是促发心肌细胞凋亡的关键路径〔6〕。因此,通过药物或基因治疗干预凋亡相关基因的表达,调控细胞内信号传导通路,抑制细胞凋亡,有可能成为防治心肌梗死的有效手段。
他汀类药物是目前临床应用最广泛的调脂药物,其具有多重调脂以外的作用。研究发现,他汀类药物通过抑制甲羟戊酸合成,使其下游的焦磷酸法尼酯和焦磷酸牛儿基牛儿酯减少,阻碍小三磷酸鸟苷结合蛋白Ras、Rho、Rac等异戊二烯化,影响Ras-PI3K/Akt及丝裂原活化的蛋白激酶信号通路、肾素-血管紧张素系统和过氧化物酶增殖物激活受体的活性,增加一氧化氮水平,减少ROS产生,因此具有保护血管内皮细胞、抗氧化应激及抗炎、抗心肌肥厚等调脂外作用〔2,3,7〕。本研究发现,术前7 d开始每日给予瑞舒伐他汀可显著抑制大鼠急性心肌梗死后的细胞凋亡,且具有一定的剂量依赖性。
Mfn2是一种线粒体外膜蛋白,广泛分布于人体的心、肾、脑、肺、肝等不同组织中,尤以心脏和肾最为丰富,对线粒体融合、线粒体形态及功能的调节有重要作用〔4〕。Mfn2也是细胞信号传导通路中一个新的调控点,对细胞增殖和凋亡有重要的调节作用。该基因是原癌基因Ras的直接负调控因子,能够与其相互作用,阻滞Ras-PI3K/Akt信号通路,显著抑制Akt的磷酸化水平,进而减少Bcl-2蛋白表达,增加Bax蛋白表达,通过线粒体途径诱导细胞凋亡,其作用与线粒体融合无关〔8,9〕。有研究发现,氧化应激诱导心肌细胞凋亡时Mfn2表达上调,过表达Mfn2通过上述通路诱导心肌细胞凋亡〔10〕。本研究发现,大鼠发生急性心肌梗死后,局部组织Mfn2表达显著增高,p-Akt表达显著降低,表明Akt磷酸化受到抑制,提示缺血缺氧损伤激活了Mfn2的表达,从而促发心肌细胞凋亡增加。而瑞舒伐他汀干预则可显著下调Mfn2表达,进而促进Akt磷酸化,抑制心肌细胞凋亡,作用呈一定的剂量依赖性。
本文研究结果显示,Mfn2基因可能是大鼠心肌梗死过程中一个重要的促凋亡基因,参与瑞舒伐他汀抑制心肌梗死后细胞凋亡的过程,也是瑞舒伐他汀发挥其心肌保护作用的一个重要靶基因,其具体机制有待进一步深入研究。
4参考文献
1Bhushan S,Kondo K,Predmore BL,etal.Selective β2-adrenoreceptor stimulation attenuates myocardial cell death and preserves cardiac function after ischemia-reperfusion injury〔J〕.Arterioscler Thromb Vasc Biol,2012;32(8):1865-74.
2Tanaka S,Fukumoto Y,Nochioka K,etal.Statins exert the pleiotropic effects through small GTP-binding protein dissociation stimulator upregulation with a resultant Rac1 degradation〔J〕.Arterioscler Thromb Vasc Biol,2013;33(7):1591-600.
3Song XJ,Yang CY,Liu B,etal.Atorvastatin inhibits myocardial cell apoptosis in a rat model with post-myocardial infarction heart failure by downregulating ER stress response〔J〕.Int J Med Sci,2011;8(7):564-72.
4Zhou W,Chen KH,Guo XM,etal.Mutation of the protein kinase A phosphorylation site influences the anti-proliferative activity of mitofusin 2〔J〕.Atherosclerosis,2010;211(1):216-23.
5Preusch MR,Vanakaris A,Bea F,etal.Rosuvastatin reduces neointima formation in a rat model of balloon injury〔J〕.Eur J Med Res,2010;15(11):461-7.
6Ishihara Y,Shimamoto N.Sulfaphenazole attenuates myocardial cell apoptosis accompanied with cardiac ischemia-reperfusion by suppressing the expression of BimEL and Noxa〔J〕.J Pharmacol Sci,2012;119(3):251-9.
7Davignon J,Mabile L.Mechanisms of action of statins and their pleiotropic effects〔J〕.Ann Endocrinol (Paris),2001;62(1 Pt 2):101-12.
8Guo XM,Chen KH,Guo YH,etal.Mitofusin 2 triggers vascular smooth muscle cell apoptosis via mitochondrial death pathway〔J〕.Circulation Res,2007;101(8):1113-22.
9周炜,曹文静,陈莉莉,等.去除蛋白激酶A磷酸化位点的线粒体融合素2基因对血管平滑肌细胞凋亡的影响〔J〕.中国动脉硬化杂志,2012;20(11):968-71.
10Shen T,Zheng M,Cao CM,etal.Mitofusin-2 is a major determinant of oxidative stress-mediated heart muscle cell apoptosis〔J〕.J Biol Chem,2007;282(8):23354-61.
〔2013-12-05修回〕
(编辑赵慧玲/曹梦园)

