胶原三维培养下卵巢癌细胞生物学性状研究
蔡国徽,韩云竹,唐斌,宋鸿
(遵义医学院微生物学教研室,贵州遵义563099)
胶原三维培养下卵巢癌细胞生物学性状研究
蔡国徽,韩云竹,唐斌,宋鸿
(遵义医学院微生物学教研室,贵州遵义563099)
目的建立卵巢癌HO-8910PM细胞胶原Ⅰ三维培养模型,对胶原Ⅰ基质中卵巢癌HO-8910PM细胞的形态、活力及功能进行研究,为体外卵巢癌的研究提供参考。方法透射电镜表征胶原Ⅰ结构特点,以胶原Ⅰ为支架材料,建立卵巢癌细胞体外三维培养模型;倒置显微镜观察卵巢癌细胞生长形态及增殖情况;钙黄绿素-AM染色观察胶原Ⅰ基质中卵巢癌细胞的活力;ELISA检测二维培养及三维培养中卵巢癌细胞血管内皮生长因子-A(VEGF-A)、表皮生长因子(EGF)和胰岛素样生长因子-1(IGF-1)的分泌。结果透射电镜下可见胶原Ⅰ呈交联网络状结构,胶原Ⅰ基质中卵巢癌细胞集聚成不规则团状,细胞在胶原Ⅰ中的活力较好,细胞与基质具有良好的生物相容性;与二维培养细胞比较,三维培养体系中VEGF-A、EGF和IGF-1的分泌量均较高,差异有统计学意义(P<0.05或0.01)。结论胶原Ⅰ具有良好的结构与性能,适宜于卵巢癌细胞体外三维培养,并能较好地维持卵巢癌细胞的形态和功能。
卵巢肿瘤;培养技术;胶原Ⅰ型;血管内皮生长因子类;表皮生长因子
在全球范围内,卵巢癌的发病率在女性恶性肿瘤中占3%~4%,但病死率却居女性生殖系统恶性肿瘤的第1位[1-2]。因此,研究卵巢癌发生发展机制,对于提高卵巢癌患者临床治疗效果尤为重要。目前,卵巢癌的体外研究大多采用二维细胞培养模式,但由于培养装置常为玻璃或塑料的二维平面,无法模拟具有空间结构的细胞外基质(ECM)与细胞之间的相互作用。有研究发现,二维细胞培养使细胞处于二维平面上,常导致细胞部分生物学特性的改变,甚至一些关键的细胞表型及功能缺失[3]。因此,二维培养模型中的细胞生物学过程并不能反映细胞在体内的真实行为,更无法体现三维微环境中多种信号对细胞的调节作用。动物模型虽可以模拟体内肿瘤细胞生长的微环境,但难以进行大规模的分子水平研究。现有研究表明,三维培养的肺癌细胞间相互连接紧密,可较好地实现细胞间信号传导,细胞在分化程度、超微结构等方面也与体内细胞更为接近[4]。三维细胞培养体系弥补了二维培养与动物实验的不足,将细胞、人造基质骨架及各种因子共培养,不仅为肿瘤细胞生长提供了类似于体内ECM的支架或基质结构,还可实现细胞间、细胞与ECM间的相互作用,也更能反映细胞与细胞间质间的作用机制,有利于从分子水平对肿瘤相关机制进行研究。本研究采用胶原Ⅰ建立卵巢癌HO-8910PM细胞三维培养模型,对三维培养和二维培养下卵巢癌细胞的形态及血管内皮生长因子-A(VEGF-A)、表皮生长因子(EGF)、胰岛素样生长因子-1(IGF-1)的分泌进行对比分析,为今后体外研究卵巢癌的发生机制提供实验基础及理论依据。
1 材料与方法
1.1 材料鼠尾胶原Ⅰ购自美国BD公司,钙黄绿素-AM购自美国Sigma公司。细胞培养用PRMI-1640培养基、胎牛血清(FBS)均购自美国Gibco公司,0.25%Trypsin-EDTA、双抗(100 U/mL青霉素,100 μg/mL链霉素)均购自美国Hyclone公司,VEGF-A、EGF和IGF-1 ELISA检测试剂盒均购自美国Uscn公司。3131型CO2培养箱购自美国Thermo公司,318C酶标仪购自上海三科仪器有限公司,IX71型荧光倒置荧光显微镜购自日本Olympus公司,H-7650型透射电镜购自日本Hitachi公司。
1.2 方法
1.2.1 透射电镜表征胶原结构特点PBS稀释胶原Ⅰ至浓度为0.06 mg/mL,取少量滴在透射电镜专用铜格上,5 min后用滤纸吸掉铜格上的液体,滴加1%磷钨酸负染30 s,滤纸吸掉铜格上多余的磷钨酸,室温晾干,透射电镜观察并拍照。
1.2.2 细胞培养HO-8910PM细胞株来自ATCC(美国模式培养物集存库),含10%胎牛血清和1%青霉素/链霉素双抗的PRMI-1640培养基于37℃、5%CO2及饱和湿度常规培养,待细胞融合至80%时,0.25%Trypsin-EDTA消化细胞进行下一步实验。
1.2.3 三维培养取生长状态良好的二维培养细胞,0.25%Trypsin-EDTA消化,冰浴下按照说明书以1 mol/L NaOH溶液和0.1 mol/L PBS调整胶原Ⅰ的pH值为中性,与细胞混匀,使得胶原Ⅰ终浓度为1.5 mg/mL,细胞终浓度为1×106mL-1,混合后取100 μL快速接种于24孔板内,37℃孵育30min后,加入800μL完全PRMI-1640培养液,37℃、5%CO2及饱和湿度常规培养,隔天换液,并于倒置显微镜下观察细胞生长情况。
1.2.4 钙黄绿素-AM染色细胞在胶原Ⅰ中培养3、6 d,预冷的PBS洗3次,每次15 min,以去除或稀释血清中的酯酶活性。PBS稀释钙黄绿素-AM液至2 μmol/L,取300 μL添加到三维培养凝胶中,室温孵育45 min,荧光显微镜下观察并拍照。
1.2.5 VEGF-A、EGF和IGF-1的分泌胶原Ⅰ三维培养卵巢癌细胞,到第4天时更换培养液,每孔加800 μL完全PRMI-1640培养液培养到第6天,取出细胞培养液,2 000 g离心20 min,取上清液分装于1.5 mL EP管中备用。样本处理按照ELISA试剂盒说明书进行,酶标仪检测450 nm波长处的吸光度值,并与二维培养细胞作对比。
1.3 统计学处理应用SPSS13.0统计软件进行数据分析,计量资料用±s表示,采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 透射电镜下胶原Ⅰ结构特点透射电镜下可见胶原Ⅰ呈细长交叉的网络状结构,这种交叉的网络状结构为肿瘤细胞三维培养提供了一个类似细胞外基质的支架结构。见图1。

图1 透射电镜胶原Ⅰ在PBS中溶解后的结构特点
2.2 胶原Ⅰ基质中细胞的形态倒置显微镜下可见二维培养下的卵巢癌HO-8910PM细胞形态与胶原Ⅰ基质中的生长形态完全不同:二维培养条件下卵巢癌细胞呈多边形,培养4 h开始贴壁,24 h完全贴壁;然而,在胶原Ⅰ基质中,细胞均匀分布于基质材料中,培养第3天时细胞开始形成明显的不规则状细胞团,随着培养时间的延长,细胞团逐渐增大。见图2。

图2 卵巢癌HO-8910PM细胞二维培养及胶原Ⅰ中三维培养3、6 d的形态(100×)
2.3 细胞存活力观察胶原Ⅰ基质中细胞分别培养到第3、6天时进行钙黄绿素染色可见:处于不同梯度的细胞均呈现绿色荧光,细胞呈不规则团状集聚,见图3。生长于胶原Ⅰ基质中的卵巢癌细胞基本存活,生长状态较好,细胞与胶原Ⅰ具有良好的生物相容性。
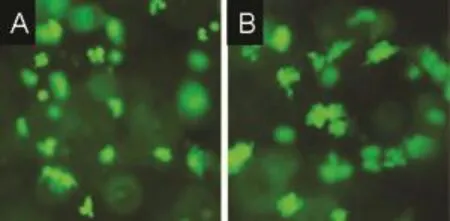
图3 HO-8910PM细胞在胶原Ⅰ中三维培养第3天和第6天的钙黄绿素荧光染色图(100×)
2.4 2种培养方法卵巢癌细胞VEGF-A、EGF和IGF-1分泌量比较与二维培养细胞比较,胶原Ⅰ三维培养体系中VEGF-A、IGF-1和EGF的分泌量显著增高,差异均有统计学意义(P<0.05或0.01)。见表1。
表1 2种培养方法卵巢癌细胞VEGF-A、EGF和IGF1分泌量比较(±s,pg/mL)
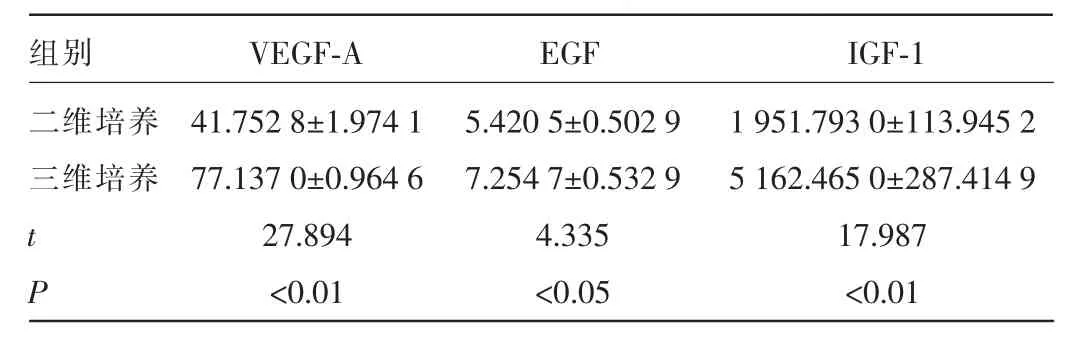
表1 2种培养方法卵巢癌细胞VEGF-A、EGF和IGF1分泌量比较(±s,pg/mL)
组别二维培养三维培养VEGF-AEGF IGF-1 tP 41.752 8±1.974 1 77.137 0±0.964 6 27.894<0.01 5.420 5±0.502 9 7.254 7±0.532 9 4.335<0.05 1 951.793 0±113.945 2 5 162.465 0±287.414 9 17.987<0.01
3 讨论
近年来,越来越多的研究表明,三维培养比二维培养更能真实地反映细胞在体内的生物学行为[5]。为建立更为理想的细胞体外三维培养模型,多种材料被用于构建类似体内的微环境,主要有高分子聚合材料、有机材料复合物和细胞外基质等[6]。高分子聚合物的孔径一般都在10~50 μm,这与大多数细胞的尺寸(5~30 μm)相近[7-8],事实上附着于这类微米纤维上的细胞未与材料充分接触,仍然处于二维的微环境中[9];藻酸盐等有机材料复合物的机械性能和细胞黏附性差,作为细胞培养支架只能简单地模拟天然组织,还不能更好地体现体内细胞生长微环境。胶原Ⅰ是从动物体内提取的一种水凝胶基质,具有来源丰富、可塑性高、制作工艺相对简单、临床应用方便[10-12]、免疫学背景清楚等特点。此外,胶原Ⅰ是含水凝胶,营养物可以自由进出凝胶网络,同时还可以交联生物活性因子调节细胞的生长和分化[13-14],因此具有良好的亲水性及细胞相容性。胶原Ⅰ适当的机械性能和结构特性促进了细胞与细胞、细胞与ECM的相互作用,作为三维培养支架材料时可为细胞生长提供一个适宜的微环境。
本研究以胶原Ⅰ为支架材料进行卵巢癌HO-8910PM细胞体外三维培养,通过观察胶原Ⅰ基质中细胞的形态、活力和增殖情况,发现胶原Ⅰ所形成的交叉网络状结构能够充分支持卵巢癌细胞的生长,细胞在胶原Ⅰ基质大部分存活,并集聚成团,呈空间立体生长,随着培养时间的延长细胞团逐渐增大,该现象与二维培养细胞贴壁生长现象明显不同,提示细胞生长微环境直接影响了细胞的形态。通过ELISA检测二维和三维培养条件下肿瘤血管生成相关因子的分泌,结果显示,三维培养下卵巢癌细胞VEGF-A、EGF和IGF-1的分泌量均比二维培养细胞分泌量高,其中VEGF-A和IGF-1的分泌量与二维细胞相比较均显著增高,推测可能由于三维培养体系中,卵巢癌细胞聚集成团生长,随着培养时间的延长细胞团逐渐增大,中心区域的细胞可能存在缺氧现象,从而促进了血管生成相关因子的分泌。由此可见,细胞外微环境极大地影响了细胞的形态及功能。卵巢癌细胞胶原Ⅰ三维培养体系的成功建立,将为从细胞外微环境治疗卵巢癌提供研究的理论和应用基础。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2007[J].CA Cancer J Clin,2007,57(1):43-66.
[2]俞岚,周蕾,宋文庆,等.卵巢上皮性癌中MMP-7,VEGF-C的表达和微淋巴管密度变化的相关性及其意义[J].中国组织化学与细胞化学杂志,2013,22(2):126-131.
[3]Grun B,Benjamin E,Sinclair J,et al.Three-dimensional in vitro cell biology models of ovarian and endometrial cancer[J].Cell Prolif,2009,42(2):219-228.
[4]David L,Dulong V,Le Cerf D,et al.Hyaluronan hydrogel:an appropritate three-dimensional model for evaluation of anticancer drug sensitivity[J]. Acta Biomater,2008,4(2):256-263.
[5]Smith LA,Liu X,Hu J,et al.Enhancing osteogenic differentiation of mouse embryonic stem cells by nanofibers[J].Tissue Eng Part A,2009,15(7):1855-1864.
[6]唐建华,崔杰峰,刘银坤.转移性人肝癌类组织体模型的建立[J].生物化学与生物物理进展,2010,37(8):864-870.
[7]Zhang S,Gelain F,Zhao X.Designer self-assembling peptide nanofiber scaffolds for 3D tissue cell cultures[J].Semin Cancer Biol,2005,15(5):413-420.
[8]宋鸿,韩云竹,蔡国徽.细胞培养技术的研究进展[J].遵义医学院学报,2014,37(5):549-554.
[9]王贵侠,米坤,刘子佳,等.自组装纳米短肽基质在肿瘤细胞三维培养中的应用[J].兰州大学学报:医学版,2010,36(1):39-43.
[10]Feng ZQ,Chu X,Huang NP,et al.The effect of nanofibrous galactosylated chitosan scaffolds on the formation of rat primary hepatocyte aggregates and the maintenance of liver function[J].Biomaterials,2009,30(14):2753-2763.
[11]Kim M,Lee JY,Jones CN,et al.Heparin-based hydrogel as a matrix for encapsulation and cultivation of primary hepatocytes[J].Biomaterials,2010,31(13):3596-3603.
[12]Fu Y,Xu K,Zheng X,et al.3D cell entrapment in crosslinked thiolated gelatin-poly(ethylene glycol)diacrylate hydrogels[J].Biomaterials,2012,33(1):48-58.
[13]Cushing MC,Anseth KS.Materials science.Hydrogel cell cultures[J]. Science,2007,316(5828):1133-1134.
[14]Seliktar D.Designing cell-compatible hydrogels for biomedical applications[J].Science,2012,336(6085):1124-1128.
读者·作者·编者
本刊欢迎各类基金课题论文
为了更快地传播、交流医学科学技术领域的新成果、新技术,本刊特别欢迎各类基金课题论文,基金课题论文包括国家自然科学基金、国家各部委及各省、市、自治区的各种基金课题所产生的论文。本刊将以优惠价格,优先安排发表,鼓励基金课题作者踊跃投稿。基金项目需写明基金名称及编号,并附单位证明,否则无效。
本刊编辑部
The biological behaviors charater of ovarian carcinoma cells of a collagen three-dimensional cultivation system
Cai Guohui,Han Yunzhu,Tang Bin,Song Hong
(Department of Microbiology,Zunyi Medical College,Zunyi,Guizhou 563099,China)
ObjectiveTo establish the three-dimensional(3D)cultivation model of ovarian cancer HO-8910PM cell line using collagenⅠas scaffolds and observe the cellular morphologies,vitalities and functions to provide references for the study of ovarian cancer in vitro.MethodsTEM was used to be assess to representation of characteristics of collagenⅠformation.Relied oncollagenⅠasraw materials,itwasestablished three-dimensionalsystem model.The growthform and proliferation of ovarian carcinomacells were observed by inverted microscope.The viabilities of the ovarian carcinoma cells in the collagenⅠmatrix were examined by calcein-AM staining;The expression of VEGF-A,EGF and IGF-1 in collagenⅠmatrix were inspected by Elisa assay.ResultsCollagenⅠdisplayed a cross-linked network structure under transmission electron microscopeⅠ.The ovarian carcinoma cells in the collagenⅠmatrix were irregular regiment massive structure and showed a good vitality in the collagenⅠ.It had a good biocompatibility between the cells and matrix.Compared to two-dimensional cultured cells,the secretion quantity of VEGF-A,EGF and IGF1 in the three-dimensional cultivation system was higher.The difference had statistical significance(P<0.05).ConclusionCollagenⅠcan support ovarian cancer three-dimensional culture adequately with good structure and functions,which is suitable for three-dimensional cultivation of ovarian carcinoma cells in vitro,maintaining the form and functions of ovarian cancer cells.
Ovarian neoplasms;Culture techniques;Collagen typeⅠ;Vascular endothelial growth factors;Epidermal growth factor
10.3969/j.issn.1009-5519.2015.05.002
:A
:1009-5519(2015)05-0642-03
2014-12-01)
国家自然科学基金资助项目(81160290)。
蔡国徽(1992-),女,云南昭通人,在读硕士研究生,主要从事肿瘤细胞三维培养方面的研究;E-mail:874660990@qq.com。
宋鸿(E-mail:song-77@qq.com)。

