18°P高浓酿造抗葡萄糖阻遏效应啤酒酵母的选育
郭立芸
1(北京燕京啤酒股份有限公司技术中心,北京,101300)2(燕京啤酒酿造技术北京市重点实验室,北京,101300)
啤酒高浓酿造(very high gravity,VHG)是指在啤酒酿造过程中糖化得到较高浓度的麦芽汁(15~18°P),在发酵以后的工序中再用含CO2的脱氧水稀释到正常浓度(10~12°P)的酿造技术。高浓酿造后稀释技术,可以在投资和运行成本降低的情况下,增加产量20%~40%,实现高浓酿造有着显著的经济效益和社会效益[1]。但是由于VHG麦汁中存在更高浓度的可发酵性糖,导致发酵初期酵母细胞承受更高的渗透压并且在发酵后期承受更高的乙醇毒性[2]。这些环境压力在很大程度上限制了啤酒的发酵速度,酵母活性也明显降低,同样也降低了酵母的再次发酵活性(即酵母的重复利用)[3],通过定向驯化选育耐高浓度的优良啤酒酵母可克服VHG酿造的劣势。
啤酒发酵过程中,当麦汁中含有葡萄糖浓度高于0.2% ~0.5% 时,会限制酵母对麦芽糖的利用,只有低于此浓度限制才会解除[4],但会降低酵母吸收利用麦芽糖和麦芽三糖的速率,造成发酵迟缓。而在超高浓发酵的麦汁中往往添加一定比例的啤酒糖浆,葡萄糖浓度会明显提高,阻遏效应加剧,最终出现发酵不彻底等现象。因此,如果对酵母进行特定的筛选,使其能够在较高葡萄糖浓度下提高对麦芽糖的利用速率,就可以在超高浓条件下提高发酵速度,缩短发酵时间,最终改善啤酒的品质[5-7]。2-脱氧-D-葡萄糖(2-DG)是葡萄糖的结构类似物,酵母吸收后不能利用,却可以对酵母产生葡萄糖阻遏效应且不能解除[8]。因此,通过在以麦芽糖为惟一碳源并添加有2-DG的培养基中可实现抗葡萄糖阻遏酵母菌株的筛选。
本研究首先从燕京12°P酿酒酵母菌株出发,通过定向自然选育获得18°P耐超高浓酿造菌株,在此基础上,将18°P高浓酵母菌株在添加2-DG抑制剂的酵母浸膏蛋白胨平板上梯度培养、抗性平板分离初筛以及复筛,使这些突变株表现出耐受较高的渗透压和酒精的能力,并适用于高浓酿造的抗葡萄糖阻遏效应的啤酒酵母菌株,并将该菌株进行100 L微酿啤酒发酵实验,以期获得1株高浓酿造抗葡萄糖阻遏效应啤酒酵母。
1 材料与方法
1.1 材料
(1)实验用菌株:12°P燕京酿酒酵母(Saccharomyces cerevisiae)菌株YJ0002,由燕京集团科研中心提供。
(2)实验用培养基(北京陆桥技术有限责任公司生产):A-18°P高浓酿造定向驯化培养基:由14°P冷麦汁加糖浆调浓制成,保藏用固体培养基加入2%琼脂粉制成;B-浓度梯度培养基:由18°P和25°P麦汁添加2%琼脂,先将25°P培养基铺入微倾放置的培养皿内,使铺好的培养基在培养皿内一侧成15°角,待凝固后水平放置培养皿,再将18°P培养基铺入,直到培养基表面水平为止;C-酵母浸膏蛋白胨琼脂培养基(YPM):酵母浸出物1%,蛋白胨2%,1%麦芽糖,0.05%的2-DG,2%琼脂。
1.2 主要仪器设备
高效气相色谱仪,美国Agilent6890型;啤酒检测仪,奥地利Anton paar DMA4500型;酸度计,意大利哈纳PH211型;色度计,德国DRLANGE;显微镜,日本OLYMPUS CX-41型;分光光度计,日本岛津UV-2550;恒温水浴锅,美国Polyscience;水浴振荡器,哈东联HZS-H型;生化培养箱,日本三洋MIR254上海一恒LRH250;全温振荡器,哈东联HZQ-Q型;酶标仪,美国Bio-rad model 550。
1.3 实验方法
1.3.1 分析测定方法
双乙酰、酒精度测定见《啤酒工业手册》[9];酵母死亡率测定采用亚甲基蓝染色法[10]。
主要风味物质含量测定采用顶空气相色谱法[11];可发酵性糖测定采用高效液相色谱法[12];AP酸化力测定见参考文献[13]。
1.3.2 18°P超高浓酿造啤酒酵母的定向选育
1.3.2.1 18°P超高浓酿造啤酒酵母的驯化
将12°P燕京酵母YJ0002由斜面接入12°P无菌麦汁(25 mL)中,在25℃下150 r/min振荡培养至对数生长期(大约36 h)。取对数生长期菌悬液培养液1 mL接种至18°P高浓驯化培养基中,并在25℃继续振荡培养,培养至对数期后,重复上述操作进行定向驯化,驯化至第11代。每代检测对数期酵母细胞数和酵母细胞活性,确定性能良好代数的菌种,将菌种进行斜面保存。
1.3.2.1 耐18°P超高浓酿造啤酒酵母的筛选
将上述性能良好代数酵母菌选取1 mL培养液连续梯度稀释涂布至18°P麦汁固体培养基平板上,选取较大菌落。将大菌落挑取1环放在装有10 mL 18°P无菌麦汁的试管中,在25℃培养箱中培养24 h。再将活化菌液进行稀释,将10-4菌液在18~20°P梯度平板上进行涂布。于25℃培养箱中培养48 h。在高浓区选取生长强壮的菌落,完成一次分离筛选。重复分离筛选10次,最后从高浓区选取生长迅速强壮的菌株移接在18°P斜面中保存备用。
1.3.3 超高浓抗葡萄糖阻遏效应酵母菌株的分离与筛选
1.3.3.1 抗葡萄糖阻遏效应突变株的分离
将选育出的18°P高浓酿造菌株菌悬液涂布于添加有0.05%的2-DG的YPM平板中,25℃培养2~3 d。将长出的菌落再在上述平板中划线培养分离1次,找出单菌落进行单菌落分离。同时接种10 mL液体试管进行活化,采用梯度稀释法分离单菌落。重复第3步,连续分离3代,选出最好菌落。
1.3.3.2 酒精耐受能力实验
按表1所列酒精浓度将驯化菌株菌悬液在每个浓度中接入0.1 mL,每个浓度做2个平行,于25℃培养箱中培养10 d,观察杜氏管中产气情况。

表1 酒精含量分配表Table 1 Alcohol content distribution table
1.3.3.3 高通量筛选
将抗葡萄糖阻遏效应突变株活化24 h后接种0.2 mL到48孔板培养,然后使用酶标仪检测其OD值,进行高通量筛选。
1.3.4 100 L微酿发酵实验
将分离得到的抗葡萄糖阻遏效应的啤酒酵母菌株进行三角瓶发酵选育后,进行100 L微酿实验。将挑选的最优菌和出发菌进行100 L啤酒小型发酵,麦汁浓度18.2°P,发酵温度为(14±0.5)℃,接种酵母浓度为(20±5)×106个/mL。跟踪检测双乙酰、酒精度、降糖情况、酵母数的变化。发酵结束后检测发酵度、pH值、总酸、苦味质、AP值、风味物质等相关发酵指标。
2 结果与讨论
2.1 18°P超高浓酿造啤酒酵母的定向选育结果
2.1.1 酵母细胞数及细胞活性检测结果
以燕京12°P酿酒酵母(S.cerevisiae)YJ0002为对照菌株,经11代传代定向驯化后,分别编记为 C1~C11传代后,其在对数期酵母细胞数和酵母细胞活性见图1。
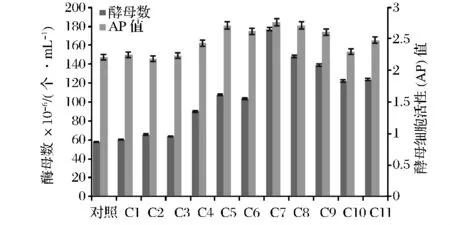
图1 18°P高浓酿造驯化各代数酵母细胞数(对数期)和细胞活性(AP)值Fig.1 The yeast count and acid power of C0-C11 under the very high gravity brewing
由图1可知,驯化代数C1-C4阶段,对数期酵母数缓慢增长,酵母细胞活性AP值略有增加,驯化代数C5-C8阶段,对数期酵母数呈现基本稳定趋势,同时,酵母细胞活性基本稳定,其中C8的酵母细胞数和酵母细胞活性表现良好。驯化代数C9-C11阶段,酵母细胞数和细胞活性呈现降低趋势。因此选取驯化代数C8阶段进行梯度稀释平板筛选。
2.1.2 定向驯化后的菌落及细胞形态
将经过10次筛选后的C8代菌株挑取少量用无菌水进行稀释后,涂布于18°P麦汁培养基平板上,培养48 h后其菌落状态和细胞状态分别见图2(稀释10-4)。培养过程中发现驯化菌株较对照菌株菌落生长快、菌落大。

图2 对照菌株和驯化菌株菌落形态照片(培养48 h)Fig.2 The colony morphology photograph of control stain and experimental strain
图2表明驯化菌株适合在18°P麦汁培养基平板上生长,细胞在高渗透压的条件下,仍保持很高的生理活性,菌落大而饱满。而对照菌株则不适应在此浓度下生长。
从图3可以看出,驯化过的酵母形态呈圆形,酵母形态饱满正常,而对照菌株出现了大量形态异常的细胞。这表明未经驯化的对照菌株对高渗透压、高酒精环境表现出了极大的不适应,高渗透压与高酒精造成细胞变形。驯化后的菌株适应高浓环境,形态未见异常。
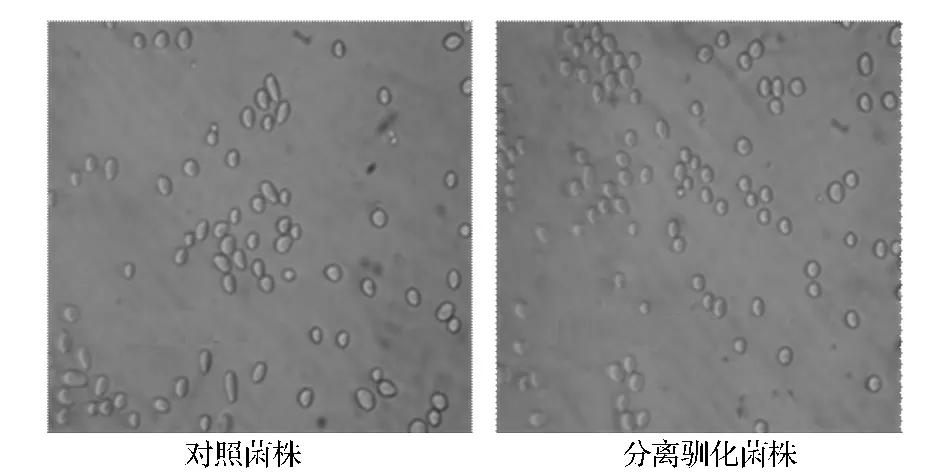
图3 对照菌株和驯化菌株细胞形态照片(40×10倍)Fig.3 The cellular morphology of control stain and experimental strain
2.2 超高浓抗葡萄糖阻遏效应酵母菌株的分离与筛选结果
2.2.1 平板分离获取抗葡萄糖阻遏效应啤酒酵母
将上述分离驯化得到的C8代酵母菌株连续梯度稀释涂布于添加有0.05%的2-DG的YPM平板中,在稀释梯度10-6和10-7条件下获得抗2-DG的高浓酿造的单菌落酵母,生长情况如图4所示。

图4 YPM平板分离菌株培养照片(48 h)Fig.4 The Purification strain cultured on YPM culture medium
2.2.2 酒精耐受能力测试结果
将分离到的抗葡萄糖阻遏效应的啤酒酵母进行耐酒精实验,培养10 d后的结果如表2所示。
从表2可以看出,驯化后的菌株在酒精浓度(乙醇体积分数)为13%的试管中仍有气泡产生,证明驯化菌株能够耐受13%的酒精浓度,而对照菌株的耐酒精浓度为10%。因此得出,经过驯化的菌株耐酒精能力能力提高了3%,最高可以耐受13%的酒精。

表2 耐酒精实验结果Table 2 The results for ethanol resistance experiment
2.2.3 高通量筛选结果
将驯化菌株分离培养得到2 545个菌株,将其接种48孔板发酵,测其生长OD值。经过逐级筛选获得30株菌进行量筒发酵(重复5次),最终突变株G2和G9的降糖速度、乙醇生成、酵母增殖和死亡率表现出较好的稳定的突变性状。
2.3 筛选菌株的发酵性能结果(100 L微酿)
2.3.1 酵母增殖、乙醇生成、发酵速率、双乙酰检测
在18°P高浓发酵过程中,对照菌株YJ0002和驯化菌株G2、G9的乙醇浓度、酵母增殖、双乙酰还原和发酵速率随时间的变化曲线如图5~图8所示。

图5 酵母增殖曲线图Fig.5 Yeast proliferation curve

图6 发酵速率曲线图Fig.6 Fermentation rate
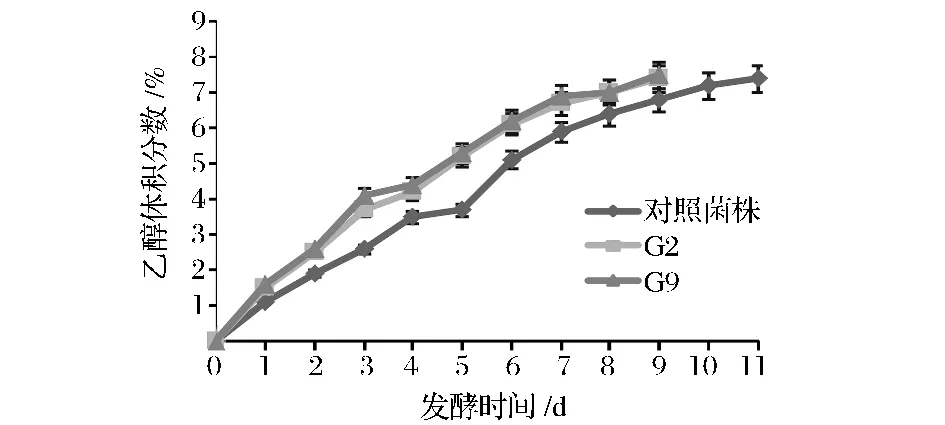
图7 酒精生成曲线图Fig.7 The curve for ethanol production
从图5~图8可以看出:在18°P发酵过程中,酵母数的变化反应了酵母在超高浓麦汁中的生长与繁殖情况,对糖的利用率和最终的发酵度都有不可忽视的作用。驯化菌株酵母峰值明显高于对照菌株。与对照菌株YJ0002相比,驯化菌株G2和G9表现出更快的发酵速率,发酵速率(发酵初期)分别提高了10.96%和15.11%,G2和G9菌株在发酵的第9天残糖浓度达到4.5°P和4.46°P,较之于对照菌株发酵11d残糖浓度4.61°P,分别缩短发酵时间42 h和50 h,因此可以提高高浓酿造的生产效率。发酵初期酒精的生成速率分别比对照菌株增加了10.52%和14.24%,双乙酰是反映啤酒成熟度的指标,G2菌株和G9菌株的双乙酰峰值高于对照菌株,这是由于G2和G9酵母数的增殖倍数比出发菌株大,导致双乙酰前驱物大量合成的结果,与对照菌株相比,G2和G9菌株双乙酰还原时间分别提前38 h和50 h。酵母数的变化反映了酵母在超高浓麦汁中的生长与繁殖情况,对糖的利用率和最终的发酵度都有不可忽视的作用。驯化菌株酵母明显高于对照菌株。

图8 双乙酰还原曲线图Fig.8 The curve for reduction of diacetyl
2.3.2 AP值的检测结果
酸化力(AP)法被认为是评估酵母活性的有效方法之一[12]。AP值大小与酵母的发酵活性相关,特别是在极端环境下用来评价酵母活性。发酵结束后收集酵母泥检测驯化菌株的AP值如图9所示。

图9 18°P发酵结束后 YJ0002、G2、G9的 AP值图Fig.9 The acid power of YJ0002,G2,G9 after fermentation
从图9可以看出,驯化菌株G2和G9的AP值均比对照菌株YJ0002高,这一结果表明G2和G9在传代发酵过程中可以保持较高的活性。
2.3.3 风味物质的检测结果
在18°P发酵结束后对照菌株YJ0002和驯化菌株G2、G9的啤酒风味物质检测结果见表3。

表3 啤酒风味物质检测结果 (单位:mg/L)Table 3 The results of flavor compound detection
从表3可以看出,相对于对照菌株 YJ0002,随着麦汁浓度增加乙酸乙酯浓度显著增加,高级醇浓度显著降低,破坏了啤酒的风味协调性。这一结果与Piddocke等人[14]的研究结论相同。啤酒中的酯含量不能过高或过低,酯含量过高会有异常的香气,过低又会使啤酒寡淡无味。因此啤酒中的酯含量要适当。
在18°P发酵过程中,突变株G2和G9发酵的啤酒表现出较低浓度的总酯和适宜浓度的总高级醇。并且G2和 G9生产的VHG啤酒的口感较 YJ0002有了显著的改善。G2和G9生成的啤酒具有更加协调醇香和果味。驯化菌株G2和G9乙醛含量低于出发菌株,这表明驯化菌株对乙醛的还原能力强于出发菌株。啤酒中的乙醛含量过高会有生青味,因此要求菌株对乙醛的还原能力越强越好。
2.3.4 常规理化指标的检测结果
发酵结束后,发酵液的pH、总酸、苦味质、酒精度和真实发酵度检测结果见表4。
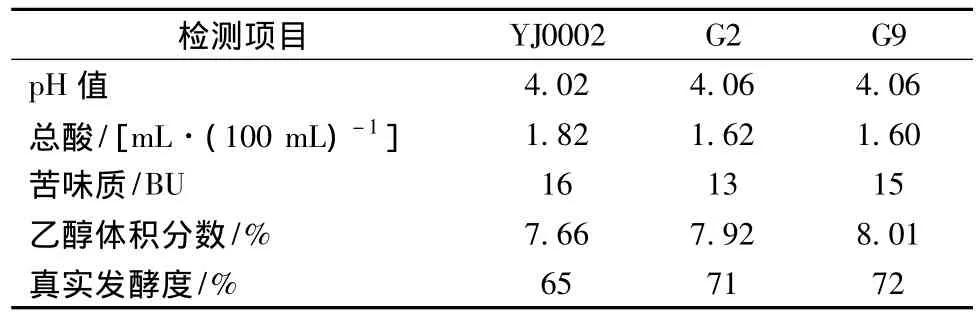
表4 理化指标的检测结果Table 4 The chemical index result after fermentation
驯化后的菌株G2和G9发酵液的发酵度比对照菌株提高了6%和7%,其他指标基本与对照菌株YJ0002相近,基本上保持了对照菌株的优良性状。
2.3.5 感官品评
将高浓发酵酒稀释到10°P,组建由国家级品酒师2人、国家啤酒评委3人、公司级品酒师2人的品评小组,将小组平均成绩记为样品感官评价结果。对啤酒样品进行感官特征、感官质量评价,表5为感官品评结果。

表5 感官品评结果Table 5 The rusults of sensory evaluation
从感官指标品评结果来看,菌株YJ0002有臭酵母味,而驯化菌株则G2和G9没有。这是因为在后酵期酵母死亡率过高,酵母自溶所造成。
3 结论
本研究以酿酒酵母 YJ0002为出发菌株对其进行18°P定向驯化后,在添加2-DG的YPM分离抗葡萄糖阻遏效应酵母突变株,采用高通量进行初筛复筛,并进行微酿实验验证。定向传代培养后C8代酵母表现出较好的酵母增殖和AP活性,分离得到的抗阻遏效应酵母突变株菌生长迅速,细胞在高渗透压的条件下,仍保持很高的生理活性,菌落大而饱满。经高通量筛选获得的G2和G9两株菌,在100L微酿发酵过程中,发酵速率、酵母增殖、风味物质较出发菌株有了明显改善。
(1)分离得到的抗葡萄糖阻遏效应的超高浓啤酒酵母菌株最高可耐受13%的酒精浓度。
(2)突变株G2和G9的发酵初期的酒精生成速率分别比初始菌株YJ0002提高10.52%和14.24%。
(3)突变株G2和G9发酵速率(发酵初期)分别提高了10.96%和15.11%,分别缩短发酵时间42 h和50 h,发酵度分别提高了6%和7%。
(4)在发酵结束时突变株G2和G9的AP值较初始菌株YJ0002高,酵母细胞活性增加。
(5)相对于初始菌株YJ0002,在VHG条件下,突变株G2和G9生产的啤酒表现出较低浓度的乙酸乙酯和适宜浓度的高级醇,且G2和G9生成VHG啤酒的口感较YJ0002有了显著的改善。感官品评G2和G9酵母菌株产酒风味:酯香较明显;YJ0002有轻微酵母臭。
[1] 任海波.超高浓酿造技术研究及其在啤酒生产中的应用[D].乌鲁木齐:新疆农业大学,2007.
[2] Pereira F B,Guimarães P M R,Teixeira J A,et al.Selection of Saccharomyces cerevisiae strains for efficient very high gravity bio-ethanol fermentation processes[J].Biotechnology Letters,2010,32(11):1 655-1 661.
[3] Lodolo E J,Kock J L F,Axcell B C,et al.The yeast Saccharomyces cerevisiae-the main character in beer brewing[J].FEMS Yeast Research,2008,8(7):1 018-1 036.
[4] Pereira F B,Guimarães P M R,Teixeira J A,et al.Selection of Saccharomyces cerevisiae strains for efficient very high gravity bio-ethanol fermentation processes[J].Biotechnology Letters,2010,32(11):1 655-1 661.
[5] Lodolo E J,Kock J L F,Axcell B C,et al.The yeast Saccharomyces cerevisiae-the main character in beer brewing[J].FEMS Yeast Research,2008,8(7):1 018-1 036.
[6] 张秀丽,唐晓达,刘进文,等.高浓度双乙酰定向驯化获得优良啤酒酵母菌株的研究[J].食品工业科技,2003,24(8):42-43.
[7] Mizuno A,Tabei H,Iwahuti M.Characterization of low aceticacid producing yeast isolated from 2-deoxyglucose resistantmutants and its application to high gravity brewing[J].J Biosci Bioeng,2006,101(1):31-32.
[8] Tony D'Amore1,Terrance M.Dowhanick,Biochemical and genetic characterization of a 2-deoxy-D-glucose resistant mutant of Saccharomyces cerevisiae[J]J Am Soc Brew Chem,1994,52(1):12-15.
[9] 管敦仪.啤酒工业手册-2版(修订版)[M].北京:中国轻工业出版社,1999:361-363.
[10] 王治权,陈远河,尚水英.啤酒酵母实用技术[M].上海:上海科学普及出版社,1990.
[11] 林艳,单连菊,张沛,等.高效液相色谱法测定啤酒,发酵液和麦汁中的糖类和乙醇[J].分析化学,1999,27(6):744-744
[12] GB/T4928-2008.啤酒分析方法[S].
[13] 刘建民,张梁.应用AP法评价工业酒精酵母的活力[J].中国酿造,2008(14):34-37.
[14] Piddocke M P,Kreisz S,Heldt-Hansen H P,et al.Physiological characterization of brewer’s yeast in high-gravity beer fermentations with glucose or maltose syrups as adjuncts[J].Applied Microbiology and Biotechnology,2009,84(3):453-464.

