超声预处理对湿法阳离子淀粉性质的影响*
张慧,侯汉学,董海洲,刘晗,舒杨,李春雪
(山东农业大学食品科学与工程学院,山东泰安,271018)
我国的阳离子淀粉生产仍以传统湿法为主,产品取代度、反应效率较低,阳离子淀粉的性质也在多个方面有所欠缺,在染色、絮凝、造纸、纺织行业中的应用需要进一步的改性以及交联,这就造成目前湿法阳离子淀粉的应用要增加复杂的工序,进一步增加成本[1]。制约产品取代度和反应效率的主要问题是淀粉结晶区分子排布紧密,渗透性差,水、酶以及化学试剂不易渗透进入淀粉颗粒,导致醚化剂与淀粉的反应速率较低。在传统变性淀粉的生产中主要靠碱破坏淀粉颗粒的结晶区结构,在一定程度上有利于减少反应过程中的扩散阻力,但是过高的碱浓度会导致醚化剂分解的副反应发生,降低反应效率;且较高的碱浓度容易导致淀粉颗粒整体糊化,并且会导致产品中含有较多盐、碱杂质,难以洗涤[2]。
近年来,超声技术逐渐应用于淀粉领域。Zhu等[3]采用不同功率超声处理马铃薯淀粉,随着超声功率的增加,淀粉颗粒逐渐由紧密结构膨胀成体积更大更疏松的结构,结晶区分子的有序度下降。Jambrak等[4]以高强度24kHz频率超声处理玉米淀粉后,改变了淀粉的结晶区结构。超声波通过机械效应、空化效应及自由基氧化反应等作用,降低淀粉结晶区结构的紧密性,起到破碎淀粉结晶区结构具有操作简单、环保、易控制、高效低能耗的特点[5]。
本实验将超声技术与传统湿法工艺相结合制备阳离子淀粉,研究超声预处理过程对阳离子淀粉分子结构及糊液性质的影响。
1 试验材料与方法
1.1 试验材料
1.1.1 试验原料
玉米淀粉,山东诸城兴贸有限公司;Shodex Standard P-82普鲁兰多糖,昭和电工株式会社;醚化剂3氯-2羟丙基三甲基氯化铵(CHPTMA)、NaNO3、NaOH、冰醋酸、HCl、CuSO4、K2SO4、H3BO3、H2SO4、无水乙醇等均为分析纯。
1.1.2 试验仪器
PHS-25型酸度计,上海伟业仪器厂;101A-1型电热鼓风干燥箱,黄骅市凯丰仪器厂;KDN-04A凯氏定氮仪,上海新嘉电子有限公司;LC-20A液相色谱仪,日本岛津;FS-250超声波处理器,上海生析超声仪器有限公司;SUPER-3RVA型快速黏度分析仪,澳大利亚NEWPORT科学仪器公司;DSC-200PC,德国耐驰公司。
1.2 阳离子淀粉制备方法
1.2.1 超声预处理原淀粉
称取30.0 g玉米淀粉于250 mL烧杯中,加入120 mL水,搅拌均匀混合成20%的淀粉乳,在一定功率的20 kHz频率超声波下作用一定时间,处理完后,用蒸馏水洗涤淀粉,抽滤,干燥,待后续制备用。
1.2.2 湿法制备阳离子淀粉
将30 g超声处理的淀粉于250 mL烧杯中加水配成0.4 g/mL浓度的淀粉糊,搅拌均匀后加入4.75 g CHPTMA,3.25 g Na2SO4,转入 250 mL 三颈烧瓶中。在一定温度下缓慢搅拌,用NaOH调节pH值,反应一段时间后,使用HCl调节pH至中性,将样品取出、抽滤、洗涤,干燥,研磨得成品。
1.2.3 凝胶渗透高效液相色谱法测定分子量
色谱条件:色谱柱:TSK gel columns系列G5000,G3000(Tosohaas);流动相:0.01 mol/L NaNO3溶液;柱温:30℃;流速:0.4 mL/min;检测器:RID-10A示差折光检测器。
标准曲线绘制:采用Shodex Standard P-82 Pullulan作为分子质量标准品。选用重均分子质量(MW)为 5 900,11 800,22 800,47 300,112 000,212 000,404 000,788 000的8个Pullulan标准品绘制标准曲线。标准品分别取50 mg,加5 mL质量分数0.02%叠氮化钠溶液配制成浓度0.1%的溶液,在室温下静置24 h,0.45 μm过滤,色谱测定。使用GPC软件绘制标准曲线。
样品测定:将150 mg淀粉溶解于15 mL 90%二甲基亚砜中,在沸水浴中加热1 h后,在25℃下搅拌24 h。加入无水乙醇,在3 000×g下离心10 min。沉淀加10 mL水在100℃加热30 min,色谱测定。
1.2.4 DSC热性质测定
热性质用DSC-200PC测定。用耐驰坩埚称取5 mg左右的淀粉样品,加入15 μL重蒸水。用示差扫描量热仪进行测定,扫描温度范围为0~120℃,扫描速度5℃/min,得到热性质参数主要包括起始温度(To)、峰值温度(Tp)、终止温度(Tc)、糊化焓变(ΔH)。
1.2.5 透光率的测定
称取0.20 g淀粉样品置于20 mL刻度试管内,调节pH为6.5,用蒸馏水定容到20.0 mL,振荡混匀成10 mg/mL的阳离子淀粉糊。沸水浴加热半小时。冷却至室温,以蒸馏水为空白对照,波长650 nm下采用分光光度计测定透光率。
1.2.6 凝沉性的测定
称取0.20 g淀粉样品置于20 mL刻度试管内,调节pH值为6.5,用蒸馏水定容到体积20.0 mL,振荡混匀成10 mg/mL的阳离子淀粉糊。沸水浴加热半小时,冷却至室温后,3 000×g的重力加速度下离心15 min,波长650 nm下测定吸光度;4℃冰箱内使上清液静置7 d,取出后回至室温,在3 000×g的重力加速度下离心15 min,波长650 nm下测定吸光度。
1.2.7 溶解指数的测定
淀粉配成2%的淀粉糊,在高于糊化温度加热搅拌30 min,以3 000×g的重力加速度离心l5 min,将上清液用烘箱105℃烘干至恒重,称量得到溶解淀粉质量A,溶解指数计算:
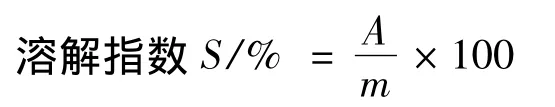
式中:A,上清液恒重质量,g;m,样品干基质量,g。
1.2.8 RVA测定黏度
以SUPER-3RVA型快速黏度分析仪测定糊化性质,称取2.5 g的淀粉,25 g蒸馏水在样品中混匀,采用标准方法进行升温。RVA曲线主要参数包括峰值黏度(peak viscosity)、谷值黏度(trough viscosity)、衰减值(breakdown)、最终黏度(final viscosity)、回凝值(setback)、糊化温度(gelatinization temperature)。
1.2.9 冻融稳定性测定
配制60 mg/mL的淀粉乳,沸水浴中加热糊化30 min,再冷却至室温。取定量倒入离心管中,加盖置于-18~-20℃冰箱内冷却,24 h后取出,室温下自然解冻,然后在3 000×g条件下离心20 min,弃去上清液,称取沉淀物质量,计算析水率,每天重复测定析水率直到析水率稳定不变。
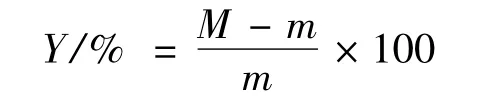
式中:Y,析水率;M,淀粉糊质量;m,沉淀物质量。
2 结果与分析
2.1 阳离子淀粉样品
通过湿法和超声湿法2种工艺制备了取代度不同的8个阳离子淀粉样品,样品见表1,通过对2种工艺各4个相近取代度样品的性质分析,研究超声预处理工艺阳离子淀粉与湿法阳离子淀粉性质的差异以及优缺点。
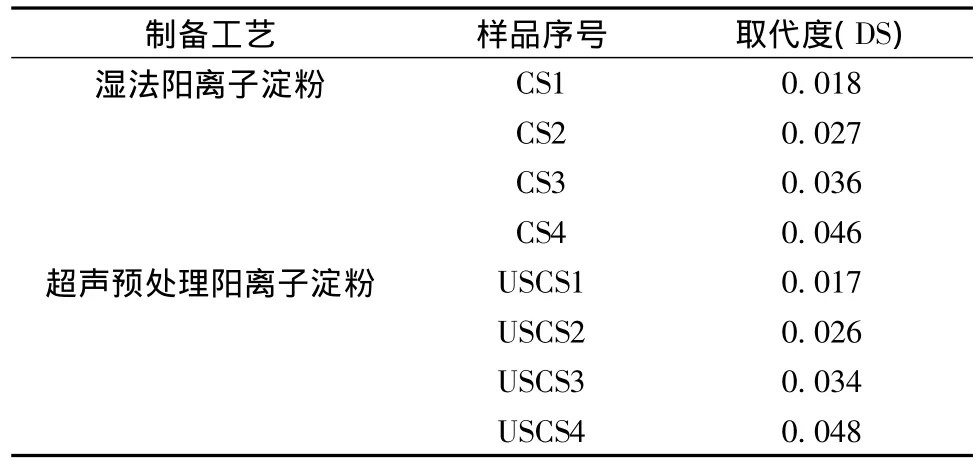
表1 用于性质研究的样品Table 1 Starch for properties research
2.2 超声预处理对阳离子淀粉分子质量分布的影响
以玉米淀粉作对照样品,测定不同取代度的湿法及超声湿法阳离子淀粉的分子质量,研究超声预处理对其分子质量分布的影响。由表2可以看出,随着取代度增大,支链部分所占比例逐渐减小,直链部分所占比例逐渐增加,且支链淀粉分子质量降低,直链淀粉分子质量增大,即支链淀粉逐渐转化为直链淀粉及低分子质量链段。
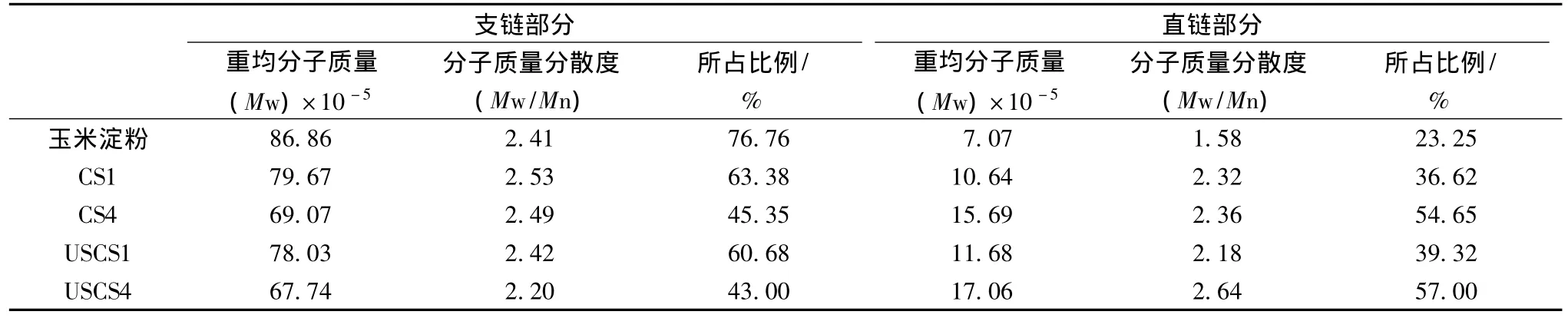
表2 超声预处理对湿法阳离子淀粉分子量的影响Table 2 The effect of ultrasonic pretreatmen onmolecular weightof cationic starch
在相同取代度的情况下,超声预处理的阳离子淀粉样品的支链淀粉的重均分子质量比湿法淀粉的降低了2.0%~2.3%,直链部分重均分子质量增大。在用超声波处理蜡质大米淀粉[6]、小麦淀粉[7]、壳聚糖[8]等的研究中,也发现支链淀粉分子质量降低。这可能是机械切断化学键作用和自由基的氧化还原的共同作用引起的。介质质点在超声波作用下产生高速度和加速度,对淀粉分子产生强机械作用和强剪切力,导致其化学键断裂而降解,并且发生自由基增殖,其氧化还原作用产生连续的对分子链的破坏作用,造成支链淀粉链断裂而转化为低分子质量链[9]。
表1显示,相同取代度的超声预处理,阳离子淀粉的支链分子质量分散度小于普通湿法淀粉,在试验范围内,减小幅度为4.3% ~11.6%。直链淀粉分散度没有明显变化趋势。即超声处理使得支链淀粉分子质量分布更集中。直链淀粉及低分子重组分未发生明显降解。这说明淀粉链越长或支链越多,超声波对其影响越大,这与Jacobs[10]等人的研究结果一致。淀粉结晶区主要由大分子质量的支链淀粉组成,支链淀粉分子的降解,可能会打破紧密的结晶区结构,从而提高淀粉分子的反应活性。
2.3 超声预处理对阳离子淀粉热性质的影响
由表3可知,阳离子淀粉凝胶化温度随着取代度提高而降低,较高取代度的超声预处理阳离子淀粉凝胶化起始温度(To)、峰值温度(Tp)、终止温度(Tc)都低于传统湿法的阳离子淀粉,取代度0.034的超声预处理阳离子淀粉(USCS3),凝胶化温度低于取代度为0.036的湿法阳离子淀粉(CS3),说明超声预处理阳离子淀粉的结晶区结构紧密度比湿法阳离子淀粉要低,这可能是因为超声作用使淀粉支链部分断链、降解,导致淀粉的结晶区的结构疏松,这种变化可能会促进醚化反应的进行。
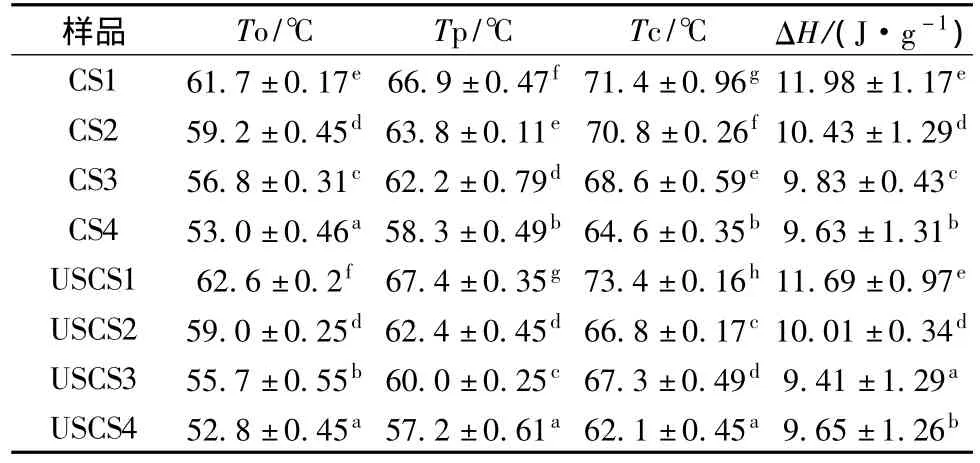
表3 超声预处理对阳离子淀粉热性质的影响Table 3 The effect of ultrasonic pretreatmen on thermal properties of cationic starch
2.4 超声预处理对阳离子淀粉黏度的影响
由表4可以看出,超声预处理阳离子淀粉在较高的3个取代度梯度,峰值黏度和衰减值相对湿法阳离子淀粉较高,而回凝值反而较低。峰值黏度发生在溶胀和多聚体溢出导致黏度增加与破裂和多聚物重新排列导致黏度降低之间的平衡点,反映了淀粉的增稠能力。随温度降低,淀粉分子发生重聚和形成凝胶,而回凝值通常与凝胶脱水和液体渗透有关,高回凝值意味着持水性缺陷,易老化。而超声预处理阳离子淀粉的峰值黏度较高,说明超声预处理阳离子增稠能力较强;回凝值较低,说明超声预处理阳离子淀粉的持水性较好,不易老化[11]。
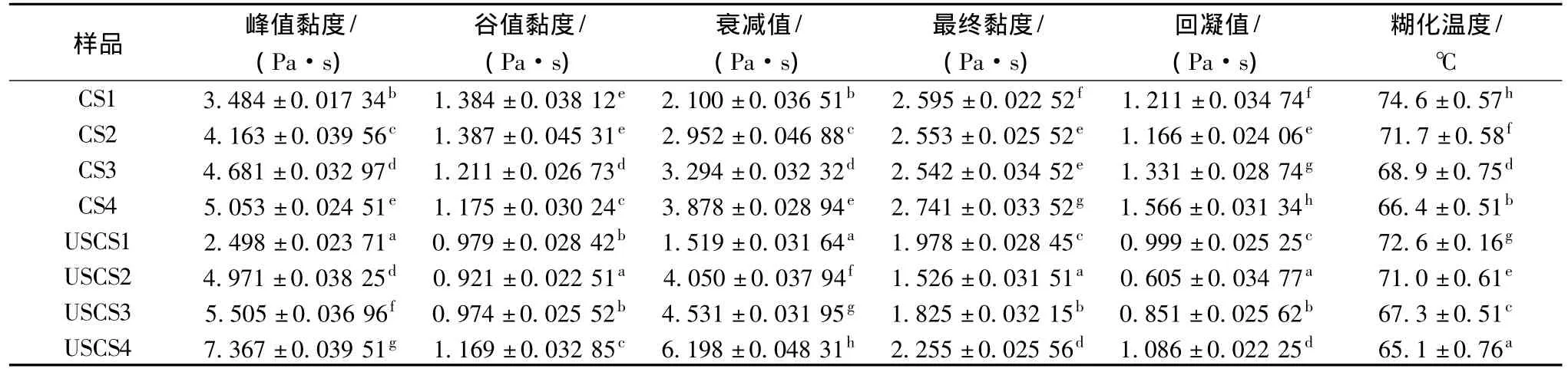
表4 超声预处理对阳离子淀粉黏度的影响Table 4 The effect of ultrasonic pretreatmen on the viscosity of cationic starch
2.5 超声预处理对阳离子淀粉透光率的影响
由图1可知,2种工艺制得的阳离子淀粉透光率都随取代度增加而增大,而超声预处理阳离子淀粉透明度普遍大于湿法阳离子淀粉。影响阳离子淀粉溶液透光率的原因主要有淀粉颗粒溶胀程度和淀粉分子溶解性。溶胀淀粉颗粒直径越大,淀粉分子溶解性越高,则透明度越高[12]。由于淀粉取代度越大,淀粉分子链上阳离子基团越多,淀粉分子亲水性越强,则淀粉的溶解度越高,所以阳离子淀粉透光率随着取代度增加而呈增加趋势;超声波还能在短时间内对淀粉结晶区结构产生破坏作用,颗粒表面受到破坏,淀粉溶胀直径增大,在水溶液中分散性较好,从而使溶液有较低的折光、反光作用,因此超声预处理阳离子淀粉透光率要大于湿法阳离子淀粉。
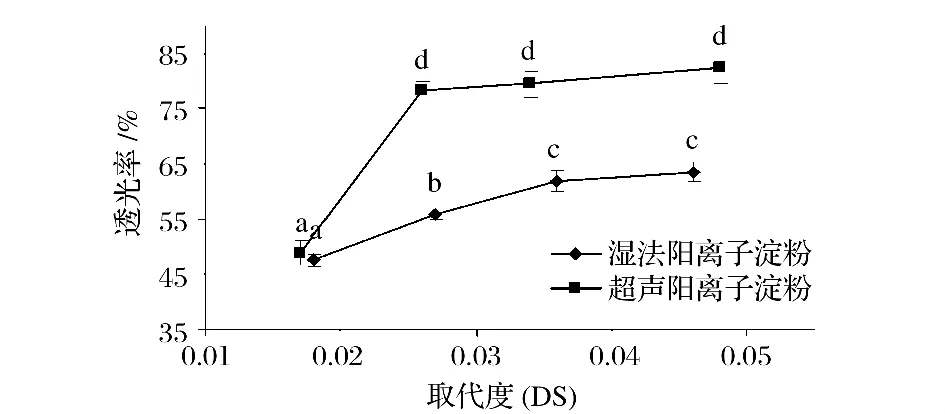
图1 超声预处理对阳离子淀粉透光率的影响Fig.1 The effect ofultrasonic pretreatmen on transmittance of cationic starch
2.6 超声预处理对阳离子淀粉凝沉性的影响
从图2可以看出,超声预处理阳离子作用凝沉值低于湿法阳离子淀粉。这可能是因为超声作用在一定程度上破坏淀粉颗粒结晶区结构,使结晶区的支链淀粉短链更多的发生阳离子化反应,支链淀粉短链带有更多的正电荷,排斥作用增强,缔合作用减弱,所以超声阳离子淀粉的凝沉性相对较低。
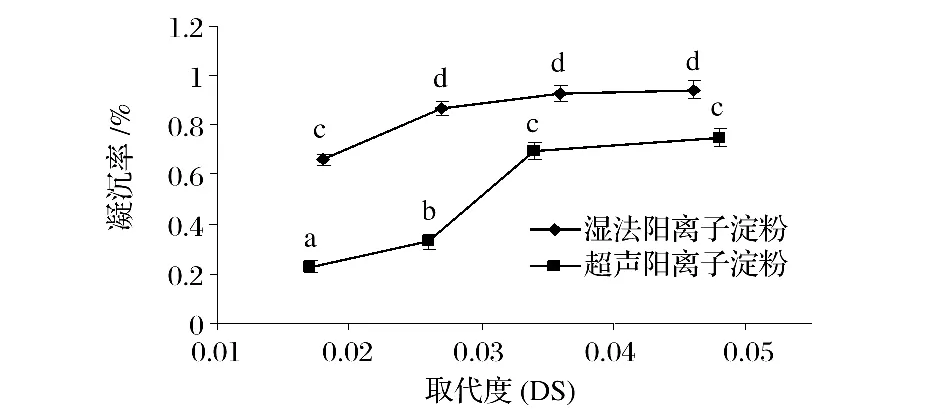
图2 超声预处理对阳离子淀粉凝沉值的影响Fig.2 The effect ofultrasonic pretreatmen on retrogradation of cationic starch
2.7 超声预处理对阳离子淀粉溶解度的影响
原玉米淀粉几乎不溶于水,由于阳离子淀粉在淀粉链上接入了阳离子基团,使其可以在水溶液中带有电荷,从而与水有较好的缔合性,故阳离子淀粉可以有较好的溶解性,取代度是决定阳离子淀粉溶解度的重要因素。该试验考察了2种工艺阳离子淀粉的随取代度不同而变化的溶解性质。
由图3可以看出,随着取代度的增大,溶解指数逐渐增大,湿法阳离子淀粉在取代度达到0.046时,溶解指数达到97.25%,超声预处理阳离子淀粉在取代度达到0.048时,溶解指数达到97.15%,而湿法阳离子淀粉与超声预处理阳离子淀粉没有明显溶解性差异。一方面是随着取代度增大,阳离子基团的接入消弱了淀粉分子依靠氢键的有序聚合作用,淀粉颗粒的紧密结构受到破坏,较易溶胀分散在水溶液中[13];另一方面由于淀粉分子与季铵基结合后,淀粉分子带有阳离子基团,静电斥力导致淀粉颗粒在溶液中倾向于分散,同时带有电荷是淀粉水合性质增强,因此,随着醚化剂添加量的增加,取代度逐渐增大,溶解度也随之增大。
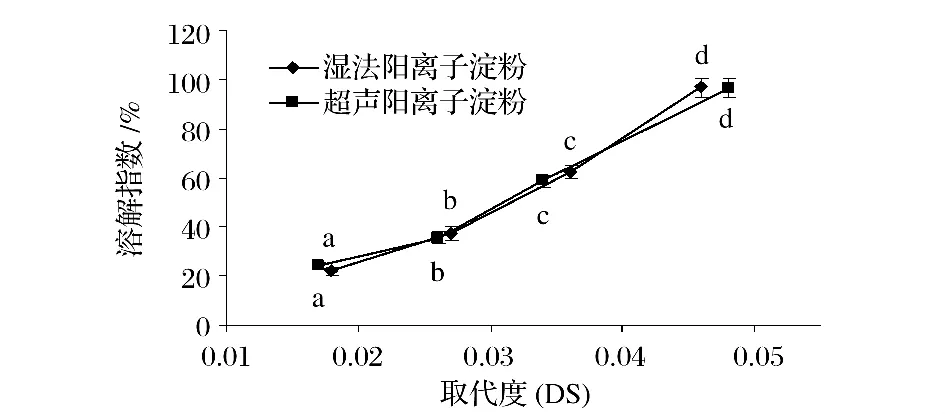
图3 超声预处理对阳离子淀粉溶解指数的影响Fig.3 The effect ofultrasonic pretreatmen onsolution index of cationic starch
2.8 超声预处理对阳离子淀粉冻融稳定性的影响
从图4可以看出,随着取代度的提高,同样冷冻时间阳离子淀粉的析水率降低,且析出同样水量所需要的冻融循环时间增多,说明随着取代度增大阳离子淀粉析水率降低,冻融稳定性增强。随着淀粉冷冻时间延长,凝胶淀粉分子间相互缔合作用增强,淀粉分子链趋向平行形成胶束,水分子从中洗出,所以随冷冻时间延长析水率提高,而支链淀粉长时间的分子重排是淀粉凝胶析水的主要原因。阳离子淀粉由于接入了阳离子基团增大了分子间空间位阻,且阳离子基团本身有水缔合作用,导致阳离子淀粉凝胶随取代度增大持水性增强[14-15]。超声预处理阳离子淀粉析水率普遍低于湿法阳离子淀粉,原因可能是超声使淀粉结晶区接入更多阳离子基团,使支链淀粉取代度增大,在冷冻过程中分子链难以趋向平行排布而形成胶束析出水分。
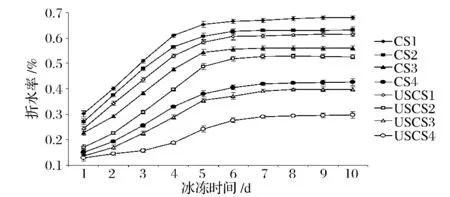
图4 超声预处理对阳离子淀粉冻融稳定性的影响Fig.4 The effect ofultrasonic pretreatmen on freeze-thaw stability of cationic starch
3 结论
超声预处理工艺对阳离子淀粉淀粉的分子质量分布和糊液性质有明显影响:超声预处理使阳离子淀粉支链淀粉重均分子质量降低2.0% ~2.3%,分子质量分散度降低4.3%~11.6%。分子结构的改变带来了湿法阳离子淀粉糊液性质的变化,透光率、冻融稳定性及糊液黏度提高,凝沉值和糊化温度降低,溶解指数没有发生显著改变。
[1] 张燕萍.变性淀粉制造与应用[M].北京:化学工业出版社,2000.
[2] 曹龙奎,李凤林.淀粉制品生产工艺学[M].北京:中国轻工业出版社,2008.
[3] ZHU Jie,LI L,CHEN L,et al.Study on supramolecular structural changes of ultrasonic treated potato starch granules[J].Food Hydrocolloids,2012,29(1):116-122.
[4] Jambrak A R,Herceg Z,Šubari ć D,et al.Ultrasound effect on physical properties of corn starch[J].Carbohydrate Polymers,2010,79(1):91-100.
[5] 徐正康,罗发兴,罗志刚.超声波在淀粉制品中的应用[J].粮油加工与食品机械,2004(12):60-64.
[6] Isono Y,Kumagal T,Watanabe T.Ultrasonic degradation ofstarch[J].Bioscienee Biotechnology Biochemistry,1994,58:1 799-1 802.
[7] Seguchi M,Higasa T,Mori T.Study of wheat starch structuresby sonication treatment[J].Cereal Chemistry,1994,71(6):636-639.
[8] Czechowska-Biskup R.Degradation of chitosan and starch by 360-kHz ultrasound [J].Carbohydrate Polymers,2005,60:175-184.
[9] Castro J V,Ward R M,Gilbert R G.Measurement of the molecular weight distribution of debranched starch[J].Biomacromolecules,2005,6(4):2 260-2 270.
[10] Jacobs A,Delcour J S.Hydrothermal.modifications of granular starch,retention of the granular structure:a review[J].Journal of Agriculture Food Chemistry,1998,46(8):2 895-2 905.
[11] 蔡旭冉,顾正彪,洪雁.瓜尔胶和黄原胶对马铃薯淀粉及其变性淀粉糊化和流变性质的影响[J].食品科学,2011,32(17):22-26.
[12] 高静,罗志刚,董华壮.低取代度木薯淀粉醋酸酯的制备及理化性质的研究[J].现代食品科技,2008,24(8):756-759.
[13] 高和军,付洪权,胡星琪.疏水性阳离子淀粉的制备与应用[J].高分子材料科学与工程,2011,27(9):164-167.
[14] 袁怀波,刘文宏,刘军.阳离子糯米淀粉的制备及性质研究[J].食品科学,2009,30(24):99-102.
[15] 张凤,董海洲,侯汉学.半干法制备低取代度阳离子淀粉的工艺研究[J].食品与发酵工业,2007,33(9):113-117.

