解淀粉芽孢杆菌黄曲霉毒素B1裂解酶的分离纯化及鉴定*
蔡国林,徐铭乾,李秋,王珊珊,杜祖波,陆健
1(江南大学工业生物技术教育部重点实验室,江苏无锡,214122)
2(江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡,214122)
3(江南大学 生物工程学院,江苏 无锡,214122)4(山东鲁花集团有限公司,山东莱阳,265200)
黄曲霉毒素是一类主要由黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)产生的带有一个氧杂萘邻酮和一个双呋喃环的强毒性次级代谢产物[1]。目前已经鉴定出的黄曲霉毒素有20多种,而黄曲霉毒素B1(Aflatoxin B1,AFB1)是粮食中最常见的,也是毒性最大的,被世界卫生组织定为1A类致癌物质[2]。
AFB1在粮食中的存在严重威胁着动物以及人体的健康,研究高效、安全降解AFB1已成为当前关注的热点。在各种AFB1去除方法中,由于物理法和化学法存在破坏粮食的营养物质成分或造成化学物质残留和影响适口性等不足,目前生物脱毒普遍被认为是最有前途的方法[3-4]。生物脱毒是指毒素分子上的毒性基团被微生物或是其代谢产物分解破坏,同时产生无毒降解产物的过程[5]。在自然界已经发现包括细菌,真菌(含酵母)在内的多种微生物能够吸附真菌毒素或是分泌降解真菌毒素的物质,这些微生物的脱毒机理主要有:菌体细胞对毒素的吸附作用和发酵产生的酶对毒素的降解作用。
在前期研究中,我们筛选到1株不但能明显抑制黄曲霉生长,且能高效降解AFB1的安全菌株,目前已保藏至中国普通微生物菌种保藏管理中心,命名为解淀粉芽孢杆菌CGMCC-9021。对解淀粉芽孢杆菌CGMCC-9021降解AFB1的特性研究发现,AFB1的降解不是依赖菌体吸附,而是由于其代谢产生的胞外活性物质,这种活性物质是一种蛋白质[6]。本研究将通过硫酸铵沉淀、阴离子交换色谱和凝胶过滤色谱分离纯化该活性物质,并通过质谱对其进行鉴定,为今后的高效生产提供理论依据。同时,采用荧光色谱技术初步分析裂解酶对AFB1的降解机理。
1 材料与方法
1.1 菌种
解淀粉芽孢杆菌CGMCC-9021由江南大学粮食发酵工艺与技术国家工程实验室分离,并保藏至中国普通微生物菌种保藏管理中心。
1.2 培养基
牛肉膏 5 g/L,蛋白胨 10 g/L,NaCl 5 g/L,葡萄糖 10 g/L,pH 7.0。
1.3 发酵液制备及硫酸铵沉淀
解淀粉芽孢杆菌CGMCC-9021经活化后,接种至培养基中,37℃,200 r/min振荡培养48 h。发酵液经5 000 r/min离心10 min后,取上清液进行硫酸铵分级沉淀。4℃,10 000 r/min离心10 min,将各个部分沉淀蛋白用20 mmol/L磷酸盐缓冲液(pH 7.0)复溶,透析过夜,之后加入4 μg/mL的 AFB1,使其最终含量为100 ng,最终质量浓度达到20 μg/L。37℃,200 r/min振荡反应72 h,测定各个部分沉淀蛋白对AFB1的降解效果,选取降解效果最明显的部分作为活性物质的蛋白粗提液。
1.4 阴离子交换色谱
透析后的蛋白粗提液通过0.22 μm微孔滤膜过滤。将过滤后的蛋白溶液,上样于HiPrep 16/10 DEAE FF离子交换柱(预装柱),用磷酸盐缓冲液(20 mmol/L、pH 7.0)冲洗,然后用含1 mol/L NaCl的磷酸盐缓冲液(20 mmol/L、pH 7.0)进行恒梯度洗脱,流速5 mL/min,每管收集2 mL。以洗脱体积为横坐标,以280 nm吸收值为纵坐标绘图。并收集主要吸收峰对应的蛋白质溶液,测定其对AFB1的降解效果。
1.5 凝胶过滤色谱
收集阴离子交换色谱后检测有AFB1降解能力的蛋白质溶液,上样于Superdux 75 10/300GL凝胶过滤层析柱(预装柱),用磷酸盐缓冲液(20 mmol/L、pH 7.0)进行冲洗,流速0.5 mL/min,每管收集1 mL。以洗脱体积为横坐标,以280 nm吸收值为纵坐标绘图。并收集主要吸收峰对应的蛋白质溶液,测定其对AFB1的降解效果。最后,收集具有降解AFB1活性的部分,进行Tricine-SDS-PAGE鉴定和质谱分析。
1.6 蛋白含量测定
采用考马斯亮蓝G250法测定蛋白质浓度,以牛血清蛋白标准液制作标准曲线。
1.7 Tricine-SDS-PAGE
Tricine-SDS-PAGE 检测方法参照孙雪文等[7],凝胶制作采用3层不连续胶的系统,先灌下边的分离胶和夹层胶,然后铺水层,胶凝固后,除去水层,灌制上面的浓缩胶,小心插入梳子,静置。内槽加入负极电泳缓冲液,外槽加入正极电泳缓冲液,开始时电压为40 V,待样品完全离开样品孔后,70 V恒压电泳至结束。将胶放入固定液(50%甲醇,10%乙酸)中固定30 min后染色1.5 h,脱色过夜。
1.8 质谱鉴定(MALDI-TOF/TOF)
取Tricine-SDS-PAGE胶上目标条带,进行手动切胶,将挖取的蛋白点凝胶转移至EP管中,加入200 μL脱色液(30%乙腈/0.1%TFA的碳酸氢铵溶液),振荡脱色至胶粒呈无色。弃掉脱色液,胶粒用50 μL的乙腈脱水2次,得到白色胶粒。每个脱水后的胶粒加入5 μL胰蛋白酶溶液,置于4℃吸收30~60 min,使胶粒充分吸胀,结束后吸出未被吸收的酶液,加入20 μL、25 mmol/L碳酸氢铵溶液覆盖胶粒,37℃水浴酶解20 h。酶解液吸出后加到新的EP管中,原管中加入20 μL、60%乙腈/0.1%TFA 萃取液,超声15 min,冻干备用。
冻干的酶解样品用 3 μL、0.1%TFA复溶,将0.7 μL CHCA基质溶液与0.7 μL酶解液先后点在Anchorchip靶板中心的疏水区。再用2 μL,0.1%TFA进行脱盐。一级质谱采用正离子模式,二级质谱分析几个强度较高的一级图谱峰,用Mascot软件(http://www.matrixscience.com)在NCBInr数据库中对蛋白质的质谱数据进行搜索匹配,Mascot分值大于59即可认定物质鉴定有效[8]。
1.9 AFB1降解产物的荧光光谱分析
将 25 μL AFB1标准溶液,975 μL 无菌的降解AFB1的活性物质溶液加入棕色反应瓶中,使得混合溶液中AFB1的质量浓度为1 000 ng/mL,37℃避光反应0,1,3 d。3倍体积于反应液的三氯甲烷进行液相萃取AFB1,之后加入1.5 mL 50%的甲醇水溶液振荡溶解,在365 nm的激发波长下测定不同反应条件下的 AFB1荧光强度[9]。
2 结果与讨论
2.1 硫酸铵沉淀
取100 mL 发酵液分别进行以下梯度的硫酸铵分级沉淀:0% ~20%,20% ~40%,40% ~60%,60% ~80%和80%~完全饱和,测定各个部分沉淀蛋白对AFB1的降解效果,结果见图1。

图1 硫酸铵分级沉淀各部分对AFB1的降解作用Fig.1 Ammonium sulfate precipitation classification effect on degrading AFB1
从图1(a)中可以发现0% ~20%,20% ~40%,40%~60%沉淀区间蛋白溶液都具有较高的降解AFB1活性,说明降解AFB1的活性物质在0% ~60%的沉淀区间内,由于沉淀区间过宽会造成杂蛋白的过多带入,所以需要对该区间进一步的分级,以求获得最优化的沉淀区间。对0%~60%的沉淀区间进一步分级沉淀,测定各个部分沉淀蛋白对AFB1的降解效果,结果如图1(b)所示。从图1(b)中可以发现0%~40%硫酸铵沉淀区间的蛋白溶液具有更强的降解AFB1能力,说明活性物质在该区间得到更好的分离。而且随着硫酸铵沉淀度的不断增加,0% ~50%、0%~60%沉淀区间蛋白对AFB1的降解活性急剧下降,几乎检测不到相应活性,说明降解AFB1的活性物质不能够耐受高浓度的盐溶液,在该环境下使其失去降解AFB1的活性。
2.2 阴离子交换色谱
将40%硫酸铵沉淀的蛋白粗提液通过0.22 μm微孔滤膜后,采用HiPrep 16/10 DEAE FF色谱柱(柱体积为20 mL,上样量为30 mL)进行分离纯化,用磷酸盐缓冲液(20 mmol/L,pH 7.0)冲洗,然后用含1 mol/L NaCl的磷酸盐缓冲液(20 mmol/L,pH 7.0)进行恒梯度洗脱,设定流速为5 mL/min,每管收集2 mL,绘制对应的OD280图谱如图2所示。
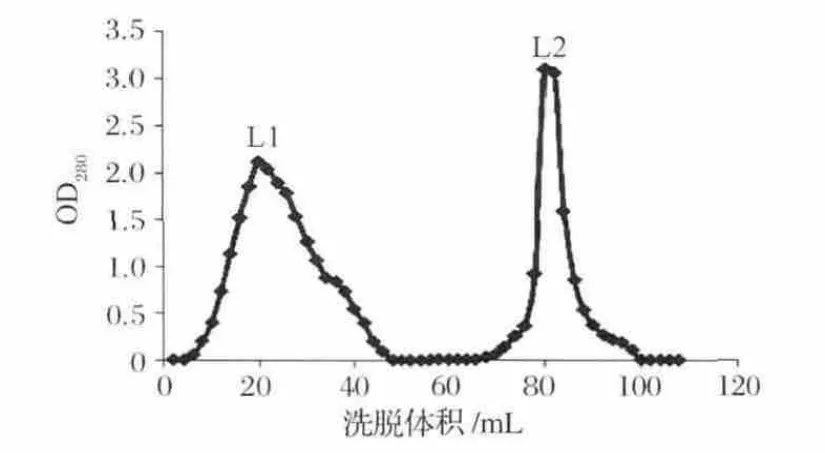
图2 HiPrep 16/10 DEAE FF色谱柱色谱洗脱图谱Fig.2 Chromatography of active substance on HiPrep 16/10 DEAE FF
从图2可以看出蛋白粗提液经离子交换色谱层析后得到2个色谱峰,且获得了较好的分离效果。收集离子交换色谱峰1、2对应的蛋白质溶液,分别命名为L1、L2。分别加入 4 μg/mL 的 AFB1,使其最终含量为100 ng,37 ℃,200 r/min振荡反应 72 h,测定L1、L2对AFB1的降解情况。其中,L2具有较高的降解AFB1的活性,其降解率为80.3%,L1的降解率为17.0%。因此,降解AFB1的活性物质主要集中于第2个色谱峰,收集第2个色谱峰,并对其蛋白浓度、体积进行测定,储存于4℃以备用。
2.3 凝胶过滤色谱分析
将离子交换色谱的L2(第2个色谱峰)所收集的蛋白溶液通过0.22 μm微孔滤膜后,采用Superdux 75 10/300GL(柱体积为25 mL,上样量为0.5 mL),用磷酸盐缓冲液(20 mmol/L,pH 7.0)进行冲洗,设定流速为0.5 mL/min,每管收集1 mL,以洗脱体积为横坐标,以280 nm吸收值为纵坐标绘图,得到对应的OD280图谱如图3所示。通过凝胶过滤色谱的进一步分离纯化将原有的L2色谱峰分离为4个色谱峰,且获得了较好的分离效果。收集凝胶过滤色谱峰1、2、3、4 对应的蛋白质溶液,分别命名为 N1、N2、N3、N4。分别加入4 μg/mL的 AFB1,使其最终含量为100 ng,37 ℃,200 r/min振荡反应 72 h,测定其对AFB1的降解效果,其中N3具有明显降解AFB1的活性,其降解率为32.4%。收集第3个色谱峰,并对其蛋白浓度、体积进行测定,储存于4℃以备用。
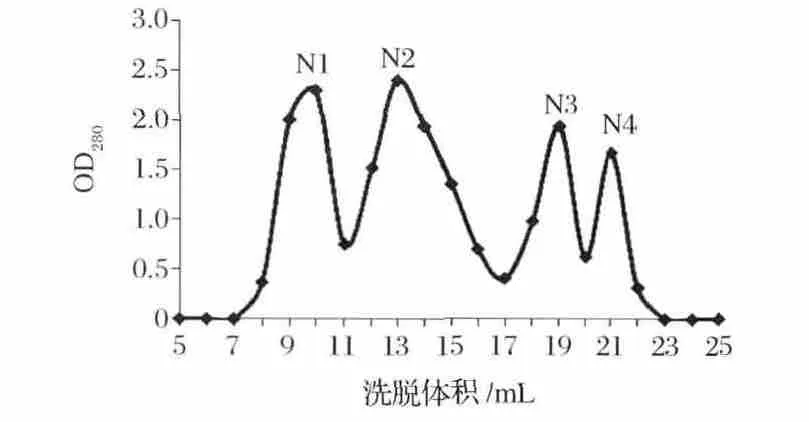
图3 Superdux 75 10/300GL色谱柱色谱洗脱图谱Fig.3 Chromatography of active substance on Superdux 7510/300GL
2.4 Tricine-SDS-PAGE分析
收集分离纯化的各个步骤中具有降解AFB1活性的成分进行Tricine-SDS-PAGE分析,电泳结果如图4所示。

图4 Tricine-SDS-PAGE图谱Fig.4 The map of Tricine-SDS-PAGE
从Tricine-SDS-PAGE图谱上可以看出5个泳道中均具有1条共有的条带,而且N3只有该条带本身,说明其可能为降解AFB1的活性物质,且分子质量为27 ku左右。
2.5 降解AFB1活性物质的质谱鉴定
对Tricine-SDS-PAGE泳道5中的蛋白条带1挖点后进行酶切,然后将其进行串联质谱(MALDITOF/TOF)分析和蛋白数据库(NCBInr)检索,匹配结果见表1,质谱分析见图5。该蛋白点鉴定结果为lytic enzyme L27[Bacillus subtilis](登录号为 gi|3986320),其匹配总得分为494,蛋白质分子质量(Mr)为27 479,蛋白质等电点(pI)为6.65。刘玉岭[10]对具有抗菌能力的解淀粉芽孢杆菌的活性物质进行蛋白质分离纯化,获得lytic enzyme L27和beat-1,3-1,4-glucanase两种均具有抗菌活性的蛋白。裂解酶主要作用于肽聚糖上的糖苷键和肽键,其中酰胺酶和肽链内切酶水解肽侧链和交联桥之间的氨基或肽键连接,同时因为肽聚糖的酰胺连接和氨基糖之间的β-1,4糖苷键连接在细菌种间往往是保守的,所以其相应的裂解酶就具有更广的裂解谱[11]。目前关于裂解酶的研究主要是集中于抗菌的研究中,该酶对于AFB1等毒素裂解作用的研究未见报道。
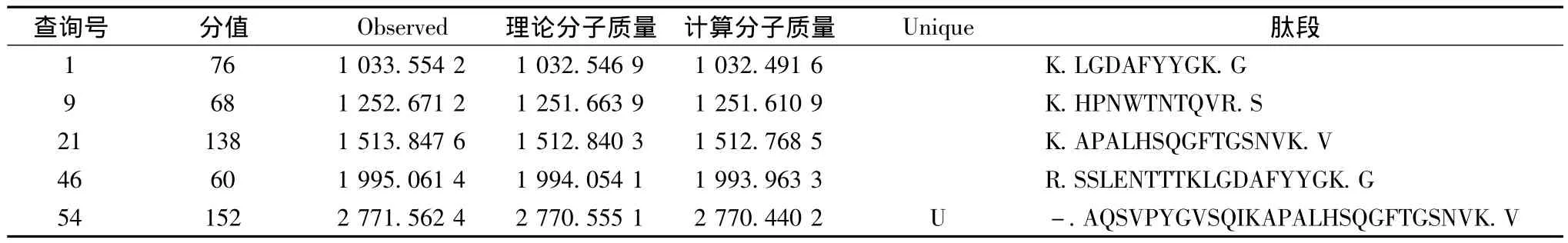
表1 质谱分析中匹配的肽段序列信息Table 1 The information of match peptide sequence by mass spectrometry analysis

图5 蛋白质的质谱分析结果Fig.5 The analysis maps of mass spectrometry
2.6 解淀粉芽孢杆菌裂解酶降解AFB1的可能机理
AFB1本身具有荧光特性,在紫外光照射下可发出蓝色或紫色荧光。而其荧光特性与其化学结构相关。AFB1经过解淀粉芽孢杆菌裂解酶的不同时间处理后,其荧光特性发生了明显的改变,随着反应时间的增加,AFB1的荧光特性不断降低,也即其降解产物的化学结构发生了改变,荧光特性消失,如图6所示。Lee等[12]发现改变AFB1的戊酮环、呋喃环及内酯环上取代基的结构,不会影响AFB1荧光特性,而内酯环结构打开后,AFB1荧光特性消失;另外对AFB1以及失去内酯环结构后的AFD1的致突变性和毒性进行对比研究,通过Ames实验发现AFD1的致突变能力几乎消失,比AFB1降低450倍,而鸡胚的毒性试验发现AFD1的毒性降低18倍,所以内酯环为AFB1的主要毒性结构,其结构的改变也使得AFB1的毒性和致突变能力大大降低。另外,筛选降解AFB1的解淀粉芽孢杆菌CGMCC-9021时采用的培养基是以香豆素为唯一碳源,香豆素是所有黄曲霉毒素的基本分子结构,能够利用香豆素生长的微生物也能分解AFB1,而内酯环结构是香豆素与AFB1共有的可能改变的结构。因此解淀粉芽孢杆菌裂解酶对AFB1的作用位点可能是内酯环结构,如图7所示,需要进一步实验证实。

图6 解淀粉芽孢杆菌裂解酶对AFB1荧光特性的影响Fig.6 Effect of lytic enzyme on emission spectra of AFB1
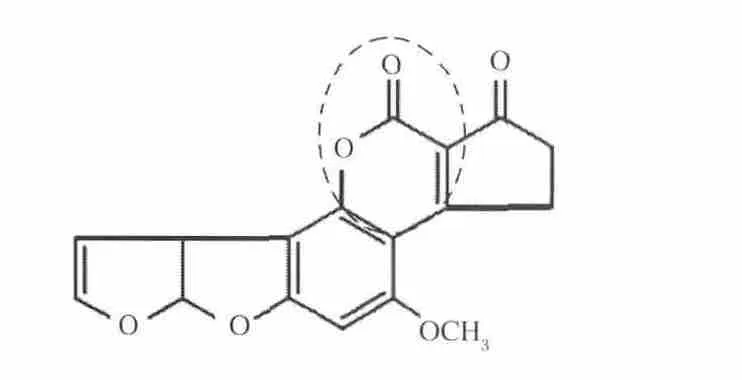
图7 解淀粉芽孢杆菌裂解酶对AFB1的可能作用位点Fig.7 Possible action site of lytic enzyme on AFB1biodegradation
3 结论
通过硫酸铵分级沉淀、DEAE FF阴离子交换层析和Superdux 75凝胶过滤层析等一系列的蛋白质分离纯化以及Tricine-SDS-PAGE和质谱鉴定获得降解AFB1的活性物质为一种分子质量(Mr)约为27ku,蛋白质等电点(pI)为6.65的解淀粉芽孢杆菌裂解酶(lytic enzyme)。通过荧光光谱对经过解淀粉芽孢杆菌裂解酶不同时间处理后AFB1进行分析,发现随着反应时间的增加,AFB1的荧光强度不断降低,也即改变了AFB1原有结构中的内酯环,荧光特性消失,与此同时其毒性消失,实现了对AFB1的真正降解。
[1] Mishra H N,Das C.A review on biological control and metabolism of Aflatoxin[J].Critical Reviews in Food Science and Nutrition,2003,43(3):245-264.
[2] 计成.霉菌毒素与饲料食品安全[M].北京:化学工业出版社,2007.
[3] 李超波,李文明,杨文华,等.降解黄曲霉毒素微生物筛选中降解与吸附结合作用的区分[J].食品与发酵工业,2012,38(5):17-21.
[4] 孙丰芹,金青哲,王兴国,等.去除黄曲霉毒素B1的菌株筛选[J].食品与生物技术学报,2011,30(2):273-277.
[5] 孙玲玉,柴同杰.黄曲霉毒素生物降解的研究进展[J].山东农业大学学报(自然科学版),2012,43(4):645-647.
[6] 徐铭乾,蔡国林,朱德伟,等.黄曲霉毒素B1脱毒菌株的分离鉴定及在花生粕中的应用[J].中国油脂,2015,40(3):20-24.
[7] 孙雪文,周金燕,邓洪渊,等.有效分离1 kDa分子量环脂肽的电泳方法[J].生物技术,2005(6):47-49.
[8] 孙鹏飞.酱油二次沉淀中蛋白质的初步分离[D].无锡:江南大学,2014.
[9] 徐丹.酿造酱油中黄曲霉毒素B1的产生及其控制研究[D]:无锡:江南大学,2012.
[10] 刘玉岭.芽孢杆菌抗菌蛋白lytic enzyme L27和B-1,3-1,4-glucanase抗菌协同作用研究[D].重庆:西南大学,2007.
[11] 王琰,陆承平.噬菌体裂解酶的抗菌特性[J].微生物学报,2009(10):1 277-1 281.
[12] Lee L S,Dunn J J,DeLucca A J,et a1.Role of lactone ring of aflatoxin B1in toxicity and mutagenicity[J].Cellular and Molecular Life Sciences,1981,37(1):16-17.

