Thermobifida fusca葡萄糖异构酶在枯草杆菌中的表达*
邓辉,陈存武,孙传伯,韦传宝
1(皖西学院 生物与制药工程学院,安徽六安,237012)
2(六安市蛋白质分离与纯化研究中心,安徽 六安,237012)
D-木糖异构酶(xylose isomerase XIase.EC 5.3.1.5)能可逆催化D-木糖和D-木酮糖之间的异构转化,也能可逆催化D-葡萄糖为D-果糖之间的异构转化,所以在食品工业中也被称为葡萄糖异构酶(GI-ase)[1]。GIase 是高果糖浆(high fructosesyrup,HFS)工业的关键用酶,由于高果糖浆比蔗糖更有益于健康,并有着良好的发酵性能和适宜的口感,被越来越广泛地应用在食品和饮料工业中。
为大幅提高GIase的产量和生产强度,将GIase的基因过量表达是最有效的途径之一。常用的基因工程宿主菌有大肠杆菌、枯草杆菌以及酵母[2]。在本实验室前期工作中,一种来源于嗜热菌Thermobifida fusca的GIase基因xylA在E.coli中成功克隆表达,并进行了酶学性质和转化率的分析,以葡萄糖为底物该酶的Km和Kcat值分别为190 mmol/L和35 s-1[3],高的催化活力、高的转化率将使该酶成为改进葡萄糖异构化食品工业过程中潜力巨大的候选者。然而大肠杆菌在过量表达外源蛋白时,易形成不溶性包涵体或聚集体,同时存在着可能对人体有害的内毒素。枯草杆菌作为一种工业中应用广泛的工程菌,在一些方面具有无可比拟的优势[4-5]:首先,枯草杆菌是国际公认的食品安全菌株;其次,种属间的密码子偏好性不明显;最后,同大肠杆菌一样,枯草杆菌的表达机理也已被深入研究。但关于GIase在枯草杆菌中的表达还研究较少,HUANG[6]等把大肠杆菌的GI-ase基因和Bacillus licheniformis青霉素酶的启动子相融合,使 GIase 基因在 B.subtilis成功表达,Lee[7]等将来源于Clostridium thermosulfurogenes的GIase基因克隆到大肠杆菌和枯草杆菌的穿梭质粒pMG1,其表达量为1.54 U/mg,高于该酶在野生菌的表达量0.29 U/mg。虽然枯草杆菌具有强大的蛋白分泌能力,但可能是因为GIase是胞内酶,两位研究者测定的都是胞内酶活。在本实验研究中我们尝试选用不同诱导方式的枯草杆菌表达系统在胞内表达Thermobifida fusca GIase,并进一步研究培养基、温度和pH等条件对重组枯草杆菌发酵产酶的影响。
1 材料与方法
1.1 菌种和质粒
Thermobifida fusca WSH03-11菌株,克隆宿主菌:E.coli JM109,B.subtilis WB600(his-nprB-nprE18-aprE-epr-bpf-mpr),表达质粒 pHCMC04、pAL12 和pMA09均为本实验室保藏。pMD18-T simple购自大连宝生物工程公司。
1.2 试剂
营养琼脂、蛋白胨、酵母抽提物购自Oxoid,工具酶、基因组DNA提取试剂盒、PCR扩增试剂盒、DNA胶回收试剂盒均购自上海生工生物工程有限公司,PCR引物由上海生工生物工程有限公司合成。其他试剂均为国产分析纯。
1.3 培养基
LB培养基,Amp终浓度100 μg/mL。TB:甘油5 g/L,蛋白胨12 g/L,酵母粉24 g/L,K2HPO416.4 g/L,KH2PO42.3 g/L。
1.4 重组质粒pHGI、pMGI和pAGI的构建
提取Thermobifida fusca的基因组DNA,并以此为模板PCR扩增GIase酶基因。PCR反应条件:94℃8 min;94℃ 45 s,60℃ 45 s,72℃ 130 s,循环30次;72℃ 10 min。PCR引物如下:
PH1(5’-3’):A/CTAGTATGAGCAACTACCAGCCCACACCCG
PH2(5’-3’):G/GATCCTTAGCGCACGCCCAGGAGGTAGT
PM1(5’-3’):CATATGAGCAACTACCAGCCCACACCCGAG
PM2(5’-3’):G/GATCCTTAGCGCACGCCCAGGAGGTAGT
PA1(5’-3’):G/GATCCATGAGCAACTACCAGCCCACACCCG
PA2(5’-3’):T/CTAGATTAGCGCACGCCCAGGAGGTAGT
引物对PH1、PH2分别含SpeI和BamH I的限制性酶切位点(载体不含信号肽序列),引物对 PM1、PM2分别含NdeI和BamH I的限制性酶切位点(去除信号肽序列 SestA)。引物对 PA1、PA2分别含BamH I和XbaI的限制性酶切位点(去除信号肽序列SamyQ),分别以引物对扩增得到xylA基因片段,将其克隆、纯化、回收后分别插入E coli-B.subtilis穿梭载体 pHCMC04[8]、pMA09[9]和 pAL12[10]中,其中,pHCMC04的启动子为PxylA,为木糖或IPTG诱导表达;pMA09的启动子为PHpaII,为组成性表达;pAL12启动子为Pdes,为低温25℃诱导表达。分别构建的重组质粒命名为pHGI、pMGI和pAGI。
1.5 枯草杆菌转化及培养
枯草杆菌转化参照Spizizen的方法[14]。挑取转入表达宿主B.subtilis的单克隆于LB培养基生长9 h,按体积分数为1%的接种量将种子发酵液接入50 mL发酵培养基,在37℃摇床培养30 h,其中重组菌WB600/pHGI在培养到 OD600值为 1.5时,添加 4 mmol/L的IPTG诱导表达,WB600/pAGI在培养到OD600值为1.5时,降温到25℃诱导表达,因WB600/pMGI为组成性表达,所以培养条件不作变动。每隔一段时间取样,将发酵液于12 000 r/min离心2 min,除上清液收集菌体,将菌体复溶后超声破壁12 000 r/min,4℃离心10 min,保留上清液、悬浮沉淀待用。
1.6 分析方法
DNA琼脂糖凝胶电泳和表达产物的SDS-PAGE按文献[11]方法进行。GIase活性的测定其异构转化葡萄糖为果糖的活性。反应体系为1 mL,包含5 mmol/L磷酸盐缓冲液(pH 7.5),900 mmol/L D-葡萄糖水溶液,5 mmol/L MgSO4水溶液,0.1 mL适当稀释的酶液。反应体系在70℃水浴10 min,然后用1 mL 0.5mol/L HClO4溶液终止反应。反应体系中的D-果糖通过半胱氨酸-咔唑方法测定[12]。1个酶活力单位(U)定义为:上述反应条件下,1 min内生成的1 μmol D-果糖。菌体的浓度采用分光光度法测定。实验设置3个重复。
1.7 重组枯草杆菌外源蛋白表达条件优化
1.7.1 不同培养基对产酶的影响
采用6种培养基发酵产酶,25 h后测定OD600值和酶活。
1.7.2 培养温度对产酶的影响
在最佳培养基中,分别采用25、30、37℃培养25 h后测定OD600值和酶活。
1.7.3 初始pH对产酶的影响
在最佳培养基和最适温度条件下,调节初始pH分别为 5.5,6.0,6.5,7.0,7.5,8.0,25 h 后测定OD600值和酶活。
2 结果
2.1 重组菌B.subtilis WB600/pHGI、WB600/pM GI和WB600/pAGI的构建与表达
以提取的T.fuscaWSH03-11的 xylA基因(与GenBank Accession No.CP000088序列一致)片段插入pMD18-T simple质粒中,分别采用相应的引物PCR扩增目的基因,纯化回收目的基因后分别与同样酶切纯化回收的枯草芽孢杆菌表达载体pHCMC04、pMA09和pAL12连接,转化大肠杆菌JM109,挑取阳性克隆,提质粒,双酶切鉴定,显示出2条明显的条带,条带大小与预期相符,证明xylA基因已成功连接到E.coli-B.subtilis穿梭载体pHCMC04、pMA09和pAL12中,将重组质粒分别命名为pHGI、pMGI和pAGI。将重组质粒分别转化枯草芽孢杆菌WB600,获得重组枯草芽孢杆菌WB600/pHGI、WB600/pMGI和WB600/pAGI。通过质粒提取和限制性酶切鉴定确认了重组菌构建成功。同时,以空载转化宿主菌WB600为对照,处理方式同上。将上述重组枯草芽孢杆菌 WB600/pHGI、WB600/pMGI和 WB600/pAGI以及含空载质粒的枯草芽孢杆菌WB600/pHCMC04、WB600/pMA09和WB600/pAL12分别接入LB培养基中表达,间隔一定时间取样,测定胞内GIase的酶活。测得重组枯草芽孢杆菌WB600/pHGI、WB600/pMGI和 WB600/pAGI破壁上清液的活力分别为1.1,1.8和1.3 U/mL,而含空载的重组枯草芽孢杆菌对照菌株均检测不到GIase活性。利用质量分数为12%的SDS-PAGE对重组枯草杆菌破壁上清和破壁后沉淀进行检测,在破壁上清和破壁沉淀中均发现与GI酶分子量相对应的约42 kDa处有条带(图1)。实验结果一方面表明构建的3种重组质粒在重组枯草芽孢杆菌胞内均成功表达,且WB600/pMGI的表达量最高;另一方面表明重组枯草芽孢杆菌产酶速度过快,导致细胞破壁沉淀中也含有目的蛋白条带,发酵过程有待近一步优化。

图1 GIASE表达的SDS-PAGE分析Fig.1 SDS-PAGE analysis of the expression of GIase
2.3 重组枯草杆菌外源蛋白表达条件优化
选取上述实验中表达量最高的重组菌株WB600(pMGI)对其表达条件进行进一步优化,因该载体为本底水平表达,对其摇瓶发酵的培养基、温度和初始pH进行优化,并考察最优条件下摇瓶中重组B.subtilis WB600(pMGI)产GIase的发酵过程。
2.3.1 初始培养基对产酶的影响
首先选择适合重组枯草杆菌表达GIase的培养基,将重组菌株置于6种较典型的枯草杆菌培养基中进行培养,测定 OD600值和酶活,其他条件为:初始pH 7.5,发酵温度37℃,发酵时间25 h。在这些培养基中,TB培养基是最利于GIase表达的发酵培养基,发酵液中菌体的浓度最高,酶活力也最高,这可能与其pH缓冲能力强,营养成分丰富有关。如图2,在TB培养基中,发酵25h后胞内酶活达到3.4 U/mL。
2.3.2 培养温度对产酶的影响
表1为不同温度下,菌体生长和产酶情况。其他条件为,TB培养基、初始pH 7.5和发酵时间25 h。结果表明:在30℃下酶活最高,为最适发酵温度。
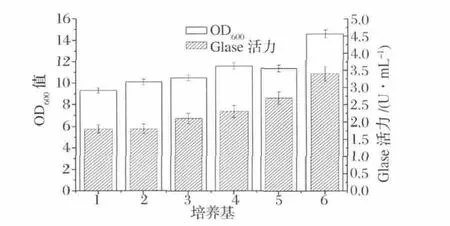
图2 出发培养基对菌体生长和产GIase酶活力的比较Fig.2 Effect of media on cell growth and production of GIase

表1 温度对GIase发酵生产的影响Table 1 Effect of temperature on the production of GIase
2.3.3 初始pH对产酶的影响
表2为不同初始pH对产酶的影响。其他条件为,TB培养基、发酵温度30℃和发酵时间25 h。结果表明:控制初始pH在6.0~7.5有利于菌株产酶,初始pH在7.0时更有利于菌体生长,在pH 7.0时酶活最高,说明中性环境有利于该菌体的生长和外源基因的表达。

表2 初始pH对GIase发酵生产的影响Table 2 Effect of initial pH on the production of GIase
2.3.4 摇瓶中重组B.subtilis WB600(pMGI)产GI-ase的发酵过程
实验进一步考察了摇瓶中重组B.subtilis WB600(pMGI)产GIase的发酵过程的菌体生长曲线和产酶曲线,以确定发酵终止时间。由图3可知,重组菌约在20 h菌体浓度达到最高,产酶量约在24 h达到最高,所以合适的发酵终止时间为24 h。

图3 摇瓶条件下重组B.subtilis WB600/pMGI产GIase的发酵过程Fig.3 Recombinant-GIase production by B.subtilis WB600/pMGI in shake flask
3 讨论
本实验室前期已将GIase在大肠杆菌中成功表达,但是为了更好满足食品工业的安全要求,从国际公认的食品工业安全宿主菌(GRAS)着眼,选择枯草杆菌这种工业上常用的工程菌尝试表达GIase酶。研究首先将GIase基因分别克隆到表达载体pHCMC04、pMA09 和 pAL12 上,转化B.subtilis TEB1030[13]、B.subtilis WB600 和 B subtilis WB800N(npr Eapr EeprbprmprblenprB::bsr.vprwprA:hyg cm:neo;NeoR),仅B.subtilis WB600所获得的基因工程重组菌能产GIase,而其他两个宿主菌均不能表达目的酶,相对于 WB600敲除 6个酶基因,TEB1030敲除4个酶基因,WB800N敲除8个酶基因,可能WB600的表达系统更适合GIase的表达。而从GIase的产酶效率上看,pMA09>pAL12>pHCMC04。最后选择组成型表达菌株WB600/pMGI进一步发酵优化,将该菌以TB为培养基,初始pH 7.0,30℃恒温培养24 h后,测得发酵上清液酶活5.6 U/mL,为培养野生菌 Thermobifida fusca产 GIase酶量的12.3倍,是已知外源GIase在枯草杆菌最高表达量的3.5倍。本研究为探索GIase在枯草杆菌中的表达和生产提供了重要的参考。
[1] Proceedings of the National Academy of Sciences of the U-nited States of America.Annual subject and author indexes[J].Proceedings of the National Academy of Sciences of the United States of America,1990,87 Suppl:10 069-10 240.
[2] Nam S W,Park H Y,Kim J H,et al.Expression of Bacillus macerans cyclodextrin glucanotransferase gene in Saccharomyces cerevisiae[J].Biotechnol Lett,2001,23(9):727-730.
[3] DENG Hui,CHEN Sheng,WU Dan,et al.Heterologous expression and biochemical characterization of glucose isomerase from Thermobifida fusca[J].Bioprocess and Biosystems Engineering,2014,37(6):1 211-1 219.
[4] SL W.Advances in the use of Bacillus subtilis for the expression and secretion of heterologous proteins[J].Curr Opin Biotechnol,1995,6(5):517-522.
[5] Westers L,Westers H,Quax W J.Bacillus subtilis as cell factory for pharmaceutical proteins:a biotechnological approach to optimize the host organism[J].Biochimica Et Biophysica Acta-Molecular Cell Research,2004,1694(1-3):299-310.
[6] Huang J J,Ho N W.Cloning and expression of the Escherichia coli D-xylose isomerase gene in Bacillus subtilis[J].Biochemical and Biophysical Research Communications,1985,126(3):1 154-1 160.
[7] Lee C Y,Bhatnagar L,Saha B C,et al.Cloning and expression of the Clostridium thermosulfurogenes glucose isomerase gene in Escherichia coli and Bacillus subtilis[J].Applied and Environmental Microbiology,1990,56(9):2 638-2 643.
[8] Nguyen H D,Nguyen Q A,Ferreira R C,et al.Construction of plasmid-based expression vectors for Bacillus subtilis exhibiting full structural stability[J].Plasmid,2005,54(3):241-248.
[9] ZHANG J,KANG Z,LING Z,et al.High-level extracellular production of alkaline polygalacturonate lyase in Bacillus subtilis with optimized regulatory elements[J].Bioresource technology,2013,146(10):543-548.
[10] Ai T T L,Schumann W.A novel cold-inducible expression system for Bacillus subtilis[J].Protein Expression & Purification,2007,53(2):264-269.
[11] Sambrook J F E,Maniatis T.Molecular Cloning:A Laboratory Manual.2nd Ed[M].New York:Cold Spring Harbor Laboratory Press,1989.
[12] Michal G,Moellering H,Gruber W.Enzymatic determination of fructose-1-phosphate[J].Enzymol Biol Clin(Basel),1968,9(2):154-159.
[13] Eggert T,Brockmeier U,Dröge M J,et al.Extracellular lipases from Bacillus subtilis:regulation of gene expression and enzyme activity by amino acid supply and external pH[J].Fems Microbiology Letters,2003,225(2):319-324.

