解淀粉芽孢杆菌F1对黄曲霉的拮抗条件优化及其抑霉特性研究*
饶胜其,陈素雅,魏永峰,高璐,尹永祺,杨振泉,方维明
(扬州大学食品科学与工程学院,江苏扬州,225127)
黄曲霉(Aspergillus flavus)是一种常见的霉菌,是子囊菌亚门(Ascomycotina)、曲霉属(Aspergillus)常见的腐生型好氧真菌。黄曲霉的次生代谢产物黄曲霉毒素是一类以二呋喃环(毒性作用)和氧杂萘邻酮(致癌作用)为基本结构的化合物,迄今已报道B1、B2、G1、G2、M1、M2和毒醇等 20 种,其中黄曲霉毒素B1(aflatoxin B1,AFB1)的毒性和致癌性最强。黄曲霉毒素广泛存在于农产品和食品中[1-3]。目前,防治黄曲霉及其毒素污染的重要手段是使用抗生素及化学制剂,但随之导致耐药性产生及抗生素残留等问题。随着人们对农作物产品质量和安全性的日益重视,生物防治正在逐步取代抗生素和化学制剂。芽孢杆菌已是重要的农业生防菌,其产生的抗真菌物质主要包括脂肽类抗生素Surfactin、Iturin和Fengycin等和蛋白类几丁质酶、葡聚糖酶等[4-5],具有较强的广谱抗真菌活性。许多研究发现,解淀粉芽孢杆菌(Bacillus amyloliquefaciens)在生长过程中可以产生一系列抑制真菌和细菌活性的代谢物,已证实的抑菌物质包括抑菌蛋白类、脂肽类抗生素、大环类酯类、肽类、聚酮化合物等,在抑制病原菌、环境保护、动物生产等方面已显示出益生菌的用途[6-10]。
在我们前期研究中,从黑胡椒中分离出1株对黄曲霉有较强抑制作用的菌株F1(保藏号CGMCC No.10942),依据菌株的形态特征、培养特征、生理生化特征结合16S rDNA基因序列分析、系统发育树构建鉴定菌株为解淀粉芽孢杆菌Bacillus amyloliquefaciens,命名为B.amyloliquefaciens F1。而且,研究已证实菌株F1的抑菌成分为分子质量为30 k~100 ku的蛋白类物质,具有良好的pH稳定性和热稳定性。在本研究中,拟从以下两方面展开:(1)对B.amyloliquefaciens F1的发酵培养基和培养条件进行初步优化,以期提高其黄曲霉抑制能力;(2)考察B.amyloliquefaciens F1发酵液对黄曲霉生长及产毒的抑制作用。
1 材料与方法
1.1 材料
1.1.2 菌株
B.amyloliquefaciens F1,产毒黄曲霉,由扬州大学食品微生物发酵实验室从海南黑胡椒体表分离纯化。
1.1.3 主要试剂
KNO3、蔗糖、D-果糖、可溶性淀粉、乙腈(色谱纯)、正己烷、异戊醇,国药集团化学试剂有限公司;Glycine,生工生物工程(上海)股份有限公司。
1.1.4 主要仪器、设备
ZHJH-C1209B型垂直流超净工作台,上海智诚分析仪器制造有限公司;GHX-92708-1型隔水式恒温培养箱,上海新苗医疗器械制造有限公司;TG-16WS台式高速离心机,湘仪离心机仪器有限公司;SS-325高压蒸汽灭菌锅,日本TOMY公司;液相色谱,日本岛津公司;CAR/PDMS SPME萃取头,上海安谱科学仪器有限公司。
1.1.5 培养基
营养肉汤培养基:蛋白胨10 g,牛肉膏10 g,酵母粉 5 g,K2HPO42 g,柠檬酸二铵 2 g,乙酸钠 5 g,葡萄糖20 g,吐温-80 1 mL,MgSO4·7H2O 0.58 g ,MnSO4·4H2O 0.25 g,加入蒸馏水,定容至1 000 mL,调pH至6.2~6.4,121 ℃灭菌15 min。
1.2 实验方法
1.2.1 菌株F1生长曲线测定
将冻存于-20℃冰箱中的B.amyloliquefaciens F1细菌保种管在4℃解冻,吸取100 μL菌液转接于含100 mL营养肉汤的300 mL锥形瓶中,30℃摇床(140 r/min)振荡培养30 h,其中,每隔2 h取样进行平板涂布,倒置培养24 h后菌落计数。
1.2.2 菌株F1抗菌培养条件单因素优化
1.2.2.1 培养温度对F1发酵液抑菌活性的影响
分别吸取100 μL菌液转接于含100 mL营养肉汤的300 mL 锥形瓶中,25,28,30,32,35,37 ℃ 摇床(140 r/min)振荡培养48 h后,测定发酵液抑菌活性。
1.2.2.2 培养基初始pH值对F1发酵液抑菌活性的影响
营养肉汤配制好后,分别调pH值至5.0,5.5,6.0,6.5,7.0,7.5,8.0 后高压灭菌,按 1.2.2.1 的方式接种,30℃摇床(140 r/min)振荡培养48 h后,测定发酵液抑菌活性。
1.2.2.3 培养时间对菌株F1抑菌效果的影响
按1.2.2.1的方式接种,自然pH值,30℃摇床(140 r/min)振荡培养,取培养不同时间(24,36,48,60,72 h)的发酵上清液,测定发酵液抑菌活性。
1.2.3 菌株F1抗菌培养基成分优化
(1)碳源。以营养肉汤为基础空白对照培养基(自然pH与1.2.2.2的优化结果相同,故无需再调节pH)分别添加0.1%的葡萄糖、蔗糖、D-果糖、乳糖和可溶性淀粉,按1.2.2.1的方式接种,32℃摇床(140 r/min)振荡培养48 h测定发酵液抑菌活性。
(2)氮源。以营养肉汤为基础空白对照培养基,分别添加0.1%的酵母抽提物、胰蛋白胨、柠檬酸铵和硝酸铵,按1.2.2.1的方式接种,32℃摇床(140 r/min)振荡48 h培养测定发酵液抑菌活性。
(3)微量元素。以营养肉汤为基础空白对照培养基,分别添加一定量的微量元素MnSO4·4H2O(22.3 mg/L)、ZnSO4·7H2O(22.3 mg/L)、CuSO4·5H2O(0.025 mg/L)、FeSO4·7H2O(27.8 mg/L)、Mg-SO4·7H2O(440 mg/L)、KNO3(190 mg/L)、甘氨酸(2.0 mg/L)、L-谷氨酸(2.0 mg/L),按 1.2.2.1 的方式接种,32℃摇床(140 r/min)振荡培养48 h测定发酵液抑菌活性。
(4)最佳成分单因素试验。已筛选出最佳碳源蔗糖、氮源柠檬酸铵、微量元素硝酸钾,以营养肉汤为基础空白对照培养基,分别添加 0.2%,0.4%,0.6%,0.8%和1.0%的蔗糖,0.1%,0.2%,0.3%,0.4%和0.5%的柠檬酸铵,95,190,285,380,475 mg/L的 KNO3,按浓度从高到低编组号 2、3、4、5、6,空白对照组为1号。按1.2.2.1的方式接种,32℃摇床(140 r/min)振荡培养48 h测定发酵液抑菌活性。
1.2.4 菌株F1发酵液对黄曲霉生长及产毒的影响
取B.amyloliquefaciens F1接种入优化后的培养基(0.4%蔗糖、0.2%柠檬酸铵、0.02%KNO3,初始pH值5.5)中,32℃,发酵培养48 h,8 000 r/min离心20 min,取上清液过0.22 μm水系滤膜,依次使用膜截留分子质量分别为100 ku和30 ku的超滤离心管进行超滤处理(4 000 g,4℃,离心45 min),收集30 k~100 ku的超滤液,即为菌株F1超滤抗菌液。
黄曲霉孢子悬液制作方法同1.2.5,调整浓度至106个/mL。每个锥形瓶加入PDA(马铃薯葡萄糖液体培养基)150 mL,高压灭菌后放至室温,每个锥形瓶加入300 μL黄曲霉孢子悬液,空白对照组未加入B.amyloliquefaciens F1超滤抗菌液,其余两组分别加入10%和20%的超滤抗菌液,每组设3个平行,150 r/min,30℃摇瓶培养,3 d后测定菌丝干重,5 d后测定黄曲霉毒素。
1.2.5 霉菌孢子悬浮液制备
将保存在PDA斜面培养基上的霉菌接种到PDA平板,28℃培养箱内培养4 d后,加入无菌PBS缓冲液,灭菌大枪头尖头轻刮培养基上的孢子,然后将含有霉菌孢子和菌丝的混悬液通过灭菌八层纱布的蓝盖瓶中以过滤掉霉菌菌丝,涡旋振荡,10倍稀释法分别稀释10、100、1 000倍后,血球计数板计数,然后将计数好的霉菌孢子原液用无菌磷酸缓冲盐溶液(PBS)缓冲液统一调整至105个/mL,4℃冰箱贮藏备用。
1.2.6 抑菌率测定
将菌株F1接种入营养肉汤中按照一定条件进行发酵培养,发酵结束后,6 000 r/min离心10 min,收集上清液,采用0.22 μm聚醚砜树脂(PES)水系滤膜过滤除菌。吸取1 mL无菌上清液倾注至无菌平板内,倒入10 mL PDA培养基轻轻混匀,待培养基冷却凝固,用直径为6 mm打孔器在中央打孔,向孔中注入20 μL浓度为104个/mL的黄曲霉孢子悬液,空白培养基代替上清液作为对照,30℃培养3 d后测霉菌直径,每组3个平行,以抑菌率(%)表示拮抗细菌上清液的抑菌效果,计算公式为:

1.2.7 菌丝干重测定
参照左瑞雨等[11]的方法,采用PDA培养基摇瓶培养黄曲霉孢子3 d后,大量菌丝已长出,中速定性滤纸过滤培养液,蒸馏水冲洗3遍以除去培养基黏性成分,过滤得到的菌丝连同滤纸放入大号平皿中(滤纸和平皿提前烘干至恒重并称重),90℃干燥烘干至恒重,之后将菌丝放入干燥器中充分干燥至恒重,则黄曲霉菌丝质量为干燥后的总体质量与干燥前平皿与滤纸质量之差。
1.2.8 黄曲霉毒素含量测定
毒素提取及浓度检测参照许艳丽等[12]的方法,进行适当改进。具体步骤如下:将1.2.1.1中培养了5 d的培养液按1.2.1.2的方法过滤,收集滤液,准确量取15 mL过滤液于50 mL离心管中,加入10 mL乙腈,涡旋振荡1 min,重复3次后,5 000 r/min离心5 min,取上清液10 mL过多功能净化柱,从多功能净化柱的收集池内转移3 mL净化液到棕色具塞小瓶中60℃ ±1℃氮气吹干,分别加入200 μL正己烷和100 μL三氟乙酸,密闭混匀60 s后,在40℃ ±1℃烘箱中衍生15 min。样品衍生后于室温下氮气吹干,采用600 μL 水-乙腈(85%/15%)溶解,3 000 r/min离心15 min,取上清液过膜到进样瓶中供测定用。
色谱条件:色谱柱,RP-C18(250 mm ×4.6 mm,5 μm);柱温,20℃;流动相,乙腈(色谱纯)+水;荧光检测器激发波长,360 nm;发射波长,440 nm;进样量,10 μL;流速,5 mL/min。梯度洗脱如下:0 ~10 min,15%~40%乙腈;10~28 min,40%乙腈;28~30 min,40%~15%乙腈。
1.2.9 数据统计分析
采用SPSS 13.0软件对数据进行统计分析,用Duncan’s多重分析进行组间显著性检验,显著水平为P<0.05。
2 结果与分析
2.1 菌株F1生长曲线
如图1所示,新保种的F1在营养肉汤中30℃摇瓶培养,2 h即进入对数生长期,之后快速生长,14 h后进入稳定期,此时菌落总数达到5.2×107CFU/mL,到30 h时仍保持在高生物量。

图1 B.amyloliquefaciens F1生长曲线图Fig.1 The growth curve of B.amyloliquefaciens F1
2.2 菌株F1抗菌培养条件单因素优化
2.2.1 培养温度对F1发酵液抑菌活性的影响
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)所属芽孢杆菌(Bacillus),其最适生长温度为28~30℃[13],但微生物最适生长温度不一定就是目标产物代谢最佳温度。值得说明的是,前期研究已证实菌株F1的抑菌成分为分子量30 k~100 ku的蛋白类物质,具有良好的热稳定性,在温度70℃以下处理30 min,其活性完全不受影响(相关系列数据已投稿其他杂志)。在本研究中,选取25~37℃考察不同温度对B.amyloliquefaciens F1抑菌蛋白合成的影响,如图2所示,随着培养温度的上升,F1发酵液抗菌活性先升后降,在32℃达到最高,后逐渐下降;其生物量呈先上升趋势,32℃后变化较小。因此,F1产抗菌物质最佳培养温度为32℃。
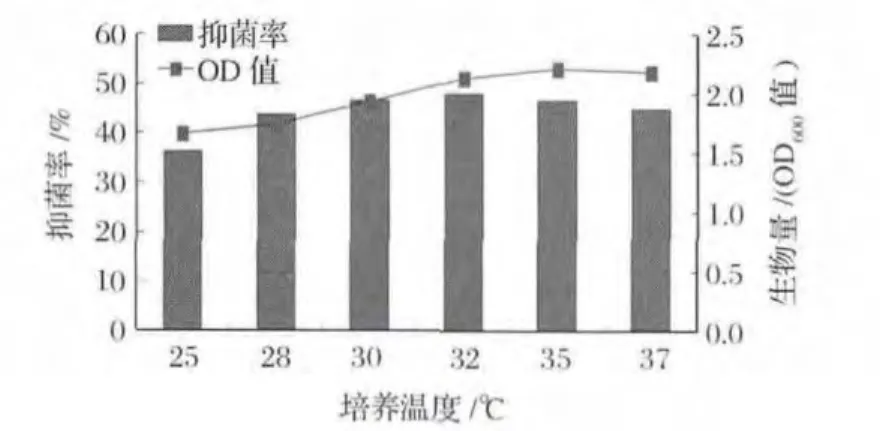
图2 培养温度对B.amyloliquefaciens F1发酵液抑菌活性的影响Fig.2 The influences of cultural temperature to B.amyloliquefaciens F1 broth’s antifungal activity
2.2.2 初始pH值对F1发酵液抑菌活性的影响
解淀粉芽孢杆菌的最适生长pH值为6.5~7.0[13],但微生物最适生长pH不一定就是目标产物代谢最佳pH。此外,前期研究已证实菌株F1所分泌抗真菌蛋白在pH值5.0~8.0,其相对抗菌活性均在80%以上,其中弱酸性环境对其抗真菌活性影响不大。培养基初始pH影响菌体自身生长和代谢物的产生,菌株F1产抑菌物质受培养基初始pH的影响如图3所示,在pH为5.5的培养基中培养,菌株F1上清液的抗菌活性最高;相比碱性环境,弱酸性环境更有利于菌F1的生长。上述结果表明,微酸性环境更有利于F1产抗菌物质。

图3 培养pH对B.amyloliquefaciens F1发酵液抑菌活性的影响Fig.3 The influences of cultural pH to B.amyloliquefaciens F1 fermentation broth’s antifungal activity
2.2.3 培养时间对F1发酵液抑菌活性的影响
由图4可知,随着培养时间的延长,B.amyloliquefaciens F1菌体生物量及发酵液抑菌活性不断增加,48 h后,菌体生物量及抑菌活性变化较小,可见抗菌物质随F1菌体的生长代谢不断积累,累积曲线类似典型的细菌生长S曲线,进一步说明了抗菌物质为F1的体外代谢产物,且稳定存在于菌液中。为经济节约,选取48 h为F1产抗菌物质为最佳培养时间。

图4 培养时间对B.amyloliquefaciens F1发酵液抑菌活性的影响Fig.4 The influences of cultural time to B.amyloliquefaciens F1 fermentation broth’s antifungal activity
综上,菌株F1产抗真菌蛋白的适宜培养条件为:温度32℃,初始pH值5.5,培养时间48 h。
2.3 B.amyloliquefaciens F1抗菌培养基优化
2.3.1 碳源
B.amyloliquefaciensF1在添加了同一浓度不同种类碳源的培养基中培养后,发酵上清液对黄曲霉的抑制效果如图5所示,与对照组相比,添加碳源对生物量的影响变化不大,OD600值均在2.1~2.3;添加碳源(包括长效大分子淀粉和速效小分子的果糖和葡萄糖)能普遍提高B.amyloliquefaciens F1的抑菌效果,蔗糖能使同等条件下的抑菌率由46.5%提高到65.5%,淀粉其次,为55.5%。因此,本批试验所选择的5种碳源中,选取蔗糖为最佳碳源。

图5 碳源对B.amyloliquefaciens F1发酵液抑菌活性的影响Fig.5 The influences of cultural carbon to B.amyloliquefaciens F1 fermentation broth’s antifungal activity
2.3.2 氮源
由图6可知,与对照组相比,添加不同氮源对菌F1的生物量影响不大,OD600值均在2.1~2.3;在试验选取的4种氮源中,柠檬酸铵能有效提高B.amyloliquefaciens F1产抑菌物质的能力(P<0.05),使得上清液对黄曲霉的抑制能力从46.5%提高到62.0%。

图6 氮源对B.amyloliquefaciens F1发酵液抑菌活性的影响Fig.6 The influences of cultural cnitrogen to B.amyloliquefaciens F1 fermentation broth’s antifungal activity
2.3.3 微量元素
由图7可知,根据各不同元素适宜添加浓度添加到培养基后,与对照组相比,各添加组中B.amyloliquefaciens F1生物量变化不大,OD600值均在2.0~2.3;菌F1发酵液抑菌活性有不同程度升高,其中K+能显著增加F1拮抗性能(P<0.05),故选取KNO3作为最佳微量元素进一步做单因素优化试验。
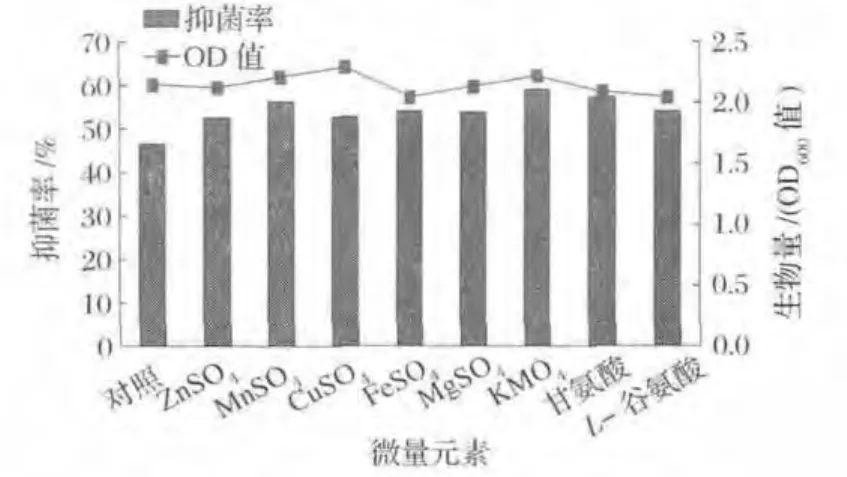
图7 微量元素对B.amyloliquefaciens F1发酵液抑菌活性的影响Fig.7 The influences of cultural trace elements to B.amyloliquefaciens F1 broth’s antifungal activity
2.3.4 培养基成分单因素
本研究根据已确定的最佳培养基成分,从中心浓度出发,设定相关不同浓度下F1发酵上清液对黄曲霉真菌抑制活性。由图8可知,碳源蔗糖的最适添加浓度为3号试验组的0.4%,氮源柠檬酸铵的最适添加浓度为3号试验组的0.2%,硝酸钾的最适添加浓度为3号试验组的1.90 mg/mL。综上,B.amyloliquefaciens F1产抗菌物质的适宜发酵培养基为:在营养肉汤培养基中添加0.4%蔗糖、0.2%柠檬酸铵和0.02%硝酸钾。优化后B.amyloliquefaciens F1发酵上清液对黄曲霉的抑菌率达到75.2%,比优化前提高了60.1%。

图8 蔗糖、柠檬酸铵、硝酸钾浓度对B.amyloliquefaciens F1发酵液抑菌活性影响Fig.8 The influences of different levels of sugar,ammonium and citrate to B.amyloliquefaciens F1 broth’s antifungal activity
2.4 菌株F1对黄曲霉菌丝生长的影响
由表1可知,预设两组试验组黄曲霉菌丝质量均低于仅接种黄曲霉孢子的对照组,分别降低了14.8%和35.7%,且加入20%F1抗菌超滤液的培养液中的菌丝质量显著低于对照组,研究表明菌株F1所产抗菌蛋白能够通过抑制孢子萌发而达到抑制黄曲霉生长的能力。本试验在灭菌的PDA培养液中加入了浓度为106个/mL的黄曲霉孢子,由图9可知,加入了所筛拮抗菌B.amyloliquefaciens F1抗菌超滤液后,黄曲霉的生长受到一定程度抑制,菌丝抱团生长现象减弱,菌丝球变小,且抑制程度随着加入的超滤液的量的增加而增加。

表1 黄曲霉菌丝质量Table 1 Weight of Aspergillus flavus mycelius

图9 锥形瓶中黄曲霉生长情况Fig.9 The growth situation of Aspergillus flavus mycelius in conical flasks
2.5 B.amyloliquefaciens F1对黄曲霉产毒的影响
将黄曲霉孢子悬液接种入PDA液体培养基中,同时加入不同蛋白终浓度的F1上清超滤液,进行摇瓶培养,5 d后采用HPLC对发酵液中的黄曲霉毒素AFB1进行定性定量分析。AFB1标准品色谱图如图10所示,保留时间为11.3 min,根据不同标准品浓度和峰面积求得回归方程和相关系数,得到AFB1标准曲线方程为:Y=0.016 6x+0.089 3,相关系数R2=0.998 4。

图10 AFB1标准品色谱图Fig.10 The chromatogram map of AFB1 standard

图11 空白组黄曲霉发酵液样品(A)、10%F1超滤液黄曲霉发酵液样品(B)和20%F1超滤液黄曲霉发酵液样品(C)HPLC色谱图Fig.11 (A)The chromatographic graph of Aspergillus flavus fermentation sample blank group;(B)The chromatographic graph of Aspergillus flavus fermentation sample within 10%ultrafiltrate;(C)The chromatographic graph of Aspergillus flavus fermentation sample within 20% ultrafiltrate

表2 培养液中黄曲霉毒素含量Table 2 AFB1 contents of Aspergillus flavus fermentation samples
由图11和表2可知,未添加抗菌超滤液的黄曲霉培养组AFB1含量最高,达到267.5 mg/L,而添加10%超滤液后,AFB1浓度减少了84.45%,添加20%超滤液的则未有真菌毒素检出。研究表明,菌株F1上清超滤液有效抑制了AFB1的生物合成。Farzaneh等[14]从伊朗开心果中分离鉴定了1株枯草芽孢杆菌UTBSP1,能够显著降低营养肉汤培养基和开心果中的AFB1,其降解率分别为85.66%和95%。张志敏等[15]从秦川牛瘤胃内容物中分离鉴定了1株巨大芽孢杆菌WZ-2,在含有500 μg/mL的 AFB1发酵培养基中培养72 h,可使AFB1降解率达到79%。上述研究显示了某些芽孢杆菌能够通过生物作用直接降解AFB1,很可能是产生了能降解AFB1的胞外蛋白酶。在本研究中,F1上清超滤液对黄曲霉菌丝生长有显著抑制作用,很可能是通过抑制孢子萌发和菌丝生长而影响黄曲霉毒素的生物合成,而F1对黄曲霉毒素AFB1是否具有降解作用有待后续研究进一步探索。
3 结论
(1)为了提高B.amyloliquefaciens F1发酵液中抗菌物质的产量,以抑菌活性为检测指标,通过单因素试验对B.amyloliquefaciens F1培养条件和培养基成分进行了优化。结果表明,B.amyloliquefaciens F1的适宜培养条件为温度32℃,初始pH值5.5,培养时间48 h;适宜发酵培养基为在营养肉汤培养基中添加0.4%蔗糖、0.2%柠檬酸铵和0.02%KNO3。
(2)以菌丝干重、菌丝形态为考核指标,研究发现B.amyloliquefaciens F1的发酵上清的超滤液(30 k~100ku)显著抑制了黄曲霉孢子萌发和菌丝生长。通过HPLC对黄曲霉毒素AFB1的定性定量检测,研究发现B.amyloliquefaciens F1发酵上清的超滤液(30 k~100 ku)显著抑制了AFB1的产生,很可能是通过抑制黄曲霉孢子萌发和菌丝生长而达到降低AFB1产量的目的。B.amyloliquefaciens F1的发酵液对黄曲霉毒素的降解作用及能有效降解黄曲霉毒素的成分有待进一步的研究。
[1] Yu J,Cleveland T E,Nierman W C,et al.Aspergillus flavus genomics:gateway to human and animal health,food safety,and crop resistance to diseases[J].Revista Iberoamericana de Micología,2005,22(4):194-202.
[2] 王后苗,廖伯寿,雷永,等.黄曲霉菌主要真菌毒素次级代谢与调控的研究进展[J].微生物学通报,2014,41(7):1 425-1 438.
[3] Zjalic S,Reverberi M,Ricelli A,et al.Trametes versicolor:a possible tool for aflatoxin control[J].International Journal of Food Microbiology,2006,107(3):243-249.
[4] 黄曦,许兰兰,黄荣韶,等.枯草芽孢杆菌在抑制植物病原菌中的研究进展[J].生物技术通报,2010(1):24-29.
[5] LIU Y,TAO J,YAN Y J,et al.Biocontol efficiency of Bacillus subtilis sl-13 and characterization of an antifungal chitinase[J].Chinese Journal of Chemical Engineering,2011,19(1):128-134.
[6] 张娟,杨彩梅,曹广添,等.解淀粉芽孢杆菌及其作为益生菌的应用[J].动物营养学报,2014,26(4):863-867.
[7] WONG J H,HAO J,CAO Z,et al.An antifungal protein from Bacillus amyloliquefaciens[J].Journal of Applied Microbiology,2010,105(6):1 888-1 898.
[8] YUAN J,Raza W,SHEN Q R,et al.Antifungal activity of Bacillus amyloliquefaciens NJN-6 volatile compounds against Fusarium oxysporumf sp.cubense[J].Applied and Environmental Microbiology,2012,78(16):5 942-5 944.
[9] Kadaikunnan S,Rejiniemon T S,Khaled J M,et al.In-vitro antibacterial,antifungal,antioxidant and functional properties of Bacillus amyloliquefaciens[J].Annals of Clinical Microbiologyand Antimicrobials, 2015,14:9 doi:10.1186/s12941-015-0069-1
[10] 陈成,崔堂兵,于平儒.一株抗真菌的解淀粉芽孢杆菌的鉴定及其抗菌性研究[J].现代食品科技,2011,27(1):36-39.
[11] 左瑞雨,常娟,尹清强,等.乳酸菌和枯草芽孢杆菌对黄曲霉毒素产生菌生长的抑制作用研究[J].河南农业科学,2011,40(3):145-148.
[12] 许艳丽.产黄曲霉毒素菌株的检测方法及产毒条件的研究[D].青岛:中国海洋大学,2009:20-23.
[13] 关晓欢,姜华.解淀粉芽孢杆菌研究进展[J].生物技术世界,2013(1):4-9.
[14] Farzaneh M,Shi Z Q,Ghassempour A,et al.Aflatoxin B1 degradation by Bacillus subtilis UTBSP1 isolated from pistachio nuts of Iran[J].Food Control,2012,23(1):100-106.
[15] 张志敏,王燕,毛勇,等.一株瘤胃黄曲霉毒素B1降解菌的分离鉴定及特性研究[J].动物医学进展,2014,35(8):49-53.

