缺氧时乳腺癌细胞HIF-1α与CXCR4表达及迁移调控的实验研究
通信作者:郭丽英,女,硕士,主任医师,博士生导师,研究方向:乳腺外科,E-mail: 2315365607@qq.com。
缺氧时乳腺癌细胞HIF-1α与CXCR4表达及迁移调控的实验研究
付明刚1, 哈丽旦·肉孜2, 郭丽英1
(1新疆医科大学第一附属医院乳腺外科, 乌鲁木齐830054,2乌鲁木齐市杭州路卫生服务中心, 乌鲁木齐830026)
摘要:目的探讨缺氧时乳腺癌细胞缺氧诱导因子HIF-1α(HIF- 1α) 与趋化因子4(CXCR4)的表达及其对乳腺癌细胞迁移调控的影响。方法将MDA-MB-231乳腺癌细胞置入缺氧盒中,建立3%缺氧微环境,设为缺氧24 h组及缺氧48 h组,对照组为正常培养的乳腺癌细胞;采用MTT法测定乳腺癌细胞的增殖能力, RT-PCR法检测HIF-1α与CXCR4mRNA表达量,同时检测添加维生素C(VitC)后HIF-1α与CXCR4mRNA的mRNA表达水平:Transwell小室测定各组细胞的迁移能力。结果与对照组比较,缺氧24、48 h组细胞增殖能力明显增加;缺氧24 h组、缺氧48 h组HIF-1α、CXCR4 mRNA表达和细胞的迁移能力明显高于对照组(P<0.05) ; 缺氧24 h+VitC组、缺氧48 h+VitC组HIF-1α、CXCR4 mRNA表达和细胞的迁移能力与对照组比较差异无统计学意义(P>0.05)。结论缺氧能增加细胞的增殖能力,能增加乳腺癌细胞HIF-1α、CXCR4mRNA表达和迁移能力,但能被抗氧化剂VitC有效阻断,提示HIF- 1α可望成为抑制乳腺癌转移的治疗靶点。
关键词:缺氧; 缺氧诱导因子- 1α; CXCR4; 乳腺癌
基金项目:省部共建国家重点实验室培育基地—新疆重大疾病医学重点实验室专项(SKLI-XJ-MDR-ZX-2014-1)
作者简介:付明刚 (1978-), 男,在读博士,主治医师,研究方向:乳腺外科。
中图分类号:R34
doi:10.3969/j.issn.1009-5551.2015.03.010
[收稿日期:2014-09-10]
Experimental research of the expression of HIF-1 alpha and CXCR4 and
regulation of the migration in hypoxic breast cancer cells
FU Minggang1, Halidan Rouzi2, GUO Liying1
(1DepartmentofBreastSurgery,FirstAffiliatedHospital,XinjiangMedicalUniversity,
Urumqi830054,China;2TheHealthCenterofHangZhouRoad,Urumqi830026,China)
Abstract:ObjectiveTo investigate the expressions of hypoxia inducible alph (HIF-1α) and chemokine receptor 4 (CXCR4) and the influence of the regulation of cell migration in hypoxia breast cancer cells. MethodsThe MDA-MB-231 breast cancer cell was put into Hypoxic box Hypoxic box, and then the hypoxic environment was constructed. The cells were divided into control group, hypoxia 24 h group and hypoxia 48 h group. The breast cancer cells in the control group were cultured without any interference. The researchers used MTT to test breast cancer cell proliferation ability and RT-PCR method to detect mRNA expression amount of HIF-1α and CXCR4 and their expression level after adding VitC. The cell migration ability of each team was determined by Transwell methods. ResultsThe proliferation of the cells in hypoxia 24 h group and hypoxia 48h group significantly increased compared to that in the control group. HIF-1α, CXCR4 expression and cell migration in hypoxia 24h group and hypoxia 48h group were significantly higher than that in the control group (P<0.05). The differences in HIF-1α, CXCR4 expression and cell migration between the hypoxia 24 h+VitC group and control group and between hypoxia 48 h+VitC group and control group were not statistically significant (P>0.05). ConclusionHypoxia can increase the proliferative capacity of breast cells and increase HIF-1α, CXCR4 expression and migration of the breast cancer cells, but these processes can be effectively inhibited by the antioxidant VitC. It suggests that HIF-1α is expected to become a new target to inhibit the process of the metastasis in breast cancer.
Key words: hypoxia; HIF-1α; CXCR4; breast cancer
乳腺癌是女性最常见的肿瘤,且乳腺癌的发病率呈增高趋势[1]。虽然以手术为主的综合治疗可以取得较好的临床疗效,但复发和转移仍然是影响患者生存率和死亡率的主要因素,尤其转移是绝大多数患者癌症晚期的症状和致死的主要原因[2]。目前乳腺癌转移潜在的分子机制目前尚未完全阐明。缺氧诱导因子1α(HIF-1α)作为多种信号途径的上游调控因子调控细胞凋亡、糖酵解、血管新生等多种肿瘤代谢过程,促进肿瘤生长。近年来,趋化因子受体在乳腺癌发展中的作用得到了广泛关注,尤其是趋化因子受体(CXCR4)与其配体SDF-1 形成的CXCR4 /SDF-1轴在肿瘤生长、侵袭和转移中也具有重要作用[3-4]。有研究表明缺氧可能与CXCR4在乳腺癌发生发展过程中诱导因子有协同作用[5]。但是,缺氧对乳腺癌HIF-1α、CXCR4 的表达及维生素C(VitC)相关作用机制及其影响却鲜有报道。本实验通过观察缺氧对乳腺癌细胞HIF-1α、CXCR4 表达及迁移能力的影响以及与VitC相关作用机制,期望为临床治疗乳腺癌提供理论依据。
1材料与方法
1.1试剂与材料高侵袭性人乳腺癌细胞系MDA-MB-231(上海信然生物科技有限公司),CXCR4 抗体为Abcam 公司产品,维生素C(VitC),1640 培养液及胎牛血清均为Gibco公司产品,Transwell 小室购自北京乐博生物科技有限公司。
1.2实验方法
1.2.1细胞培养MDA-MB-231 乳腺癌细胞用含10% 胎牛血清、100 U/mL 青霉素和100 U/mL卡那霉素的1640 培养液,于37℃、5%CO-2培养箱中培养,常规换液传代。
1.2.2缺氧培养方案将MDA-MB-231乳腺癌细胞先放入缺氧盒中,使用缺氧混配器(长沙长锦公司)将气体(3% O-2、5%CO-2及90%N)混合,并将混合后的气体注入缺氧盒,从而建立缺氧微环境。实验分为缺氧24 h 组、48 h组和正常对照组(正常培养的乳腺癌细胞),每组实验为6次后取均值。
1.2.3MTT法测定乳腺癌细胞的增殖率将缺氧干预后的细胞用0.25%胰蛋白酶液消化,收集细胞,调节细胞浓度为1×10+4/mL,于96孔板每孔加0.2 mL,同时设空白对照组,只加入培养基,37℃分别培养24 h和48 h后,弃去培养液,PBS洗1次,每孔加0.1 mL PBS和10 μL MTT染液,在37℃、5%CO-2培养箱中培养4~6 h。弃去培养液,每孔加DMSO100 μL,震荡,在酶联免疫检测仪上选择570 nm 波长,测定每孔的光密度值(OD值)。
1.2.4RT-PCR法检测HIF-1α与CXCR4 mRNA表达水平及添加VitC后HIF-1α与CXCR4mRNA的mRNA表达水平按照以上分组收集处理后的细胞,Trizol法提出总RNA,逆转录为cDNA后进行PCR。PCR反应体系为:Mix:10 μL,HIF-1α上游引物:5′-GGAAACTTCTGGATGCTGGTGAT-3′,下游引物:5′-CACTTCATTCTGAGAAAAAAGCTTC-3′,扩增片段 310 bp。CXCR4上游引物5′-AGGTGGTCTATGTTGGCGTCTGGAT-3′,下游为5′-AGGATGGGGATGATTGTGGTCTTGA-3′,SDF-1各1 μL,扩增片段大小291 bp。cDNA:1.5 μL,dd H-2O:6.5 μL,总计20 μL。取PCR产物进行1.5%琼脂糖凝胶电泳35 min,以β-actin基因作为内参照,采用GDS8000凝胶自动成像仪扫描分析并相对处理。
1.2.5Transwell小室实验检测细胞迁移能力细胞按照各组处理后加入上室内,下室内加入含SDF-l(200 nM)的500 μL的培养液,各组细胞在趋化因子诱导下可穿过多孔滤膜,由小室的上室面迁移至小室的下室面,0.1%的结晶紫染色20 min(结晶紫用无水甲醇配成0.5%的母液,用时稀释成0.1%),PBS清洗2次,24孔板加入PBS,10%乙酸(100 μL)溶解,将溶解的液体转入96孔板中用酶标仪读数(OD=560 nm),结果用倍数比表示各组数据,对照组定为100%,其他各组数据与对照组进行比较得到倍数比,实验重复3次。
1.3统计学处理使用SPSS13.0统计软件完成统计学处理,计量资料以均数±标准差(±s)表示,组间差异比较采用单因素方差分析, P<0.05为差异有统计学意义。
2结果
2.1缺氧对乳腺癌细胞增殖能力的影响与正常对照组比较,在缺氧24 h后,3%缺氧组细胞增殖能力显著升高(P<0.05)(A 值表示乳腺癌细胞的增殖程度);而且24 h缺氧组与48 h缺氧组比较细胞增殖能力无明显变化(P>0.05),见表1。
表1 3%缺氧对MDA-MB-231 增殖的影响( ±s)

表1 3%缺氧对MDA-MB-231 增殖的影响( ±s)
分组检测次数A值正常对照组60.12±0.0283%缺氧24h组60.21±0.0213%缺氧48h组60.22±0.047
注:注:与正常对照组比较,*P<0.05。
2.2缺氧对乳腺癌HIF-1α和CXCR4 mRNA的影响与正常对照组比较,3%缺氧24 h、48 h组细胞HIF-1α和CXCR4 mRNA显著升高(P<0.05)(表2),但3%缺氧24 h+VitC和3%缺氧48 h+VitC 组细胞与对照组比较无明显差异(P>0.05),见图1、2,表2。

图1 缺氧24 h对乳腺癌HIF-1α和CXCR4 mRNA表达的影响
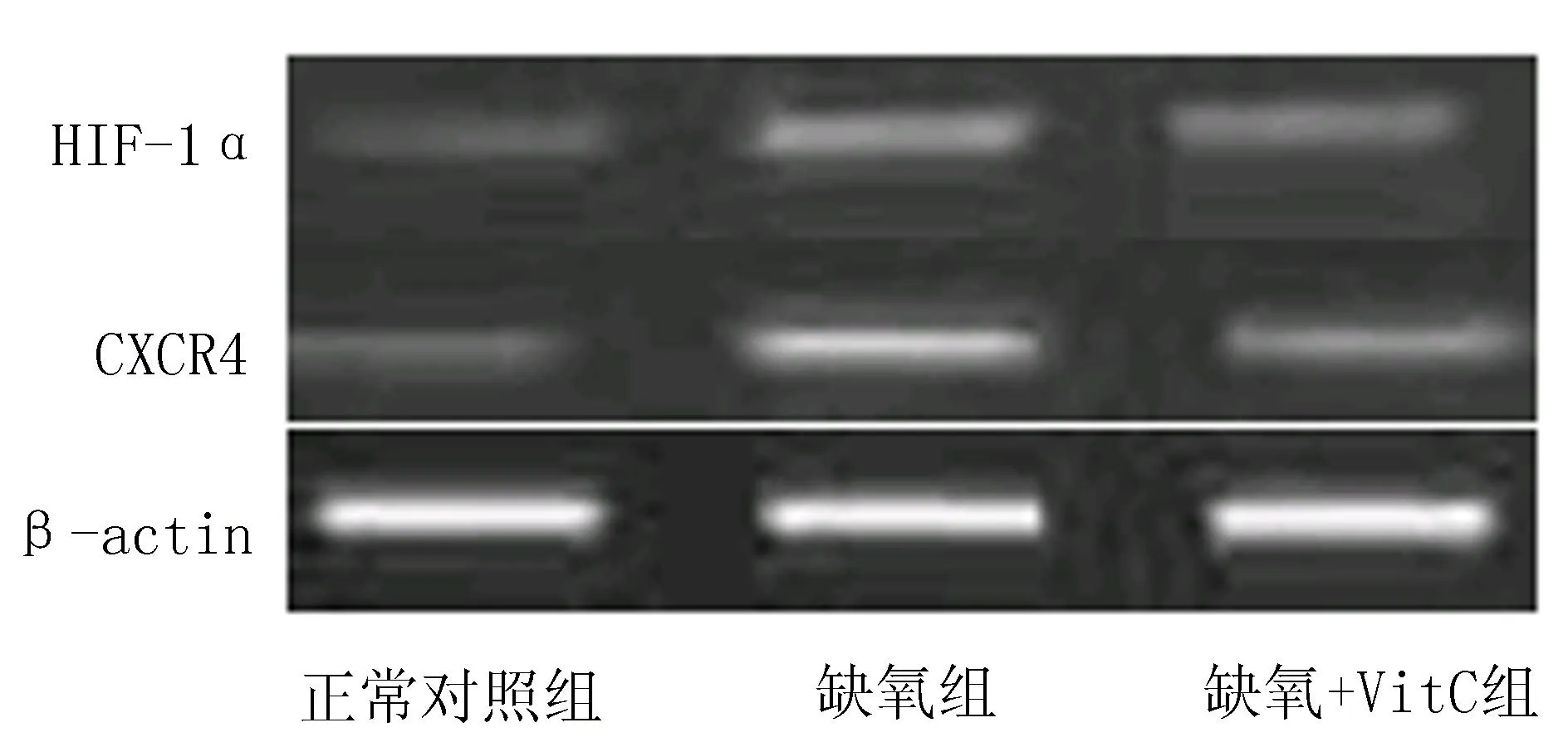
图2 缺氧48 h对乳腺癌HIF-1α和CXCR4 mRNA

分组检测次数R值24h48h正常对照组62.562.863%缺氧组65.656.623%缺氧+VitC组63.013.22
注:注: R值为相对mRNA水平,与正常对照组比较,*P<0.05。
2.3Transwell小室测定各组细胞迁移能力与正常对照组比较,3%缺氧24 h组、48 h组细胞迁移能力明显升高(P<0.05),但3%缺氧24 h+VitC和3%缺氧48 h+VitC 组细胞与正常对照组比较迁移能力无明显差异(P>0.05),见图3~5。
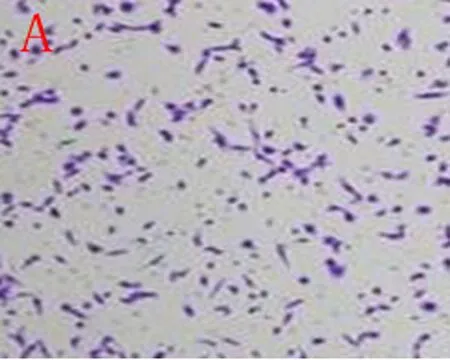
A: 正常对照组
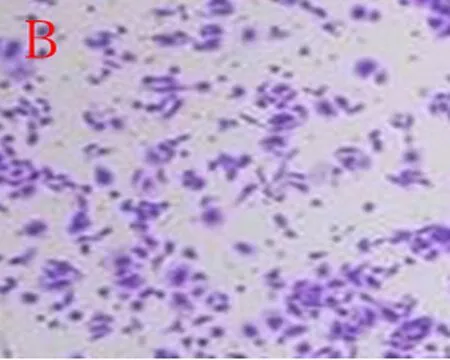
B:3%缺氧组
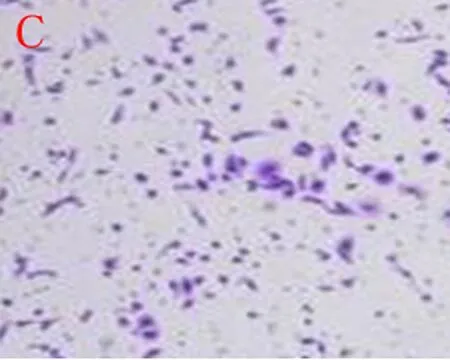
C:3%缺氧+VitC组
图33%缺氧24 h组乳腺癌细胞迁移能力

A: 正常对照组
B:3%缺氧组
C:3%缺氧+VitC组
图43%缺氧48 h组乳腺癌细胞迁移能力
3讨论
缺氧是实质性肿瘤局部微环境的基本特征之一。越来越多的研究表明缺氧是决定恶性肿瘤预后的重要因素,缺氧不仅可以促进肿瘤细胞的生长,更重要的是缺氧还可以诱导肿瘤细胞的转移和浸润性生长[6-7],但其机制尚不清楚。
HIF-1是哺乳动物细胞在缺氧条件下产生的一种转录因子,主要由HIF-1α、HIF-1β2个亚基组成。
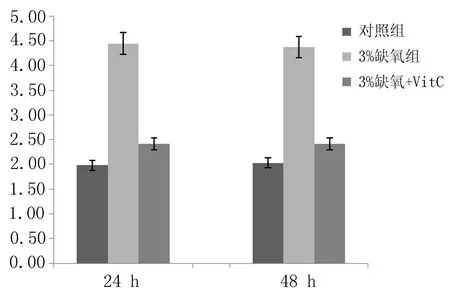
图5 各组乳腺癌细胞迁移能力比较
正常条件下,各组织HIF-1α的表达甚少,而低氧状态时,则表现为时间及低氧程度依赖性升高[8]。HIF-1广泛参与哺乳动物细胞中缺氧诱导产生的特异应答,介导机体的整体和局部缺氧反应,在缺氧诱导的基因表达调节中起着关键作用。 研究表明HIF-1α在多种恶性肿瘤,如乳腺癌、卵巢癌等的原发灶、转移灶、侵袭性癌细胞的前沿部位高表达,拮抗HIF-1α活性可以抑制肿瘤的形成和转移扩散[9]。基质细胞衍生因子1(stromal cell derived factor-1,SDF-1)属化学趋化因子超家族,其特异性的受体CXCR4是G蛋白偶联的7次跨膜受体,目前研究发现CXCR4 在多种肿瘤高表达,并可能在肿瘤发展、转移中发挥重要的作用[10-11]。本实验结果表明, 缺氧条件下的MDA-MB-231细胞的增殖能力明显增加,HIF-1α水平和迁移能力明显增加,说明缺氧增加MDA-MB-231细胞迁移可能与HIF-1α的表达有关。本研究通过RT-PCR 法从基因水平检测CXCR4 在乳腺癌细胞的表达,并分析其功能,结果显示缺氧能上调MDA-MB-231细胞CXCR4表达且增加其的迁移能力,提示缺氧可能与CXCR4表达和乳腺癌迁移能力增加有关。Kim等[7]对79 例手术切除的乳腺浸润性导管癌组织进行的研究表明, 所有患者的癌组织均表达CXCR4, 而高表达尤其是局灶性高表达者伴有广泛的淋巴结转移, 进一步说明CXCR4可能参与乳腺癌的淋巴转移。
VitC作为抗氧化刺,可以减少自由基的生成,能够有效拮抗缺氧引起的细胞损伤[12]。为了进一步探讨其机制,本研究观察抗氧化剂VitC对缺氧是否有拮抗作用,结果显示VitC能够有效抑制缺氧增加的HIF-1α和CXCR4 mRNA,并能抑制缺氧条件下细胞的迁移能力。说明缺氧可能通过增加乳腺癌细胞缺氧诱导因子HIF-1α表达、CXCR4表达及乳腺癌细胞迁移的迁移能力,为临床移植乳腺癌转移提供新的思路和治疗靶点。
综上所述,缺氧能增加细胞的增殖能力,能增加乳腺癌细胞HIF-1α、CXCR4mRNA表达和迁移能力,但能被抗氧化剂VitC有效阻断,可能为预防乳腺癌转移提供新的思路。
参考文献:
[1]Bendinelli P, Matteucci E, Maroni P,et al. NF-kappaB activation, dependent on acetylation/deacetylation, contributes to HIF-1 activity and migration of bone metastatic breast carcinoma cells[J]. Mol Cancer Res, 2009,7(2):1328-1341.
[2]Yang SX, Loo WT, Chow LW, et al. Decreased expression of C-erbB-2 and CXCR4 in breast cancer after primary chemotherapy[J]. J Transl Med,2012,10:(3) 67-69.
[3]Maroni P, Bendinelli P, Matteucci E, et al. HGF induces CXCR4 and CXCL12-mediated tumor invasion through Ets1 and NF-kappaB[J]. Carcinogenesis,2007,28(2):267-279.
[4]Sivrikoz ON, Doganay L, Sivrikoz UK, et al. Distribution of CXCR4 and gamma-catenin expression pattern in breast cancer subtypes and their relationship to axillary nodal involvement[J]. Pol J Pathol, 2013,64(7):253-259.
[5]Andreou K, Rajendran R, Krstic-Demonacos M, et al. Regulation of CXCR4 gene expression in breast cancer cells under diverse stress conditions[J]. Int J Oncol,2012,41(6):2253-2259.
[6]Lundgren K, Nordenskjold B, Landberg G. Hypoxia, Snail and incomplete epithelial-mesenchymal transition in breast cancer[J]. Bri J Cancer, 2009,101(3):1769-1781.
[7]Kim B, Park B. Baohuoside I Suppresses Invasion of Cervical and Breast Cancer Cells through the Downregulation of CXCR4 Chemokine Receptor Expression[J]. Biochemistry, 2014,53(3):7562-7569.
[8]Sun Y, Mao X, Fan C, et al. CXCL12-CXCR4 axis promotes the natural selection of breast cancer cell metastasis[J]. J Tumor Biol,2014,35(8):7765-7773.
[9]Vermeer LS, Fruhwirth GO, Pandya P, et al. NMR metabolomics of MTLn3E breast cancer cells identifies a role for CXCR4 in lipid and choline regulation[J]. J Proteome Res, 2012, 11(2):2996-3003.
[10]Song N, Huang Y, Shi H, et al. Overexpression of platelet-derived growth factor-BB increases tumor pericyte content via stromal-derived factor-1alpha/CXCR4 axis[J]. Anticancer Res,2009,69(2):6057-6064.
[11]Staller P, Sulitkova J, Lisztwan J, et al. Chemokine receptor CXCR4 downregulated by von Hippel-Lindau tumour suppressor pVHL[J]. Nature,2003,425(5):307-311.
[12]Papatheodorou H, Papanastasiou AD, Sirinian C, et al. Expression patterns of SDF1/CXCR4 in human invasive breast carcinoma and adjacent normal stroma: correlation with tumor clinicopathological parameters and patient survival[J]. Pathol Res Pract, 2014,210(10):662-667.
(本文编辑杨晨晨)

