石斛兰叶片再生体系的建立
冯 莹,赖钟雄
(1.泉州师范学院资源与环境学院,福建 泉州362000;2.福建农林大学园艺植物生物工程研究所,福建福州350002)
石斛兰(Dendrobium species.)是兰科石斛属多年生植物,属于“四大洋兰”之一,除了具有药用价值外,还具有较高的观赏价值[1].自然条件下,石斛兰分株能力弱,繁殖速度慢,不能满足市场和消费者的需求.1960年法国人Morel[2]利用茎尖组织培养无病毒植株,创立石斛无性繁殖技术,随后,石斛兰的研究备受关注[3-19,24-25],冯莹等[3]以石斛兰原球茎为材料,利用外源激素和糖优化原球茎的生长,为石斛兰遗传转化提供了良好的受体材料.以石斛兰原球茎为受体材料采用甘露醇预处理提高遗传转化效率[4],并获得转化ACS反义基因的转基因植株[5].目前,石斛兰离体培养研究主要从以茎段或茎尖为材料建立再生体系[6-10]、成熟或未成熟种胚为材料建立再生体系[12,13]、壮苗生根优化[14,15]、原球茎增殖优化[3,16,17]等方面开展,而以叶片外植体进行石斛兰离体再生体系建立的报道较少[18,19].此外,石斛兰叶片再生体系建立为石斛兰遗传转化、受体系统优化等相关研究奠定坚实的基础.本文以叶片为材料研究了石斛兰离体再生途径的建立,旨在解决叶片难诱导原球茎问题和提高石斛兰的再生能力,为保护濒危植物资源和基因工程研究提供有效的参考价值.
1 材料与方法
1.1 材料
石斛兰(Dendrobium spp.)叶片.
1.2 外植体消毒
将叶片置于流水中冲洗30 min,75%酒精浸30 s后,用0.1%升汞消毒8 min,最后用无菌水冲洗3次,获得无菌外植体.
1.3 方法
1.3.1 原球茎诱导 分别将无菌叶片切割成 0.5 cm×(0.3-0.5)cm 小块接种于 KC+6-BA(2.0、4.0、6.0 mg·L-1)+NAA(0.5、1.0 mg·L-1)培养基中,30 d 后统计原球茎的诱导率.各组合接种 5 瓶,每瓶接 5 片叶片切割的叶块,各处理重复3次.
1.3.2 原球茎增殖与分化 以原球茎为材料,原球茎切割成0.2-0.5 mm3的小块培养于不同培养基(表1)中.培养25 d后观察原球茎生长状态并统计原球茎增殖倍数和分化率.各组合6瓶,每瓶接入35-40个原球茎,各处理重复3次.
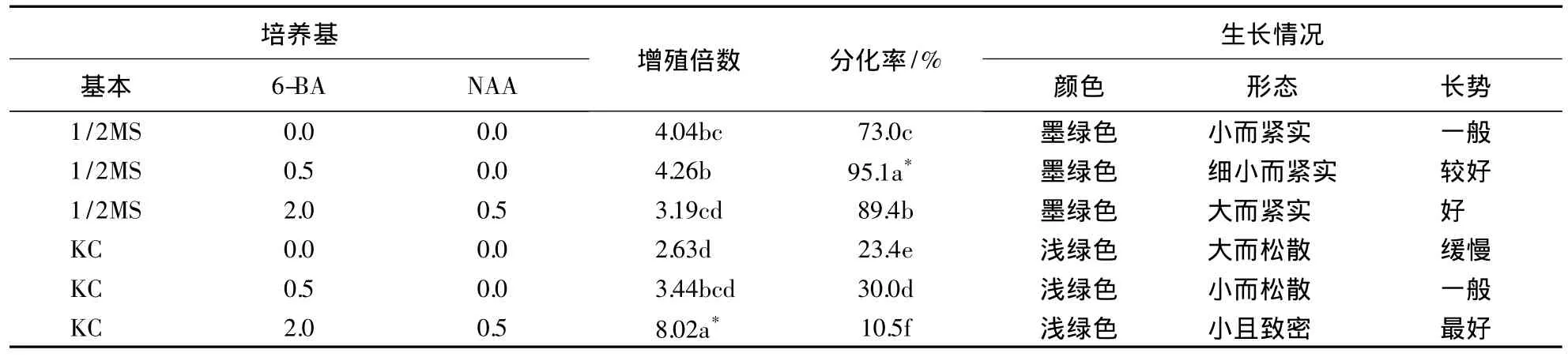
表1 石斛兰原球茎增殖与分化1)Table 1 Propogation and differentiation of PLBs in Dendrobium spp.
针对KC+2 mg·L-16-BA+0.5 mg·L-1NAA培养基中添加不同天然附加物(液体椰子汁、椰乳匀浆物、香蕉匀浆物、苹果匀浆物、马铃薯匀浆物、活性炭,其中除附加物活性炭的浓度为1.0 g·L-1外,其余浓度均为100.0 g·L-1)进行试验.各组合6瓶,每瓶接入35-40个原球茎,各处理重复3次.
1.3.3 壮苗和生根 以苗高为0.5 cm的石斛兰无根小苗为材料,以1/2MS(大量元素减半,其余各元素不变,以下均同)为基本培养基,添加NAA、6-BA和添加物,按L9(34)(其中NAA为因素1,3水平分别为1.0、1.5、2.0 mg·L-1;6-BA 为因素 2,3 水平分别为 0.0、0.2、0.4 mg·L-1,天然附加物为因素 3,3 水平分别为无添加物、100.00 g·L-1香蕉匀浆物、1.0 g·L-1活性炭)进行正交设计试验确定适宜的壮苗生根培养基.每瓶接4株,各组合8瓶,各处理重复3次.培养30 d后统计苗高和根数量及长度,并观察苗的生长状况.
1.3.4 移栽基质的筛选 选取苗高约2.0 cm且长势一致的小苗为材料,以水草、松树皮(移栽前将其碾成小块后,用水充分浸泡,并每隔1 d换1次水)、棕树皮(移栽前一段时间用水充分浸泡)、稻谷壳为移栽基质.移栽前将试管苗在自然条件下炼苗30 d后,洗去根部的培养基,用500 mg·L-1的多菌灵浸泡小苗5 min后,种植于不同移栽基质中,置于大棚中培养,每种处理30株小苗,30 d后统计其成活率.
1.4 培养条件与数据分析
培养基中添加 20 g·L-1白糖、6 g·L-1琼脂,pH 为 5.4,光照强度 1500 lx,光照时间 12 h·d-1,培养温度25±1℃.
诱导率=诱导出原球茎的叶片块数/总块数×100%;增殖倍数=(转接瓶数-原有瓶数)/原有瓶数;分化率(%)=分化成苗的原球茎总数/总原球茎数量×100%.用DPS软件分析数据,小写字母(a,b)表示差异显著性检测水平为0.05;大写字母(A,B)表示差异显著性检测水平为0.01.
2 结果与分析
2.1 不同激素组合对原球茎诱导的影响
叶片切割成小块后培养于培养基Ⅲ(KC+4.0 mg·L-16-BA+1.0 mg·L-1NAA)中诱导原球茎的效果好,其诱导率为11.99%,与其他组合呈极显著性差异(图1);原球茎主要是由叶片基部或叶尖部位诱导而来(图2-A).6-BA浓度为4.0 mg·L-1时易诱导原球茎,其浓度过高或过低时均不利于原球茎诱导;6.0 mg·L-16-BA培养时,叶片容易褐化死亡.

图1 叶片对原球茎的诱导率Fig.1 Rate of induced protocorm from leaves
2.2 不同培养基种类对原球茎增殖和分化的影响
不同培养基种类对原球茎增殖和分化具有不同的影响,从表1中可以看出:石斛兰原球茎在KC+2.0 mg·L-16-BA+0.5 mg·L-1NAA培养基中增殖倍数较高,原球茎能不断地自身繁殖,分化率低(图2-B).而 1/2MS+0.5 mg·L-16-BA 培养基中原球茎增殖倍数是 KC+2.0 mg·L-16-BA+0.5 mg·L-1NAA 培养基中的0.53倍,原球茎颗粒分化快(图2-C).1/2MS基本培养基培养的原球茎易分化,生长较快;KC基本培养基培养的原球茎分化慢,繁殖能力较好.因此,原球茎增殖的最佳培养基为KC+2.0 mg·L-16-BA+0.5 mg·L-1NAA,而分化培养基为 1/2MS+0.5 mg·L-16-BA.

图2 石斛兰的植株再生Fig.2 The regeneration of plantlets in Dendrobium spp.
2.3 不同添加物对原球茎增殖的影响
无附加物培养基中原球茎繁殖能力与其它附加物的呈显著性差异(表2).不同添加物对原球茎增殖的影响不同,椰子汁和椰乳对原球茎的生长表现出明显地不同,椰子汁培养基中原球茎增殖倍数是椰乳匀浆物的1.55倍,椰乳匀浆物培养基中原球茎易分化成苗;香蕉匀浆物培养基中原球茎生长缓慢,培养20 d开始出现黄色菌;苹果匀浆物培养基中原球茎表现出2种状态:1种为浅黄色,原球茎较大,表面有粉末状的物质形成,该物质无生长能力;2种为墨绿色,原球茎容易分化.马铃薯匀浆物培养基中原球茎易分化,且易生长菌类物质.活性炭培养基中原球茎生长缓慢,分化程度低.因此,采用无附加物的KC+2.0 mg·L-16-BA+0.5 mg·L-1NAA培养基适宜于原球茎的繁殖.

表2 天然附加物对石斛兰增殖和生长的影响1)Table 2 Effects of natural additives on propogation and growth of PLBs in Dendrobium spp.
2.4 不同培养基种类对石斛兰壮苗生根的影响
根据表3可知,小苗在1/2MS+1.0 mg·L-1NAA培养基上苗高和根长与其他组合达到极显著性差异.经正交方差分析表明:各因素影响生根的效果依次为天然附加物>NAA>6-BA;影响壮苗培养的效果依次为 6-BA>NAA>天然附加物.NAA 浓度为 1.0 mg·L-1时对生根培养的效果最好,优于 1.5 mg·L-1和 2.0 mg·L-1.6-BA不同浓度水平对壮苗及生根均无显著性差异.
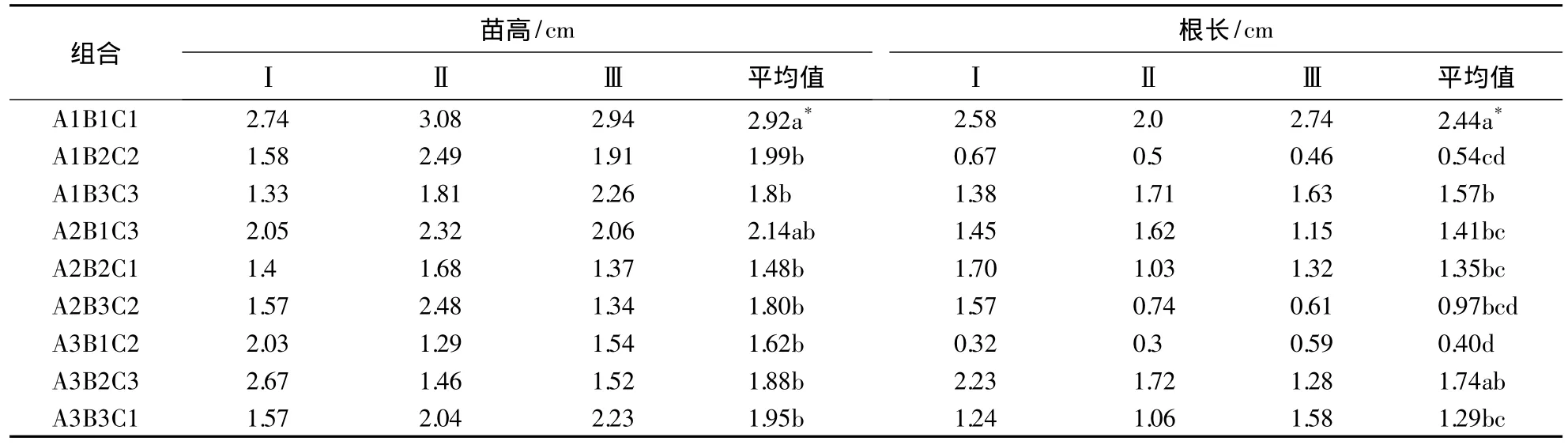
表3 培养基对石斛兰壮苗生根的影响1)Table 3 Effects of different media on the growth of roots in Dendrobium spp.
无根的小苗在1/2MS+1.0 mg·L-1NAA培养基中不仅高、粗壮,而且根系发达(表4,图2-D),植物长势很好(图2-E).不同附加物对石斛苗生根的效果影响效果依次为无附加物>香蕉>活性炭,香蕉匀浆物培养基中苗长势好,根较粗壮,但根系不发达,培养20 d后易出现黄色菌,苗生长缓慢,甚至逐渐枯萎死亡.活性炭培养基中苗长势一般,根生长势差,部分为乳白色,生活力较差,甚至有10%苗在培养90 d后仍然没有着生根.
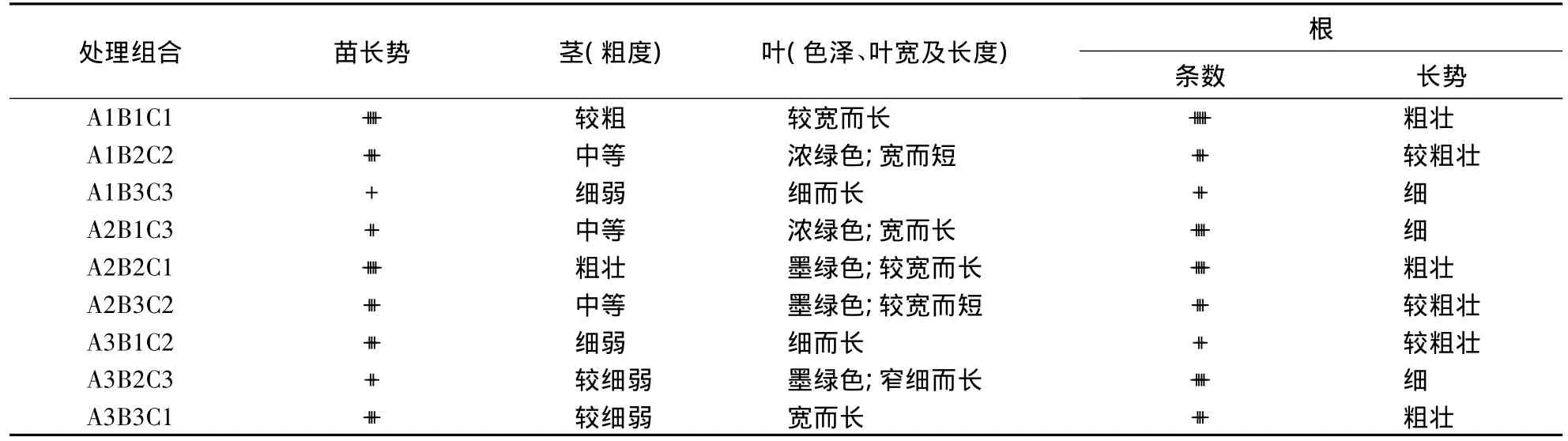
表4 培养基对石斛兰小苗生长的影响1)Table 4 Effects of different media on the growth of plantlets in Dendrobium spp.
2.5 移栽基质对石斛兰移栽成活的影响
石斛兰经过炼苗移栽于各种基质的成活率和生长势图3中分析:在大棚内移栽石斛兰试管苗时,最好的移栽基质为棕树皮,成活率达到93.33%,苗长势好,生长快(图2-F).稻谷壳移栽基质中苗成活率低,长势差,移栽后13 d苗开始出现较为严重的腐烂现象.松树皮移栽基质中苗生长较为缓慢,而水草移栽基质中苗的生长较快.
3 讨论
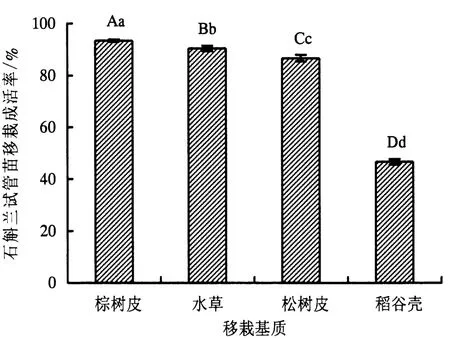
图3 移栽基质对石斛兰移栽成活率的影响Fig.3 Effects of different transferring media on the survival rate of Dendrobium spp.
叶片作为外植体是比较理想的材料来源,取材不受季节限制而且数量多.本研究以石斛兰叶片为材料诱导原球茎,其诱导率为11.99%.这可能是由于成熟幼叶对诱导反应极弱,这与王怀宇[20]的报道一致.如何有效地提高叶片外植体的原球茎诱导率有待于进一步研究.
基本培养基的选择是高效石斛兰离体培养的基础.研究中发现KC基本培养基适宜于石斛兰叶片原球茎诱导及其繁殖,而1/2MS基本培养基适宜于原球茎分化和壮苗生根培养.这可能是由于1/2MS、KC基本培养基中均含有和,植物生长时所需要的N源由供给,活性几乎完全受到抑制[21],1/2MS基本培养基中含量比KC基本培养基高,高浓度的能抑制细胞生长[22].
植物生长调节剂对石斛兰原球茎诱导和繁殖、苗分化和生长均有影响.6-BA低浓度有利于原球茎分化,高浓度对成苗起着抑制的作用.这与冯莹[3]、王国梅等[16]的研究报道一致.NAA有利于提高原球茎诱导率和苗生根.本研究中发现单独使用NAA对生根效果优于6-BA和NAA配合使用.这可能是由于6-BA、NAA分别属于细胞分裂素和生长素类,体现2类激素对植物生长的生理作用.适宜浓度的激素促进细胞分裂,促进细胞对营养物质(无机盐、糖、水等)的吸收,或激素被吸收后,作为信使,与激素受体结合,调节相关基因表达[23],进而引起一系列生理生化反应,启动基部细胞的生长,促使细胞不断分生.
天然附加物对石斛兰原球茎和苗的生长具有一定影响.天然附加物不利于原球茎和苗生长,这可能是由于天然附加物中含有糖,提高培养基的渗透压,影响其对生长物质的吸收.香蕉、马铃薯、苹果匀浆物不利于原球茎生长,与蒋林等[17]的报道一致.这可能由于匀浆物含有大量糖类物质或抑制原球茎生长的有机物质.这与李璐等[15]的报道不一致,可能是由于香蕉匀浆物使用的方式及其浓度不同.李小军等[24]指出香蕉上清夜有利原球茎生长,而沉淀物抑制其生长.活性炭不利于原球茎生长,与Nihar et al[25]的报道一致.这可能是由于活性炭具有吸附作用,吸附有害物质的同时也将培养基中能够促进石斛兰小苗生长的有用成分吸附,造成原球茎和苗生长缓慢.
[1]韦三立.花卉组织培养[M].北京:中国林业出版社,2001:120.
[2]MOREL G.Producing virus free Cymbidiums[J].American Orchid Society Bulletin,1960(29):495-497.
[3]冯莹,赖钟雄.外源激素和糖对石斛兰受体系统建立的影响[J].福建农林大学学报,2009,38(5):495-499.
[4]冯莹,赖钟雄.甘露醇在农杆菌转化石斛兰中的作用[J].生物技术通报,2009(6):112-116.
[5]冯莹,赖钟雄.石斛兰转ACS反义基因抗性原球茎及转化植株的筛选与鉴定[J].西北植物学报,2013,33(2):247-253.
[6]DEVI J,BORTHAKUR B,DEKA PC.Clonal Propagation of Denelrobium moschatum and Cymbidium aloifolium through shoottip culture[J].Journal of the Orchid Society of India,1997,11(1-2):19.
[7]GANGA M,SARASWATHI M S,CHEZHIYAN N.In vitro induction of multiple shoots in Dendrobium madras[J].Agricultural Journal of India,1999,86(1-3):78-80.
[8]MARTIN KP,MADASSERY J.Rapid in vitro propagation of Dendrobium hybrids through direct shoot formation from foliar ex-plants and protocorm-like bodies[J].Scientia Horticulturae,2006,108:95-99.
[9]KIM K K,KUNISAKI J T,SAGAWA Y.Shoof-tip culture of Dendrobium[J].American Orchid Society Bulletin,1970(39):1077-1080.
[10]鲁蓉蓉.不同激素水平下对石斛兰进行组织培养的影响分析[J].山东农业工程学院学报,2014,31(6):42-43.
[11]李璐.石斛兰试管开花及其分子机制研究[D].福州:福建农林大学,2010.
[12]卓孝康,兰思仁,彭东辉,等.大苞石斛胚组织培养及植株再生研究[J].福建林学院学报,2014,34(4):289-296.
[13]殷丽青,孙翊,周音,等.添加物和植物生长调节剂对铁皮石斛离体快速繁殖的影响[J].上海交通大学学报:农业科学版,2014,32(4):8-14.
[14]陈继敏,蓝伟泉,陈旭敏,等.不同添加物对石斛兰壮苗生根的影响[J].北方园艺,2009(3):78-81.
[15]李璐,赖钟雄,翁浩.春石斛和铁皮石斛试管苗壮苗生根条件的优化[J].福建农林大学学报:自然科学版,2011,40(1):31-36.
[16]王国梅,韦鹏霄,岑秀芬.基本培养基和激素组合对金钗石斛原球茎增殖的影响[J].广西农业科学,2006,37(1):10.
[17]蒋林,丁平,郑迎冬.添加剂对铁皮石斛组织培养和快速繁殖的影响[J].中药材,2003,26(8):539-541.
[18]周月坤,王伏雄.兜唇石斛幼叶再生植株的研究[J].植物学集刊,1989,12(4):123-126.
[19]叶秀粦.石斛兰组织培养和细胞学观察[J].园艺学报,1995,22(1):83-87.
[20]王怀宇.蝴蝶兰的快速无性繁殖[J].园艺学报,1989,16(1):74-77.
[21]SOLOMON L P,BARBER M J.Assimilatory nitrate reductase:Functional properties and regulation[J].Annual Review of Plant Physiology and Plant Molecular Biology,1999,41:225-253.
[22]AMY N K,CARRETT R H.Purification and characterization of the nitrate reductase from the diatom Thalassiosira pseudonana[J].Plant Physiology,1974,54:629-637.
[23]潘瑞炽.植物生理学[M].高等教育出版社,2008.
[24]李小军,刘石泉,潘维陵,等.香蕉提取物对霍山石斛试管苗壮苗的影响[J].江苏大学学报:自然科学版,2004,25(6):469-472.
[25]NIHAR R N,SHIBA P R,SATYANARAYAN P.In vitro propagation of three epiphytic orchids,Cymbidium aloifolium(L)Sw,Dendrobium aphyllum(Roxb)Fisch and Dendrobium moschatum(Buch Ham)Sw,through thidiazuron-induced high frequency shoot proliferation[J].Scientia Horticulturac,1997,71(3):240-250.

