hTfR基因在体外神经干细胞的表达研究
岳四海 郭永坤
郑州大学附属郑州中心医院神经外科 郑州 450007
干细胞是临床再生替代治疗极其重要的资源,干细胞移植治疗多种疾病的有效性和潜能日益受到重视,有着广阔的应用前景[1-5]。分子影像学,特别是MR 的发展使在活体状态下示踪移植干细胞成为现实。MR 具有极其精细的组织分辨率、空间分辨率、无游离辐射和非侵袭性等特点,通过MR报告基因介导的分子成像可以监测移植细胞的分布、动态迁移的过程以及与宿主的整合情况。其中人转铁蛋白受体(human transferrin receptor,hTfR)报告基因在MR 分 子成像中受到高度重视和广泛的关注[6]。本实验通过构建hTfR 慢病毒表达载体,为下一步以hTfR 为报告基因的活体干细胞MR 分子成像奠定基础,以期为今后临床活体示踪干细胞提供一种新的途径和方法。
1 材料和方法
1.1 材料
1.1.1 质粒和菌株:pENTR221-hTfR质粒购于广州复能基因有限公司;pLENTI6.3 载体由中国人民解放军北京军区总医院杨志军教授惠赠;E.coli DH5a 感受态细菌购于天根生化科技(北京)有限公司;小鼠神经干细胞胚胎来源CD1,小鼠神经干细胞由中国人民解放军北京军区总医院杨志军教授惠赠。
1.1.2 主要试剂:T4连接酶、限制性内切酶和碱性磷酸酶购自NEB 公司;琼脂糖凝胶回收试剂盒和质粒提取试剂盒购自OMEGA 公司;DAN Maker购自天根生化科技(北京)有限 公 司;lipofectamine 2000、Opti-MEM培养液、293T 细胞、B27、Neurobasal培养基、多聚赖氨酸均购于Sigma公司;DMEM 培养基、DMEM/F12(1∶1)培养基购于Hyclone公司;兔抗人转铁蛋白受体(hTfR)单克隆抗体购于Epitomics公司。
1.2 方法
1.2.1 PCR 引物的设计和合成:根据Genbank收录的hTfR序列(BC001188)设计引物,在上游引物的5'端加入Bamh1酶切位点和Kozak序列,下游引物的5'端加入BamH1酶切位点。上游引物序列:5'-CGC[GCCACC]ATGAT-GGATCAAGCTAGAGATCAGC-3'(下划线部分为BamH1酶切位点,括号内部分为Kozak 序列);下游引物序列:5'-CGCTTAAAACTCATTGCAATGTCCCAAC-3 '(下划线部分为BamH1酶切位点)。引物送北京六合华大基因科技股份有限公司合成。
1.2.2 PCR 扩增hTfR 基因和胶回收:为保证基因克隆的正确率,采用具有高保真性和高扩增效率的PfuDAN 聚合酶。以pENTR221-hTfR基因质粒为模板,扩增hTfR。PCR反应条件为:94°C预变性3min,94°C变性45s,60°C退火45s,72°C 延伸4 min,共25 个 循环,72°C 延伸10 min。PCR 产物经1%的琼脂糖凝胶电泳鉴定,按照试剂盒说明书回收目的基因。
1.2.3 重组质粒pLENTI6.3-hTfR-IRES-EGFP的构建:对空载体pLENTI6.3和PCR 的回收目的产物分别用BamH1进行酶切,反应条件为:37°C,4h;在酶切反应2h时用NEB的碱性磷酸酶进行去磷酸化反应,以减少载体自连产生假阳性克隆;对酶切载体进行1%的琼脂糖凝胶电泳后切胶回收;酶切目的片段的纯化,根据PCR 清洁试剂盒说明书进行。将去磷酸化的酶切载体和目的片段按5∶1的摩尔比例,用T4DNA 连接酶进行连接反应,4 ℃,连接过夜;次日连接产物转化E.coli DH5a感受态细菌,涂布氨苄(Amp)抗性LB平板,37 ℃摇菌过夜培养。
1.2.4 克隆鉴定:转化后,挑取单菌落,用上述设计合成好的PCR 的引物,进行PCR 扩增检测阳性菌落,反应条件为:94℃预变性3min,94变性45s,60℃退火45s,72℃延伸4 min,共25个循环,72°C 延伸10min;PCR 产物行1%的琼脂糖凝胶电泳后鉴定。挑取阳性菌落接种于5mL Amp 抗性的LB培养基中,37℃220r/min摇菌过夜培养;按质粒提取试剂说明书提取质粒,并行BamH1酶切,反应条件为:37℃,4h,酶切产物1%的琼脂糖凝胶电泳后鉴定。酶切鉴定符合理论值的质粒菌液送北京六合华大基因科技股份有限公司测序。
1.2.5 慢病毒颗粒的包装:接种293T 细胞,次日观察细胞密度,达到80%融合率时用制备的重组质粒pLenti6.3-hTfR-IRES-EGFP与PLP1、PLP2、PLP-VSVG 在转染试剂lipofectamine 2 000下共转染293T 细胞。培养6h后,更换完全培养液DMEM +10%FBS。转染48h后收集病毒上清,0.45μm 的滤器过滤;将病毒原液在50 000g下超速离心2 h,收集沉淀,重悬于opti-MEM 培养液中,取部分浓缩病毒液进行滴度测定,其余分装成小管保存于-80 ℃,用于下一步实验。
1.2.6 NSCs复苏培养及慢病毒的感染:将冻存的细胞从液氮中取出,快速转入到37 ℃水浴中,边解冻,边振荡,待细胞解冻;将细胞转移到2倍体积的神经干细胞培养基中,1 000 r/min,离心3min,去上清;神经干细胞培养基重悬细胞,调整细胞浓度,按1×106Cells/(6 mL·瓶)接种于25cm2的培养瓶,37 ℃,5%CO2培养箱中培养。取生长状态良好的第7代NSCs,接种到12孔板中培养3h后,每孔加入MOI值为10的病毒稀释液,设置空载体和空白细胞作为对照组。感染12h后半量换液一次,以后每24h半量换液1次,72h后倒置荧光显微镜下观察感染情况。
1.2.7 Western blot检测TfR 蛋白的表达水平:将1×106个过表达hTfR 的NSCs用200μL×SDS-PAGE蛋白上样缓冲液重悬,煮沸5~10min直接裂解,提取总蛋白,设置EGFP-NSCs组和NSCs组作为对照。各组取15μL 蛋白上样,经10%SDS-PAGE 凝胶电泳、半干转法将蛋白样品转移到PVDF膜、5%BSA 封闭1h,兔抗人hTfR 单克隆抗体(1∶1 000),4 ℃孵育过夜,二抗为辣根过氧化物酶标记的羊抗兔多克隆抗体(1∶2 000),室温孵育1h,化学荧光检测。
2 结果
2.1 hTfR 基因的扩增 以pENTR221-hTfR 为模板,经PCR 扩增后,1%的琼脂糖凝胶电泳可见1条长约2 283bp的亮带,与理论值一致。见图1。
2.2 重组载体酶切鉴定和测序 提取菌落阳性克隆8的质粒,行BamH1酶切,1%的琼脂糖凝胶电泳,结果显示:酶切图谱有11条长约2 283bp的亮带。见图2。送北京六合华大基因科技股份有限公司测序。测序结果显示:hTfR 基因序列正确,无突变或缺失。以上结果表明pLENTI6.3-hTfRIRES-EGFP 重组慢病毒表达载体构建成功。

图1 hTfR PCR 产物电泳结果图
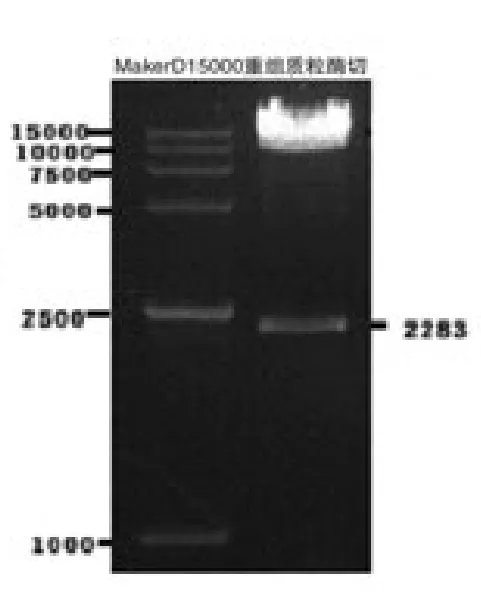
图2 pLENTI6.31-hTfRIRES-EGFP重组慢病毒表达载体BamH1酶切后电泳图
2.3 hTfR 在NSCs中的荧光表达 慢病毒感染48h后可见部分细胞开始有微弱绿色荧光出现,其后绿色荧光逐渐增强,72h可见几乎每个神经球都有绿色荧光,部分神经球荧光比较强,表明hTfR慢病毒成功高效的感染NSCs。见图3。

图3 hTfR 在NSCS中的荧光表达
2.4 Western blot检测hTfR 蛋白的表达水平 目的条带出现在相对分子量为90u区域附近,与理论值一致,hTfRNSC组蛋白表达量明显高于EGFP-NSC 组和NSC 组,对照组hTfR 的表达量很低,结果显示实验组细胞的hTfR 的表达水平明显增加。见图4。

图4 Western blot检测hTfR 蛋白的表达结果1.hTfR-NSC组;2.EGFP-NSC组;3.NSC组
3 讨论
hTfR 是一种广泛分布于细胞膜的跨膜糖蛋白,但其表达具有明显的组织分布差异性,在高增殖的基底上皮细胞和肠上皮细胞等有较高水平的表达,也在非增殖的细胞中表达,如脑毛细血管内皮细胞、肝细胞、胰腺、睾丸细精管等。hTfR位于人的第3 号染色体,编码区(CDS)长2 283bp。hTfR 的表达主要受细胞内铁的水平进行转录后水平的调节,hTfR mRNA3'端非编码区存在5个连锁作用的铁效应元件(five iron response elements,IRE)是hTfR 表达调控的关键结构,这些铁的效应元件被2种RNA 结合的铁调节蛋白(iron regulatory proteins,IRP)识 别,并 控 制mRNA的稳定性[7]。当细胞内铁不足时,IRP-1 结 合IRES 增加了TfR mRNA 的稳定性,因此TfR 的mRNA 被翻译,增加了细胞表面的TfR。
目前,干细胞活体非侵袭性示踪的分子影像学技术主要有光学成像、核素成像和磁共振成像(MRI)等。相比其他技术,MRI有着极其精细的空间分辨率和组织分辨率,对深层组织成像无困难,且无电离辐射,已广泛用于临床;对于移植的干细胞,MRI还可以获得移植周围组织的解剖和生理信息,包括移植灶周围的水肿和炎症,这些为临床医生提供了更多的信息,有助于了解细胞移植治疗的各个方面[8]。以报告基因为基础的MRI具有MR 信号不会或很少受干细胞分裂的影响,且报告基因的表达产物可以反映干细胞的功能和活力等优点[9-10]。目前,用于MRI的报告基因有β-半乳糖苷酶、酪氨酸酶、转铁蛋白受体、铁蛋白、富含赖氨酸蛋白等,其中转铁蛋白受体的报告基因应用最为广泛[11]。hTfR 是细胞膜上的受体蛋白,与特异性配体转铁蛋白(Tf)结合介导Fe的细胞内转运。在MR 的分子影像中,将hTfR 基因导入干细胞,干细胞过表达hTfR,与Tf连接的磁性氧化铁即Tf的分子探针,通过转铁蛋白受体介导的内吞作用转运到细胞内。这样干细胞内磁性氧化铁纳米颗粒的蓄积,实现了MRI信号的逐步放大,提高了对干细胞信号的敏感性,从而获得MR T2WI上特征性的低信号[12]。Wang 等[13]应用转铁蛋白受体(TfR)作为报告基因,转铁蛋白偶联的超小顺磁性氧化铁纳米颗粒的复合物(Tf-USPIO)作为MR 的报告探针,对小鼠MDA-MB-231 细胞的乳腺癌的动物模型静脉注射Tf-USPIO 分子探针,发现肿瘤MR T2的弛豫时间比较对照组显著缩短,表明转铁蛋白受体为报告基因成功进行了MR活体分子成像,可以对内皮抑制素基因的表达和治疗进行了活体动态监测。目前的研究表明,TfR 报告基因介导的Tf-USPIO 分子探针的细胞转运和蓄积,能够对TfR 进行MR基因显像和示踪,并可以检测TfR 的表达水平[14-16]。
与其他病毒载体系统相比,慢病毒可以稳定高效的感染分裂和非分裂细胞,无明显免疫反应,同时能够转染广泛的组织等优点,近年来被广泛用于基因的转导载体[17-20]。因此通过慢病毒介导的基因转导,使报告基因在靶细胞稳定的表达,从而达到长期检测的目的。本实验中,只扩增了hTfR 编码区2 283bp,去除了细胞内Fe对的调控。采用高保真的Pfu DNA 聚合酶扩增目的片段,减少了碱基的错配或突变。对于重组质粒的鉴定,首先进行了简单快速的菌落PCR 初步筛选鉴定,用初步筛选的阳性克隆,摇菌、小提质粒、酶切鉴定和基因测序,结果证实pLENTI6.3-hTfR-IRES-EGFP重组慢病毒表达载体的构建成功。本实验应用慢病毒包装系统包装出含有hTfR 基因的高滴度病毒,高效地感染到NSCs中。Western blot分蛋白证实了hTfR 的过表达。
干细胞低水平表达hTfR,且受细胞内IRE 的负反馈调节[8],无法实现以hTfR 为标记物的MR 分子影像成像。因此,如果利用转基因的方法,将hTfR 基因导入干细胞内,使其过表达hTfR,因而干细胞可摄取较多的磁性氧化铁纳米颗粒,使其在MR T2WI信号特异性减低,从而达到对移植后干细胞长期无侵袭性的活体示踪。我们构建的pLENTI6.3-hTfR-IRES-EGFP重组慢病毒载体,还带有EGFP 报告基因,通过组织冰冻切片的荧光显微镜检测,进行离体状态下的EGFP报告基因荧光成像,从而达到活体和离体检测的相互印证。本实验为下一步进行NSCs体外、体内的MR 分子成像研究奠定了基础。
[1]Giralt SA,Horowitz M,Weisdorf D,et al.Review of stem-cell transplantation for myelodysplastic syndrmoes in older patients in the context of the Decision Memo for Allogeneic Hematopoietic Stem Cell Transplantation for Myelodysplastic Syndrome emanating from the Centers for Medicare and Medicaid Services[J].J Clin Oncol,2011,29(5):566-572.
[2]Sharp J,Frame J,Siegenthaler M,et al.Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants improve recovery after cervical spinal cord injury[J].Stem Cells,2010,28(1):152-163.
[3]Kisseleva T,Gigante E,Brenner DA.Recent advances in liver stem cell therapy[J].Curr Opin Gastroenterol,2010,26(4):395-402.
[4]Couzin J.Biotechnology.Celebration and concern over U.S.Trial of embryonic stem cells[J].Science,2009,323(5 914):568.
[5]Gonzales C,Pedrazzini T.Progenitor cell therapy for heart disease[J].Exp Cell Res,2009,315(18):3 077-3 085.
[6]Gilad AA,Keren Z,Michael T,et al.MR reporter genes[J].J Nucl Med,2008,49(12):1 905-1 908.
[7]Zhang CY,Lu J,Tsourkas A.Iron chelator-based amplification strategy for improved targeting of transferrin receptor with SPIO[J].Cancer Biology &Therapy,2008,7(6):889-895.
[8]Cromer Berman SM,Walczak P,Bulte JW.Tracking stem cells using magnetic nanoparticles[J].Wiley Interdiscip Rev Nanomed Nanobiotechnol,2011,3(4):343-355.
[9]Rodriguez-Porcel M.In Vivo Imaging and Monitoring of Transplanted Stem Cells:Clinical Applications[J].Curr Cardiol Rep,2010,12(1):51-58.
[10]Liu J,Cheng EC,Long RC,et al.Noninvasive Monitoring of Embryonic Stem Cells In Vivo with MRI Transgene Reporter[J].Tissue Eng Part C Methods,2009,15(4):739-747.
[11]Liu J,Cheng EC,Long RC,et al.Noninvasive Monitoring of Embryonic Stem Cells In Vivo with MRI Transgene Reporter[J].Tissue Eng Part C Methods,2009,15(4):739-747.
[12]Moore A,Josephson L,Bhorade RM,et al.Human transferrin receptor gene as a maker gene for MR imaging[J].Radiology,2001,221(1):244-250.
[13]Wang K,Wang KZ,Shen BZ,et al.MR Reporter Gene Imaging of Endostatin Expression and Therapy[J].Mol Imaging Biol,2010,12(5):520-529.
[14]Thorek DL,Tsourkas A.Size,charge and concentration dependent uptake of iron oxide particles by non-phagocytic cells[J].Biomaterials,2008,29(26):3 583-3 590.
[15]Waerzeggers Y,Monfared P,Viel T,et al.Methods to monitor gene therapy with molecular imaging[J].Methods,2009,48(2):146-160.
[16]Nakase I,Gallis B,Takatani-Nakase T,et al.Transferrin receptor dependent cytotoxicity of artemisinin-transferrin conjugates on prostate cancer cells and induction of apoptosis[J].Cancer Lett,2009,274(2):290-298.
[17]Dropulic B.Lentiviral Vectors:Their Molecular Design,Safety,and Use in Laboratory and Preclinical Research[J].Hum Gene Ther,2011,22(6):649-657.
[18]Warlich E,Kuehle J,Cantz T,et al.Lentiviral vector design and imaging approaches to visualize the early stages of cellular reprogramming[J].Mol Ther,2011,19(4):782-789.
[19]Lin Y,Cheung P,Roth JC,et al.Imaging stem cell derived persistent foci after in vivo selection of lentiviral MGMTP140Ktransduced murine bone marrow cells[J].Mol Ther,2011,19(7):1 342-1 352.
[20]Pomper MG,Hammond H,Yu X,et al.Serial imaging of human embryonic stem-cell engraftment and teratoma formation in live mouse models[J].Cell Res,2009,19(3):370-379.

