干扰素联合拉米夫定治疗HBeAg阳性代偿期乙型肝炎肝硬化儿童患者疗效和安全性研究
董 漪,张鸿飞,徐志强,陈大为,甘 雨,王丽旻,王福川,闫建国,张 敏,朱世殊
干扰素联合拉米夫定治疗HBeAg阳性代偿期乙型肝炎肝硬化儿童患者疗效和安全性研究
董 漪,张鸿飞,徐志强,陈大为,甘 雨,王丽旻,王福川,闫建国,张 敏,朱世殊
目的研究干扰素(interferon,IFN)联合拉米夫定(LAM)治疗HBeAg阳性代偿期乙型肝炎肝硬化儿童患者的疗效与安全性。方法给予26例入选患者IFN(3~6 MU/m2,1次/隔日)联合LAM[3 mg/(kg·d)]治疗48周,观察基线和治疗12、24、36、48周的HBV血清学标志物、HBV DNA定量、生化指标及不良反应。结果治疗12、24、36、48周时HBeAg清除率分别为30.8%、42.3%、53.8%和53.8%,HBeAg血清学转换率分别为23.1%、34.6%、46.2%和46.2%,HBsAg清除率分别为0、11.5%、19.2%和19.2%,HBsAg血清学转换率分别为0、3.8%、19.2%和19.2%,HBV DNA低于检测下限率分别为38.5%、53.8%、73.1%和84.6%,ALT复常率分别为88.5%、92.3%、92.3%和96.2%。随着疗程的延长,HBeAg清除/血清学转换率、HBsAg清除/血清学转换率、HBV DNA低于检测下限率和ALT复常率均逐渐升高(P均<0.05)。未见明显不可耐受的不良反应。结论IFN联合LAM治疗HBeAg阳性代偿期乙型肝炎肝硬化儿童患者具有良好的疗效和安全性。
肝硬化;干扰素类;拉米夫定;乙型肝炎e抗原;儿童
代偿期乙型肝炎(乙肝)肝硬化的治疗目标是延缓和降低肝功能失代偿和肝癌的发生,目前指南均推荐核苷(酸)类似物的长期应用,对于干扰素(interferon,IFN)主张慎重使用,或从小剂量开始[1]。但是IFN在慢性乙肝(chronic hepatitis B,CHB)治疗中的抗病毒及免疫调节双重作用,以及长期应用核苷(酸)类似物病毒变异和耐药的问题,使得一部分学者致力于研究单用IFN或IFN联合核苷(酸)类似物在成人代偿期乙肝肝硬化中的应用[2-5]。相对于儿童,此类研究则更少,这也缘于对儿童这一特殊群体用药安全性的担忧。为此,我中心进行了IFN联合拉米夫定(LAM)治疗HBeAg阳性代偿期乙肝肝硬化儿童患者的疗效和安全性的相关研究。
1对象与方法
1.1对象本研究纳入2010年7月—2015年7月在解放军第三〇二医院青少年肝病诊疗与研究中心住院确诊为HBeAg阳性代偿期乙肝肝硬化的儿童患者(年龄≤14岁)26例,诊断符合2000年《病毒性肝炎防治方案》[6]和2010年版《慢性乙型肝炎防治指南》[1]的标准。研究方案经医院伦理委员会同意(2012135D),所有患者家长均签署知情同意书。
1.1.1入选标准HBsAg和HBeAg均阳性超过半年,血清HBV DNA>2000 IU/ml,ALT≤10×正常值上限(upper limit of normal,ULN),TBIL≤2×ULN,凝血酶原时间及活动度正常,腹部B超、CT或MRI提示:肝硬化。患者均经肝脏穿刺检查明确为肝硬化(病理提示肝纤维化程度分期为S3~4和S4)。
1.1.2排除标准入选前6个月用过抗病毒药物及免疫调节药物;合并HAV、HCV、HDV、HEV、巨细胞病毒、EB病毒感染;失代偿期肝硬化;合并甲状腺疾病、自身免疫性疾病。
1.2治疗方法给予患者IFN α-1b(深圳科兴生物工程有限公司),1次/隔日,肌内注射,起始治疗剂量为1MU/隔日,根据患者耐受情况逐渐增加到预定的治疗剂量(3~6 MU/m2);联合LAM 3 mg/(kg·d)(最大剂量100 mg/d)[葛兰素史克制药(苏州)有限公司],口服,疗程共48周。
1.3观察指标①在基线及治疗12、24、36、48周时分别检测HBV血清学标志物(HBsAg、HBsAb、HBeAg、HBeAb和HBcAb)、HBV DNA定量、HBsAg定量及肝脏生化指标。其中HBV血清学标志物检测使用罗氏Roche Cobas 6000全自动电化学发光免疫分析仪及配套试剂,HBV DNA定量检测采用实时荧光定量聚合酶链反应法(FQ-PCR),试剂购自上海科华生物工程股份有限公司,检测下限为40 IU/ml,HBV DNA<40 IU/ml为阴性。HBsAg定量检测使用罗氏配套试剂,HBsAg<0.05 IU/M为阴性。②在基线及治疗12、24、36、48周时分别检测血常规、尿常规、肾功能、甲状腺功能、自身抗体,以及行腹部B超检查,进行安全性评价。③在基线及治疗24、48周时测量身高和体质量,进行生长发育评价。
1.4疗效评价指标①主要评价指标:HBeAg清除/血清学转换率以及HBsAg清除/血清学转换率。②次要评价指标:HBV DNA低于检测下限率和ALT复常率。
1.5统计学处理采用CHISS 2004软件进行统计分析。计量资料呈正态分布,用±s表示,治疗前后比较用自身配对t检验。计数资料以率表示,多组间率的比较用R×C χ2检验或确切概率法,率的多重比较用Scheffe法。P<0.05表示差异有统计学意义。
2结果
2.1基线特征26例HBeAg阳性儿童患者中,男21例,女5例,年龄1~11岁(中位数4岁),母婴传播感染25例。患者基线ALT(181.19±94.91)U/L,HBVDNA(7.74±1.01)log10IU/L,HBsAg定量(12 464.03± 18 171.21)IU/L;基因B型4例,C型22例;肝组织炎症活动度G1有1例,G2有19例,G3有6例。
2.2主要疗效指标26例患者经IFN联合LAM治疗后,HBeAg清除/血清学转换率以及HBsAg清除/血清学转换率均随着疗程的延长逐渐升高。其中治疗12、24、36、48周HBeAg清除率分别为30.8%(8/26)、42.3%(11/26)、53.8%(14/26)和53.8%(14/ 26),呈上升趋势(χ2=12.677,P=0.013),但36周和48周差异无统计学意义;HBeAg血清学转换率分别为23.1%(6/26)、34.6%(9/26)、46.2%(12/26)和46.2%(12/26),呈上升趋势(χ2=11.369,P=0.023),但36周和48周差异无统计学意义(图1)。12、24、36、48周HBsAg清除率分别为0(0/26)、11.5%(3/ 26)、19.2%(5/26)和19.2%(5/26),呈上升趋势(χ2= 8.971,P=0.006),但36周和48周差异无统计学意义;HBsAg血清学转换率分别为0(0/26)、3.8%(1/26)、19.2%(5/26)和19.2%(5/26),呈上升趋势(χ2=11.008,P=0.027),但36周和48周差异无统计学意义(图2)。其中出现HBsAg清除/血清学转换的5例基线HBsAg定量为(4965.67±1147.43)IU/L,与没有出现HBsAg清除/血清学转换的21例HBsAg定量[(14320.81±19387.64)IU/L]比较明显偏低,但因例数较少,未做统计学分析。

图1 治疗12、24、36、48周HBeAg清除/血清学转换率Figure 1Rates of HBeAg loss/seroconversion at 12,24, 36 and 48 weeks of treatment
2.3次要疗效指标26例患者经IFN联合LAM治疗后HBV DNA水平随着疗程的延长明显下降,HBV DNA基线为(7.74±1.01)log10IU/L,48周疗程结束时为(2.08±1.14)log10IU/L,平均下降(5.65±1.51)log10IU/L,治疗前后差异有统计学意义(表1)。其中HBV DNA低于检测下限率(<40IU/ml)12周为38.5%(10/26),24周为53.8%(14/26),36周为73.1%(19/26),48周时达到84.6%(22/26),呈上升趋势(χ2=18.525,P=0.001),见图3。ALT基线为(181.19±94.91)U/L,48周疗程结束时为(19.08± 9.85)U/L,平均下降(162.11±92.46)U/L,治疗前后差异有统计学意义(表1)。ALT复常率12、24、36、48周分别为88.5%(23/26)、92.3%(24/26)、92.3%(24/26)和96.2%(25/26),呈上升趋势(含基线值χ2=21.740,P=0.000),但12周后差异无统计学意义,见图3。
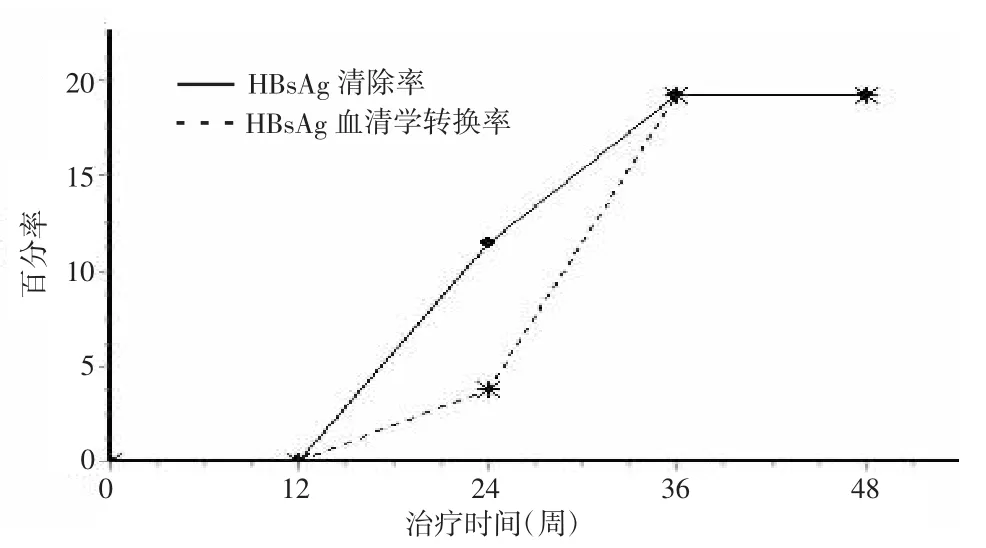
图2 治疗12、24、36、48周HBsAg清除/血清学转换率Figure 2Rates of HBsAg loss/seroconversion at 12,24, 36 and 48 weeks of treatment
表1 治疗前后HBV DNA和ALT水平(±s)Table 1Levels of HBV DNA and ALT before and after treatment(±s)

表1 治疗前后HBV DNA和ALT水平(±s)Table 1Levels of HBV DNA and ALT before and after treatment(±s)
?

图3 治疗12、24、36、48周HBV DNA低于检测下限率和ALT复常率Figure 3Rates of serum undetectable HBV DNA/ALT normalization at 12,24,36 and 48 weeks of treatment
2.4安全性评价48周治疗期间无患者因不良反应退出研究。其中19例患者在IFN开始治疗1~2周内出现中度发热,经退热处理体温正常,以后逐渐耐受,无发热。出现轻度头痛和肌肉酸痛2例。轻度食欲下降3例。中性粒细胞绝对值≤1.0×1092例。1例36周出现轻度甲状腺功能减低症,在继续治疗同时经内分泌科会诊给予甲状腺素片治疗,1个月后甲状腺功能恢复正常。1例出现持续抗核抗体阳性(核均质型1∶100)。体质量无增加或减轻3例,身高无增长1例,尿常规、肾功能均正常。1例48周出现LAM耐药(rtM204V阳性)。
3讨论
1992年至今,我国通过接种乙肝疫苗显著降低了儿童HBV感染率,目前5岁以下儿童感染率已降至1%以下,但是由于我国一般人群7.18%的HBsAg携带率[1],所以儿童乙肝的防治依然任重道远。本研究中,除1例因为被抱养,其生母HBsAg情况不详外,其余25例的母亲均HBsAg阳性,出生后均全程接种乙肝疫苗进行母婴阻断,有6例还联合注射乙肝免疫球蛋白。
HBV感染时的年龄是影响慢性化的最主要因素,在围产期和婴幼儿时期感染HBV者中,分别有90%和25%~30%将发展成慢性感染[1]。患者感染HBV后多处于免疫耐受期,但是有一部分患者很快进入免疫清除期,出现肝功能异常和肝脏持续病变,迅速进展甚至出现肝硬化和肝衰竭。本研究中,最早有出生后6个月即出现肝功能异常;26例中1~3岁12例(46.2%),3~7岁10例(38.5%),7~14岁4例(15.3%);ALT为65~361(181.19±94.91)U/L;肝组织炎症活动度≥G2有25例,占96.2%;肝组织纤维化程度分期S3~4有22例,S4有4例。对于这一部分已发展到肝硬化的患者,治疗是刻不容缓的,关键和有效的抗病毒治疗才能阻止肝脏病变的活动性进展。但是儿童CHB的治疗面临许多问题和争议,如缺乏高等级循证医学证据、抗病毒药物缺少儿童适应证等。美国食品药品监督管理局(Food and Drug Administration,FDA)已批准5种药物可用于治疗儿童CHB:IFN α可用于≥12个月儿童,LAM可用于≥3岁儿童,阿德福韦酯和替诺福韦酯可用于≥12岁儿童,恩替卡韦可用于≥16岁患者[7]。2014年3月FDA新批准恩替卡韦可用于≥2岁儿童[8]。
目前指南对成人和儿童代偿期乙肝肝硬化都主张慎重使用IFN,主要担心其诱发过度免疫反应反而加重肝损伤,导致失代偿和肝衰竭。指南均推荐长期应用核苷(酸)类似物[1,7-8]。但有研究发现经IFN治疗1年,成人肝硬化患者HBeAg清除率达50%,远高于非肝硬化患者的29%(P=0.030)[3]。另一项研究发现肝硬化组经聚乙二醇IFN α-2b治疗78周后HBV DNA和HBeAg转阴率远高于无肝硬化组,而2组不良反应发生率相似[5]。长期应用核苷(酸)类似物不可避免出现耐药和复发问题,都可能导致病情进展和生存率下降。因此,我们尝试将IFN和LAM联合治疗HBeAg阳性代偿期乙肝肝硬化儿童患者。为避免IFN诱发过度免疫的风险,IFN从小剂量开始,个体化治疗,根据患者耐受情况逐渐增加到预定治疗剂量。同时密切观察不良反应,尤其是肝功能变化。另外本研究中有12例1~3岁患者,在与其家长充分沟通并签署知情同意书后应用LAM,治疗过程中密切随访。
本研究入选的26例患者治疗48周后,HBeAg清除率为53.8%,HBeAg血清学转换率为46.2%,HBsAg清除/血清学转换率为19.2%,HBV DNA低于检测下限率为84.6%,ALT复常率为96.2%。随着疗程的延长,HBeAg清除/血清学转换率、HBsAg清除/血清学转换率、HBV DNA低于检测下限率以及ALT复常率均逐渐升高,显示出很好的疗效。这与年龄小患者(1~7岁)占84.6%,感染HBV时间较年龄大儿童和成人短以及入组患者肝功能明显异常、肝组织炎症重有关。本研究中有5例获得HBsAg清除/血清学转换,接近临床治愈,5例均为1~3岁患者,与文献报道5岁以下儿童IFN的反应更好一致[9]。与没有出现HBsAg清除/血清学转换患者比较,其基线HBsAg定量明显偏低,尽管无统计学意义,仍然提示HBsAg定量是一个很好的疗效预测指标,水平越低,经过治疗HBsAg清除/转换率越高。本研究也提示在密切观察不良反应,尤其是肝功能变化的情况下,应用IFN治疗儿童代偿期肝硬化是安全有效的,没有进展到失代偿。本研究还发现IFN在儿童患者中的不良反应如流感样症状、胃肠道反应、中性粒细胞减少、甲状腺功能异常和体质量降低等与成人类似,甚至比成人发生率低,这也与本中心既往研究报道一致[10]。不良反应在停药后可逆,对生长发育没有明显影响,提示代偿期肝硬化儿童患者对IFN耐受性好,应用安全。当然,今后须扩大样本量及进一步完成停药后随访工作才能得出更多结论。
IFN具有抗病毒及免疫调节的双重作用,其有限疗程、较高的HBeAg甚至HBsAg清除/血清学转换率、停药后持久应答以及不会出现基因耐药的优点,在成人CHB治疗中有不可替代的作用。同样,IFN应用于儿童CHB的治疗也已超过10年,2010年12月《美国儿童慢性乙型肝炎治疗会议纪要》中建议IFN可用于1~12岁的代偿性CHB患者[11]。但是IFN单药治疗高病毒载量CHB效果欠佳,应用不方便,出现不良反应及部分患者不能耐受IFN,都导致在儿童中的应用受到一定限制。LAM是第1个上市的核苷(酸)类似物,可快速抑制HBV复制,应用于儿童CHB的疗效和安全性已得到广泛证明。在一项LAM治疗151例儿童CHB的长期随访试验中,治疗1年82%的患者获得持续HBeAg血清学转换,治疗2年或以上超过90%的患者获得持续HBeAg血清学转换。长期随访未见相关严重不良事件发生,且对患者身高和体质量无影响[12]。另外,LAM在治疗HIV感染儿童时,3月龄~12岁儿童推荐剂量为每次4 mg/kg,2次/d,最大剂量为300 mg/d[13],远远超过治疗乙肝儿童的用量[3 mg/(kg·d)]。但是由于LAM容易耐药,3年耐药率达64%[14],所以欧洲儿科胃肠病、肝病和营养学协会2013年的《儿童慢性乙型肝炎诊治指南》中建议LAM应当限制在对IFN α治疗无应答、须快速抑制病毒及其他特殊人群中应用[7]。IFN与LAM是2类作用靶点不同的抗病毒药物,联合应用可发挥协同作用,提高疗效,减少耐药发生,在儿童CHB治疗中前景很好[15-16],本研究结果也印证了这一点。联合治疗可能是未来的一个发展方向,但是需要更多的研究数据。
[1]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].传染病信息,2011,24(1):Ⅲ-ⅩⅤ.
[2]Ikeda K,Saitoh S,Suzuki Y,et al.Interferon decreases hepatocellular carcinogenesis in patients with cirrhosis caused by the hepa-titis B virus:a pilot study[J].Cancer,1998,82(5):827-835.
[3]Van Zonneveld M,Honkoop P,Hansen BE,et al.Long-term follow-up ofalpha-interferon treatment of patients with chronic hepatitis B[J].Hepatology,2004,39(3):804-810.
[4]Ikeda K,Kobayashi M,Saitoh S,et al.Significance of hepatitis B virus DNA clearance and early prediction of hepatocellular carcinogenesis in patients with cirrhosis undergoing interferon therapy:long-term follow up of a pilot study[J].J Gastroenterol Hepatol,2005,20(1):95-102.
[5]Buster EHCJ,Hansen BE,Buti M,et al.Peginterferon alpha-2b is safe and effective in HBeAg-positive chronic hepatitis B patients with advanced fibrosis[J].Hepatology,2007,46(2):388-394.
[6]中华医学会传染病与寄生虫病学分会,中华医学会肝病学分会.病毒性肝炎防治方案[J].传染病信息,2000,13(4):141-150.
[7]Sokal EM,Paganelli M,Wirth S,et al.Management of chronic hepatitis B in childhood:ESPGHAN clinical practice guidelines: consensus of an expert panel on behalf of the European Society of Pediatric Gastroenterology,Hepatology and Nutrition[J].Hepatology,2013,59(4):814-829.
[8]WHO.Guidelines for the prevention,care and treatment of persons with chronic hepatitis B infection[EB/OL].[2015-07-12].http: //www.who.int/hiv/pub/hepatitis/hepatitis-b-guidelines/en/.
[9]Kobak GE,MacKenzie T,Sokol RJ,et al.Interferon treatment for chronic hepatitis B:enhanced response in children 5 years old or younger[J].J Pediatr,2004,145(3):340-345.
[10]张鸿飞,杨晓晋,朱世殊.α干扰素治疗小儿慢性肝炎副作用的长期观察[J].中华实验和临床病毒学杂志,2000,14(4): 376-378.
[11]Jonas MM,Block JM,Haber BA,et al.Treatment of children with chronic hepatitis B virus infection in the Untied States:patient selection and therapeutic options[J].Hepatology,2010,52(6):2192-2205.
[12]Jonas MM,Little NR,Gardner SD.Long-term lamuvidine treatment of children with chronic hepatitis B:durability of therapeutic responses and safety[J].Viral Hepat 2008,15(1):20-27.
[13]中华医学会感染病学分会艾滋病学组.艾滋病诊疗指南(2011版)[J].中华传染病杂志,2011,29(10):629-640.
[14]Sokal EM,Kelly DA,Mizerski J,et al.Long-term lamivudine therapy for children with HBeAg-positive chronic hepatitis B[J]. Hepatology,2006,43(2):225-232.
[15]Yilmaz A,Akcam M,Gelen T,et al.Lamivudine and high-dose interferon alpha 2a combination treatment in naïve HBeAg-positive immunoactive chronic hepatitis B in children:an East Mediterranean center′s experience[J].Eur J Pediatr,2007,166(3):195-199.
[16]Akman SA,Okcu SC,Halicioglu O,et al.Therapeutic efficacy of sequential and simultaneous treatments with interferon-alpha and lamivudine in children with chronic hepatitis B[J].Pediatr Int,2007, 49(6):848-852.
(2015-08-04收稿 2015-09-05修回)
(责任编委 张玲霞 本文编辑 王 姝)
Efficacy and safety of interferon combined with lamivudine in treatment of cirrhotic children with HBeAg-positive compensated hepatitis B
DONG Yi,ZHANG Hong-fei,XU Zhi-qiang,CHEN Da-wei, GAN Yu,WANG Li-min,WANG Fu-chuan,YAN Jian-guo,ZHANG Min,ZHU Shi-shu*
Pediatric Liver Diseases Treatment and Research Center,302 Hospital of PLA,Beijing 100039,China
ObjectiveTo evaluate the efficacy and safety of interferon(IFN)combined with lamivudine(LAM)in treatment of cirrhotic children with HBeAg-positive compensated hepatitis B.MethodsTwenty-six enrolled patients received combination treatment with IFN(3-6 MU/m2,once on alternate days)and LAM[3 mg/(kg·d)]for 48 weeks.The data of HBV serologicalmarkers,HBV DNA,biochemical parameters and adverse reactions were collected at baseline and 12,24,36 and 48 weeks of treatment.ResultsAt 12, 24,36 and 48 weeks of treatment,the rates of HBeAg loss were 30.8%,42.3%,53.8%and 53.8%,the rates of HBeAg seroconversion were 23.1%,34.6%,46.2%and 46.2%,the rates of HBsAg loss were 0,11.5%,19.2%and 19.2%,the rates of HBsAg seroconversion were 0,3.8%,19.2%and 19.2%,the rates of serum undetectable HBV DNA were 38.5%,53.8%,73.1%and 84.6%,and the rates of ALT normalization were 88.5%,92.3%,92.3%and 96.2%.As the treatment duration prolonged,there was an increase in the rates of HBeAg loss/seroconversion,HBsAg loss/seroconversion,undetectable HBV DNA and ALT normalization(P<0.05).No obviously intolerable adverse reaction was found.ConclusionCombination treatment with IFN and LAM in treatment of cirrhotic children with HBeAg-positive compensated hepatitis B is effective and safe.
cirrhosis;interferons;lamivudine;hepatitis B e antigens;child
R575.2
A
1007-8134(2015)05-0000-00
10.3969/j.issn.1007-8134.2015.05.000
解放军第三〇二医院院内科题(YNKT2010002);首都卫生发展科研专项(2011-5003-02)
100039北京,解放军第三〇二医院青少年肝病诊疗与研究中心(董漪、张鸿飞、徐志强、陈大为、甘雨、王丽旻、王福川、闫建国、张敏、朱世殊)
朱世殊,E-mail:302zss@sina.com
*Corresponding author,E-mail:302zss@sina.com

