联合治疗策略在应答不佳/耐药HBeAg阳性慢性乙型肝炎患者中的临床研究
金 怡,黄春洋,魏飞力,何智敏,马丽娜,陈新月
·论著·
联合治疗策略在应答不佳/耐药HBeAg阳性慢性乙型肝炎患者中的临床研究
金 怡,黄春洋,魏飞力,何智敏,马丽娜,陈新月
目的比较采用聚乙二醇干扰素(pegylated interferon,Peg-IFN)+核苷(酸)类似物(nucleotide and nucleos(t)ide analogues,NAs)和NAs+NAs二种方案治疗NAs治疗应答不佳/耐药的HBeAg阳性慢性乙型肝炎(chronic hepatitis B,CHB)的疗效和安全性,探求具有停药终点的优化治疗方案。方法选择NAs抗病毒治疗应答不佳/耐药的HBeAg阳性CHB患者110例,根据既往NAs用药史、耐药检测结果及个人意愿,采用Peg-IFN+NAs(IFN组)或NAs+NAs(NA组)进行抗病毒治疗。比较2组在治疗48周和96周时完全病毒学应答(HBV DNA<20 IU/ml)率、HBeAg血清学转换率及HBsAg清除/血清学转换率。结果IFN组58例,NA组52例,2组分别有45例和42例完成96周疗程。在治疗48周IFN组和NA组的完全病毒学应答率分别为96.6%(56/58)和67.3%(35/52);96周分别为100%(45/45)和71.4%(30/42),IFN组均高于NA组(P值分别为<0.001和0.001)。IFN组在治疗48周和96周HBeAg血清学转换率(20.69%、46.7%)高于NA组(5.77%、21.4%),差异有统计学意义(P=0.013)。24、48、96周时IFN组HBsAg水平明显低于NA组。截至96周IFN组8例(17.8%)HBsAg清除,其中3例(6.7%)发生HBsAg血清学转换。NA组在治疗96周出现1例(2.3%)HBsAg清除。IFN组的HBsAg清除率高于NA组(P= 0.045)。结论对于NAs治疗应答不佳/耐药的CHB患者,采用Peg-IFN+NAs和NAs+NAs的治疗方案均可有效抑制病毒复制;但在HBeAg血清学转换及HBsAg清除方面,Peg-IFN+NAs联合治疗方案更具优势。采用以IFN为基础的联合治疗可使NAs应答不佳/耐药患者获得可靠的停药终点。
乙型肝炎,慢性;干扰素类;乙型肝炎e抗原;抗病毒药;治疗结果
随着对慢性乙型肝炎(chronic hepatitis B, CHB)抗病毒治疗的普及,越来越多的患者接受了核苷(酸)类似物(nucleotide and nucleos(t)ide analogues,NAs)抗病毒治疗。虽然NAs治疗能够有效抑制HBV DNA复制,但其HBeAg血清学转换率较低,难以达到免疫控制的停药终点,随着用药时间的延长和长期用药患者的增加,HBV发生NAs相关的耐药概率增加。目前对NAs耐药的再治疗共识,均是以NAs+NAs为联合治疗方案,以HBV DNA抑制程度或转阴率作为疗效评估的标准,极少涉及HBeAg和HBsAg转阴/血清学转换这个能停药的标准。虽然有效抑制病毒复制也能改善病毒学和生化学应答,但仍然要求患者长期服药以维持疗效,在长期NAs联合治疗中仍有发生耐药甚至多位点或多药耐药的风险[1]。研究表明聚乙二醇干扰素(pegylated interferon,Peg-IFN)α不仅具有较高的HBeAg血清学转换率,而且联合治疗也显示在降低拉米夫定(LAM)耐药发生率方面具有优势[2]。因此,我们拟对NAs治疗应答不佳或耐药的CHB患者,采用Peg-IFN┼NAs和NAs┼NAs二种联合治疗方法,探求具有停药终点的优化治疗方案。
1对象与方法
1.1对象本研究为前瞻性研究,研究对象为2008年3月—2012年12月在首都医科大学附属北京佑安医院接受长期NAs抗病毒治疗应答不佳/耐药的HBeAg阳性CHB患者110例,其中男77例,女33例,年龄18~70(37.55±10.63)岁。诊断符合2005年中国《慢性乙型肝炎防治指南》[3]的诊断标准,并符合本研究对应答不佳/耐药的定义:使用NAs抗病毒药物>48周,在服药依从性良好的情况下HBV DNA下降<2 log10IU/ml或发生病毒学反弹或实验室直接测序法检测到相关的基因型耐药。根据患者既往NAs用药史、耐药检测结果及个人意愿,分别入组到Peg-IFN┼NAs(IFN组,58例)和NAs┼NAs(NA组,52例)再治疗。
1.2治疗方案、疗程及停药标准①NA组:参照2008年《乙型肝炎病毒耐药专家共识》[4],加用无交叉耐药的NAs;②IFN组:在加用或换用无交叉耐药的NAs[4]基础上,联用Peg-IFN α-2a(135 ug/周或180 ug/周)。由于本研究入组病例均为NAs经治且疗效不佳/耐药的难治性患者,预计疗程为48~96周。对于疗程已达96周,仍未达到下述停药标准的患者,停用Peg-IFN,以NAs维持治疗。本研究的停药标准:HBV DNA<20 IU/ml,并达到HBeAg血清学转换,伴或不伴有HBsAg清除/血清学转换。NA组达到停药标准后至少巩固治疗1年,IFN组至少巩固治疗半年;若期间HBsAg较基线下降>1 log10IU/ml,则继续治疗至96周,以追求HBsAg清除/血清学转换。
1.3疗效评价本研究主要评价治疗48周和96周节点时病毒学及血清学指标,疗效评价的定义为:①完全病毒学应答,即指HBV DNA<20 IU/ml;②HBeAg血清学转换,即指HBV DNA<20 IU/ml,同时HBeAg消失、抗HBe出现;③HBsAg清除或血清学转换,在达到HBeAg血清学转换基础上伴有HBsAg清除或血清学转换。
1.4实验室检查①HBV DNA定量采用罗氏COMBAS TaqMan PCR系统检测,HBV DNA检测下限为20 IU/ml。②血清HBV标志物采用化学发光法检测(罗氏公司),HBsAg<0.05 IU/ml为阴性,HBeAg<1.0 COI为阴性。③耐药检测采用PCR产物直接测序法(双脱氧终止法),其中目的基因的扩增使用ntPCR技术以改善检测灵敏度。测序结果校正及耐药变异判定:使用ContigExpress和Bioedit软件,对测序结果进行拼接、校正。将拼接校对后的测序结果提呈到Stanford大学的耐药分析网页,参照其version 0.8耐药基因库(http://www.hiv-grade. de/hbv_grade/deployed/grade.pl?program=hbvalg&action=showSequenceForm)进行虚拟表型分析,随后对不同位点的核苷酸耐药变异进行判定。
1.5统计学处理使用SPSS 19.0软件对数据进行统计分析。连续变量呈正态分布,用±s表示。2组间计量资料比较采用成组t检验,计数资料比较用四格表χ2检验。2组间各时间点计量资料的比较用重复测量设计资料的方差分析,计数资料采用R×C χ2检验。P<0.05表示差异有统计学意义。
2结果
2.1一般资料及基线特征本研究纳入的110例中,IFN组58例,NA组52例。2组性别、年龄、基线ALT和HBV DNA水平、基因型分布等差异不大,具有可比性(表1)。
2.2既往用药情况110例中既往NAs单药治疗47例;63例曾序贯或联合使用过2种或以上NAs。2组用药方式差异不大,具有可比性。见表2。
2.3耐药检测情况对110例均进行耐药检测,总检测阳性率为60.91%(67/110),其中NA组耐药检测阳性率为55.77%(29/52),IFN组耐药检测阳性率为65.52%(38/58)。耐药检测阳性的患者中单药耐药占89.55%(60/67),多药耐药占10.45%(7/67)。本文单药耐药指:仅检测到对LAM/替比夫定(Ldt)或阿德福韦酯(ADV)或恩替卡韦(ETV)一种NAs耐药[6]。其中LAM/Ldt相关单药耐药36例,ADV相关耐药16例,ETV耐药8例。多药耐药指:出现对至少2种无交叉耐药谱的NAs同时耐药。7例多药耐药均为LAM/Ldt┼ADV耐药,未检测到ETV┼ADV耐药病例。2组单药耐药和多药耐药分布情况及A181T/V共同通道发生率差异不大,具有可比性(表3)。

表1 CHB患者一般资料及基线特征Table 1Demographics and baseline characteristics of CHB patients enrolled in this study

表2 2组既往用药情况(例)Table 2Previous medications of the two groups(cases)
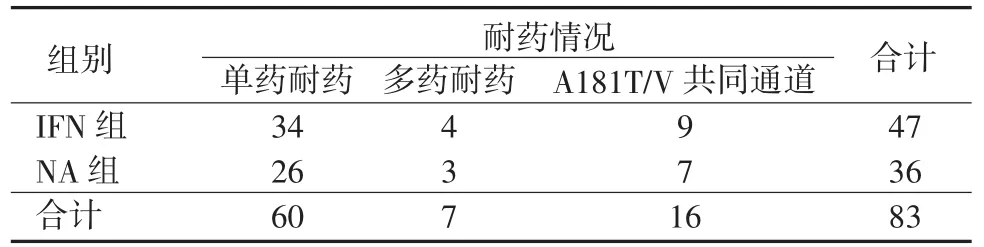
表3 耐药情况(例)Table 3Drug resistance(cases)
2.4治疗方案及疗程完成情况2组所采取的具体抗病毒治疗方案见表4。目前所有患者均完成了48周的治疗,IFN组和NA组分别有45例和42例已完成96周疗程,停药随访情况待报。
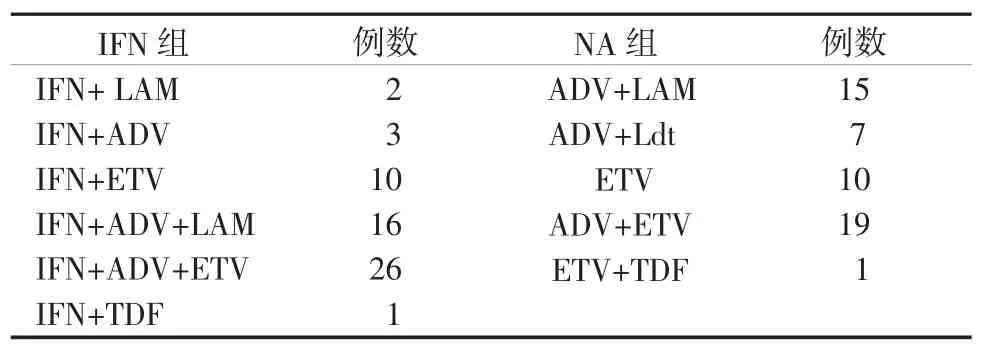
表4 抗病毒治疗方案Table 4Antiviral treatment regimens
2.5抗病毒疗效分析
2.5.1HBV DNA
2.5.1.1HBV DNA下降情况观察HBV DNA水平的变化,IFN组在24、48、72、96周HBV DNA分别为(0.82±1.30)、(0.42±0.95)、(0.42±0.71)、(0.41± 0.80)log10IU/ml;NA组分别为(1.36±1.71)、(1.37± 2.10)、(1.37±1.92)、(1.62±2.80)log10IU/ml。和NA组比较:在上述治疗节点IFN组HBV DNA水平均低于NA组,2组差异有统计学意义(F=18.581,P= 0.001)。2组各个随访点HBV DNA水平与基线水平相比均明显下降(IFN组:F=176.437,P=0.001;NA组:F=51.499,P=0.001)。见图1。
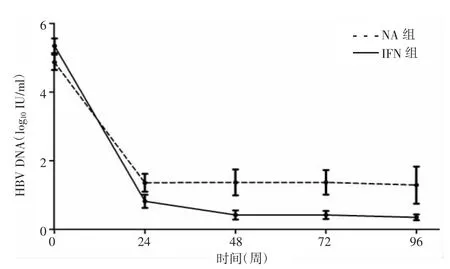
图1 2组治疗期间HBV DNA变化情况Figure 1Changes of HBV DNA during treatment in the 2 groups
2.5.1.2发生病毒学突破及耐药检测情况治疗期间IFN组2例出现病毒学突破,占3.45%(2/58),NA组11例出现病毒学突破,占21.15%(11/52),NA组病毒学突破率明显高于IFN组(χ2=6.243,P=0.012)。对所有发生病毒学突破者再次行耐药检测,NA组耐药检测阳性率54.55%(6/11例),其中2例检测到新发耐药位点。IFN组2例耐药检测均为阴性。
2.5.1.3完全病毒学应答率如图2所示,随着治疗时间的延长,2组患者HBV DNA<20 IU/ml的比例逐渐增加,IFN组在24、48、96周时的完全病毒学应答率分别为70.7%(41/58)、96.6%(56/58)和100%(45/45),而NA组相应节点仅为65.4%(34/52)、67.3%(35/52)和71.4%(30/42),IFN组在48周及96周明显高于NA组,差异均有统计学意义(χ2=16.410、14.914;P=0.001和0.001)。

图2 2组治疗期间完全病毒学应答率Figure 2Complete virological response during treatment in the 2 groups
2.5.2HBeAg
2.5.2.1HBeAg滴度变化治疗期间2组HBeAg水平均呈进行性下降,IFN组和NA组在治疗24、48、72、96周与各自基线比较HBeAg(log10COI)下降均有统计学意义(IFN组:F=32.964,P=0.001;NA组:F=13.649,P=0.001)。与NA组相比,IFN组上述节点的HBeAg滴度下降更明显(F=23.630,P= 0.001)。见图3。

图3 2组治疗期间HBeAg滴度变化Figure 3Changes of HBeAg titer during treatment in the 2 groups
2.5.2.2HBeAg血清学转换率IFN组和NA组各有45例和42例完成96周疗程。96周IFN组和NA组HBeAg转换率分别为46.67%(21/45)和21.43%(9/42),二者比较差异有统计学意义(χ2=6.125,P=0.013),如图4所示48周时IFN组HBeAg转换率[20.6%(12/58)]即高于NA组[5.7%(3/52)],差异有统计学意义(χ2=5.183,P=0.023)。其中IFN组48周获得HBeAg血清学转换的12例中4例符合停药标准,在72周停药,随访至96周时,4例均维持HBeAg血清学转换,但HBV DNA<20 IU/ml者仅1例,其余3例HBV DNA为4.2×102~1.6× 104IU/ml,ALT均正常。另外8例虽然符合停药标准,但HBsAg滴度较基线下降>1 log10 IU/ml,故在延长治疗中,追求HBsAg清除或血清学转换。
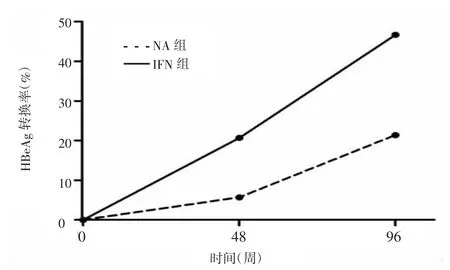
图4 2组治疗期间HBeAg血清学转换率情况Figure 4Changes of HBeAg/Anti-HBe seroconversion rates during treatment in the 2 groups
2.5.3HBsAg
2.5.3.1HBsAg水平变化情况IFN组HBsAg滴度随疗程延长呈进行性下降,在48、96周均明显低于基线,分别为(3.03±0.13)、(2.18±0.26)log10IU/ml,差异有统计学意义(F=19.264,P=0.001);NA组HBsAg滴度下降不明显。相同时间节点2组间比较:IFN组在48、96周时HBsAg水平明显低于NA组,差异有统计学意义(F=18.285,P<0.001)。见图5。
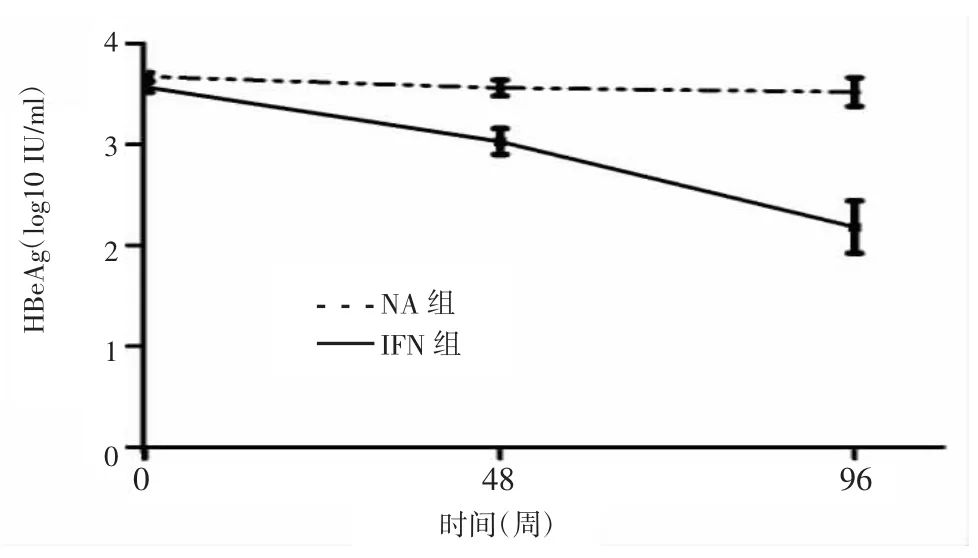
图5 2组治疗期间HBsAg滴度变化Figure 5Changes of HBsAg during treatment in the 2 groups
2.5.3.2HBsAg清除/转换率完成96周治疗的IFN组中共有8例(17.78%)获得HBsAg清除,其中3例(6.67%)出现抗HBs抗体。完成96周的NA组中仅有1例(2.38%)获得HBsAg清除。IFN组HBsAg清除率明显高于NA组(χ2=4.017,P=0.045)。
2.5.3.3HBsAg低水平优势人群如图6所示,在IFN组由于HBsAg水平进行性下降,改变了HBsAg低水平人群的构成比。48周时HBsAg>1500 IU/ml的人数从基线时的47例减少到35例,而HBsAg≤1500 IU/ml的人数从12例增加到23例。48周时HBsAg≤100 IU/ml的14例中有3例在96周获得HBsAg清除;HBsAg≤10 IU/ml的4例中有3例在96周获得HBsAg清除。故我们认为HBsAg滴度≤100 IU/ml是HBsAg清除的优势人群。此外,从48周到96周,HBsAg≤100 IU/ml的人数从14例增加到19例;HBsAg≤10 IU/ml的人数从4例增加到8例。在48周获得HBeAg血清学转换伴有HBsAg滴度明显下降,进而延长治疗的8例中,有4例在96周获得HBsAg清除。因此,我们认为对于HBsAg低水平优势人群应进一步延长治疗,以争取获得理想的治疗终点。

图6 HBsAg低水平优势人群分布Figure 6Distribution of advantage population with lower HBsAg level
2.6安全性本研究中NA组的耐受性良好,IFN组不良反应发生率较高。2组在治疗期间均未因出现不良反应而停止治疗方案。IFN组治疗过程中39例(67.24%)出现IFN相关不良反应,其中流感样症状34例(58.62%),乏力30例(51.72%),血细胞减少(包括WBC<3.0×109/L、中性粒细胞<1.5×109/L或PLT<75×109/L)29例(50.00%),头痛8例(13.79%),注射部位红肿10例(17.24%),体质量下降(下降>10%)3例(5.17%),脱发15例(25.86%)。3例中性粒细胞降至0.8×109/L以下,经过调整用药间隔同时服用升白细胞药物后逐渐好转。IFN组96周与48周相比未见到新不良反应的发生,原有不良反应未见加重。
3讨论
针对NAs治疗应答不佳/耐药患者的治疗,既往文献都是以加用无交叉耐药的NAs进行挽救治疗,以HBV DNA得到抑制为评判标准,但这并不是抗病毒治疗的可靠停药终点。本研究采用NAs┼IFN治疗,是以获得比较可靠的停药终点为目标,结果显示IFN组的疗效优于NA组。首先,结果显示2种治疗方案在抑制病毒复制方面均有效,但是IFN组在48周和96周的完全病毒学应答率(96.6%、100%)均高于NA组(67.3%、71.4%),差异有统计学意义(P=0.015、0.002)。表明NAs┼IFN的挽救治疗方法优于NAs┼NAs。同时,与以往有关耐药治疗的文献报道相比本研究的疗效较好。例如:日本一项针对LAM┼ADV治疗132例LAM耐药患者的研究显示,治疗2年病毒学应答率为80%[5];而另一项研究针对YMDD变异阳性的HBeAg阴性患者,接受ADV单药或ADV、LAM联合治疗3年,ADV单药组和联合组HBV DNA低于检测下限的比例分别达到71%和78%[6]。另外,本研究在治疗期间NA组11例出现病毒学突破,占21.2%(11/52),6例耐药检测阳性,其中2例检测到新发的耐药位点。可以看到NAs┼NAs的联合治疗并没有彻底解决耐药问题,还有可能诱导新的耐药,给后续治疗增加了难度。IFN组亦有2例出现病毒学突破,但耐药检测均为阴性。2例患者HBV DNA升高同时均伴有ALT升高及HBeAg水平下降,其中1例伴有明显的HBsAg下降,用一般的耐药难以解释,继续予以原方案治疗,2~4周后复查HBV DNA均<20 IU/ml,继续随访至96周,2例均发生了HBeAg血清学转换。究其原因可能与IFN清除病毒的同时伴随的免疫损伤有关,导致了ALT升高及HBV一过性释放。这提示在IFN┼NAs治疗中出现病毒学突破时,须结合HBV DNA、HBeAg及HBsAg的精准检测结果,全面具体地分析。
随着病毒载量的下降,NA组和IFN组患者的HBeAg水平均逐渐下降,IFN组48周和96周HBeAg滴度比NA组下降更明显(P值分别为<0.001和0.006)。累计至96周IFN组HBeAg血清学转换率为46.67%(21/45)明显高于NAs组的21.43%(9/42例),当然停药后随访的结果有待进一步观察。以往临床上对NAs应答不佳/耐药人群再治疗的方案均为NAs┼NAs联合治疗[7-8],故以HBV DNA抑制率或转阴率为主要的疗效评估指标,较少涉及HBeAg血清学转换。近几年NAs┼IFN治疗NAs耐药的CHB患者的研究得到更多的关注。岳伟等[9]针对rtN236T位点变异的ADV耐药CHB患者(65例),随机给予Peg-IFN α-2a┼ADV或LAM┼ADV治疗,结果表明HBV DNA转阴率分别为60.6%和34.4%,HBeAg血清学转换率分别为48.5%和18.8%(P均<0.05)。提示Peg-IFN α-2a┼ADV组疗效相对较好,但总体疗效并不令人十分满意,可能因为IFN联合治疗组未能选择与ADV无交叉耐药的NAs,或IFN疗程相对较短。另一项针对LAM耐药患者的研究采用Peg-IFN α-2a单药治疗48周或换为ADV单药治疗72周,前者HBeAg血清学转换率为14.6%(18/123),而ADV组仅为3.8%(3/80)[10]。由此可见,对于LAM耐药的患者,不论是换用Peg-IFN还是换用无交叉耐药的NA,其总体疗效均不佳。与既往文献相比,本研究中应用NAs┼IFN作为NAs应答不佳/耐药患者的治疗方案,结果显示其在病毒学应答及HBeAg血清学转换方面均有较好表现,对于NAs应答不佳/耐药患者只有同时获得病毒学应答和HBeAg血清学转换才是可靠的停药终点,只有不再需要NAs维持治疗,才能真正解决NAs耐药问题。
本研究治疗方案与以往文献的不同之处在于疗程较长,这缘于停药标准是HBV DNA<20 IU/ml,同时HBeAg血清学转换,NA组巩固1年,IFN组巩固半年。总体疗程较长使我们观察到IFN组在治疗过程中HBsAg下降,甚至趋于转阴的患者。而HBsAg清除是目前评估疗效的最佳指标,因此针对这部分患者进一步延长疗程,以争取获得HBsAg清除。
本研究显示:在HBsAg应答方面,IFN组也比NA组更有优势。48周和96周差异有统计学意义。截至96周,IFN组8例出现HBsAg清除,达到理想的治疗终点,而NAs组仅1例出现HBsAg清除(P= 0.045)。HBsAg定量可反映免疫控制,是IFN疗效评估与预测的重要指标[11-13]。本研究中IFN组HBsAg水平进行性下降,显著改变了不同疗程节点HBsAg低水平人群的构成比。经过48周治疗,HBsAg≤1500 IU/ml增加了91.67%。48周时HBsAg≤100 IU/ml及≤10 IU/ml的患者中分别有21.43%(3/14)和75.0%(3/4)在96周获得HBsAg清除。因此我们认为HBsAg<100 IU/ml者是HBsAg转阴的优势人群。本研究在48周对于8例已经获得HBeAg血清学转换并且HBsAg水平显著下降的患者,并没有按照常规停药,而是予以延长治疗,最终在96周有4例获得HBsAg清除。因此,我们认为在对NAs应答不佳/耐药患者给予IFN为基础的治疗中,也应该监测HBsAg。如果HBsAg明显下降应延长治疗以获得理想的治疗终点。对于HBsAg低水平人群也值得进一步延长治疗,争取获得理想的治疗终点。当然,获得HBsAg清除的只是少部分患者,因此要留意HBsAg低水平优势人群,不要错过获得HBsAg清除的最佳治疗时机。
同时我们要兼顾“有效、安全”的原则,本研究的安全性总体情况良好,IFN组的安全性和单用IFN治疗[10-11]相似,96周与48周相比未发生新的不良反应,原有不良反应也未加重。在安全的前提下,筛选出HBsAg清除的优势人群,适当延长疗程,可以追求更高的治疗目标。因此,我们认为以IFN为基础的联合治疗方案在NAs应答不佳/耐药患者中的临床应用,值得进一步扩大和推广。
[1]Liu Y,Wang C,Zhong Y,et al.Genotypic resistance profile of hepatitis B virus(HBV)in a large cohort of nucleos(t)ide analogueexperienced Chinese patients with chronic HBV infection[J].J Viral Hepat,2011,18(4):e29-e39.
[2]Lau GK,Piratvisuth T,Luo KX,et al.Peginterferon Alfa-2a, lamivudine,and the combination for HBeAg-positive chronic hepatitis B[J].N Engl J Med,2005,352(26):2682-2695.
[3]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南[J].传染病信息,2005,18(增刊):1-12.
[5]Yatsuji H,Suzuki F,Sezaki H,et al.Low risk of adefovir resistance in lamivudine-resistant chronic hepatitis B patients treated with adefovir plus lamivudine combination therapy:two-year follow-up[J].J Hepatol,2008,48(6):923-931.
[6]Lampertico P,Viganò M,Manenti E,et al.Low resistance to adefovir combined with lamivudine:a 3-year study of 145 lamivudineresistant hepatitis B patients[J].Gastroenterology,2007,133(5): 1445-1451.
[7]乙型肝炎病毒耐药专家委员会.乙型肝炎病毒耐药专家共识:2009年更新[J/CD].中华实验和临床感染病杂志(电子版),2009,3(1):72-79.
[9]岳伟,袁宏,毛小荣,等.不同策略治疗rtN236T位点变异的HBeAg阳性慢性乙型肝炎的疗效观察[J].中华肝脏病杂志,2013, 21(3):184-188.
[10]Sun J,Hou JL,Xie Q,et al.Randomised clinical trial:efficacy of peginterferon alfa-2a in HBeAg positive chronic hepatitis B patients with lamivudine resistance[J].Aliment Pharmacol Ther, 2011,34(4):424-431.
[4]乙型肝炎病毒耐药专家委员会.乙型肝炎病毒耐药专家共识[J/CD].中华实验和临床感染病杂志(电子版),2008,2(1): 90-98.
[14]Reddy KR,Wright TL,Pockros PJ,et al.Efficacy and safety of pegylated(40-kd)interferon alpha-2a compared with interferon alpha-2a in noncirrhotic patients with chronic hepatitis C[J]. Hepatology,2001,33(2):433-438.
[15]Cooksley WG,Piratvisuth T,Lee SD,et al.Peginterferon alpha-2a (40kDa):anadvanceinthetreatmentofhepatitisBe antigen-positive chronic hepatitis B[J].J Viral Hepat,2003,10 (4):298-305.
[11]Peng CY,Lai HC,Li YF,et al.Early serum HBsAg level as a strong predictor of sustained response to peginterferon alfa-2a in HBeAg-negative chronic hepatitis B[J].Aliment Pharmacol Ther, 2012,35(4):458-468.
[12]Moucari R,Mackiewicz V,Lada O,et al.Early serum HBsAg drop: a strong predictor of sustained virological response to pegylated interferon alfa-2a in HBeAg-negative patients[J].Hepatology, 2009,49(4):1151-1157.
[13]Chan HY,Wong VW,Chim AM,et al.Serum HBsAg quantification to predict response to peginterferon therapy of e antigen positive chronic hepatitis B[J].Aliment Pharmacol Ther,2010,32 (11-12):1323-1331.
[18]参加乙型肝炎病毒耐药讨论会专家.核苷和核苷酸类药物治疗慢性乙型肝炎的耐药及其管理[J].传染病信息,2013,26(1): 1-9.
(2015-08-05收稿 2015-09-04修回)
(责任编委 张玲霞 本文编辑 王 姝)
Research progress for the association of genetic mutation of hepatitis B virus with hepatocellular carcinoma occurrence
JIN Yi,HUANG Chun-yang,WEI Fei-li,HE Zhi-min,MA Li-na,CHEN Xin-yue*
International Medical Department,You'an Hospital,Capital Medical University,Beijing 100069,China
ObjectiveTo compare and evaluate the efficacy and safety of pegylated interferon(peg-IFN)α-2a in combination with nucleos(t)ide analogues(NAs)and NAs in combination with NAs in HBeAg-positive chronic hepatitis B(CHB)patients with poor virological response/HBV resistance to NAs,so as to investigate optimal treatment regimen with end point of therapy.MethodsTotally 110 HBeAg-positive CHB patients with poor virological response/HBV resistance to NAs were enrolled in the study,and divided into 2 groups receiving Peg-IFN+NAs(IFN group)and NAs+NAs(NA group)according to administration of NAs,the results of drug susceptibility testing and patients'will.Complete virological response(HBV DNA concentration of less than 20 IU/ml)rate,HBeAg seroconversion rate and HBsAg loss/seroconversion rate at 48 and 96 weeks of treatment were compared between the 2 groups.ResultsThere were 58 patients in IFN group and 52 patients in NA group,and 45 patients in the IFN group and 42 patients in NA group received 96-week treatment duration.The complete virologic response rates of IFN group and NA group were 96.6%(56/58)and 67.3%(35/52) at 48 weeks,and 100%(45/45)and 71.4%(30/42)at 96 weeks,and Those of IFN group were significantly higher than those of NA group(P<0.001,=0.001).HBeAg seroconversion rates of IFN group at 48 and 96 weeks(20.69%,46.7%)were significant-ly higher than those of NA group(5.77%,21.4%)(P=0.013).HBsAg levels of IFN group at 24,48 and 96 weeks were significantly lower than those of NA group.At week 96,8 patients(17.8%)achieved HBsAg loss,and 3(6.7%)HBsAg seroconversion in IFN group;1 patient(2.3%)achieved HBsAg loss.The HBsAg loss rate of IFN group at week 96was significantly higher than that of NA group(P=0.045).ConclusionsThe 2 treatment regimens of Peg-IFN+NAs and NAs+NAs are effective in suppression of HBV replication in HBeAg-positive CHB patients with poor virological response/HBV resistance to NAs,but Peg-IFN+NAs is superior to NAs+NAs in HBeAg seroconversion and HBsAg loss.Combination therapy with IFN as the basis will achieve reliable end point of therapy in HBeAg-positive CHB patients with poor virological response/HBV resistance to NAs.It prompt that for NAs suboptimal response/resistance CHB patients,combination therapy and prolonged therapy can improve the efficacy.
hepatitis B,chronic;interferons;hepatitis B e antigens;antiviral agents;treatment outcome
R373.21;R735.7
A
1007-8134(2015)05-0000-00
10.3969/j.issn.1007-8134.2015.05.000
国家“十二五”科技重大专项(2013ZX10002002-006、2012ZX10002003);首都临床特色应用研究与成果推广项目(Z151100004015181);首都卫生发展科研专项项目(首发2011-2018-08);国家临床重点专科建设项目(WJWYA-2014-007);重大传染病防治协同创新中心项目(2011-协同创新中心)(PXM2015_014226_000058)
100069,首都医科大学附属北京佑安医院国际医疗部感染病科(金怡、何智敏、马丽娜、陈新月),肝病免疫科(黄春洋),肝炎研究所(魏飞力)
陈新月,E-mail:chenxydoc@163.com
*Corresponding author,E-mail:chenxydoc@163.com

