胸腔积液患者细胞DNA异倍体、microRNA-192及其相关因子对非小细胞肺癌的诊断意义*
刘崇梅,王彩霞,陈凤,于惠芝,王婕,阳娟
(湖南省岳阳市二人民医院1.病理科,2.肿瘤科,湖南 岳阳 414000)
·论著·
胸腔积液患者细胞DNA异倍体、microRNA-192及其相关因子对非小细胞肺癌的诊断意义*
刘崇梅1,王彩霞1,陈凤1,于惠芝2,王婕1,阳娟1
(湖南省岳阳市二人民医院1.病理科,2.肿瘤科,湖南 岳阳 414000)
目的探讨联合检测胸腔积液细胞DNA异倍体、microRNA-192(miRNA-192)含量及其相关因子在肺癌临床诊断中的应用价值,以期提高良、恶性胸腔积液的鉴别能力。方法应用受试者工作特性曲线(ROC)对61例肺癌及70例良性肿瘤患者的胸水细胞DNA异倍体、miRNA-192含量、血清人细胞角蛋白19片段抗原21-1(CYFRA21-1)、吸烟史及卡氏功能状态量表(KPS量表)的检测结果进行分析和评价。结果两组患者临床资料单因素分析显示,吸烟史、KPS量表、CYFRA21-1、胸水细胞miRNA-192及胸水细胞DNA异倍体比较,差异有统计学意义(P<0.05)。胸水细胞miRNA-192诊断肺非小细胞癌(NSCLC)的曲线下面积(AUC)= 0.735、约登指数(YI)=0.408;胸水细胞DNA异倍体诊断NSCLC的AUC=0.806,YI=0.556;联合吸烟史、KPS量表、CYFRA21-1诊断NSCLC的AUC=0.839,YI=0.596。将胸水细胞miRNA-192和DNA异倍体纳入诊断体系,5项危险因素联合诊断NSCLC的AUC=0.867,YI=0.628。结论吸烟史、KPS量表、CYFRA21-1、胸水细胞miRNA-192及胸水细胞DNA异倍体的联合检测有助于对良、恶性胸腔积液进行鉴别诊断,提升NSCLC的诊断价值。
胸腔积液;DNA异倍体;miRNA-192;非小细胞性肺癌
临床上胸腔积液常见、多发,病因复杂多样,可由胸膜、肺部多种疾病引发,如胸膜炎、肺结核、恶性肿瘤等。临床上约5%~10%恶性胸腔积液患者的原发肿瘤病灶无法明确。近年来,肿瘤标志物的应用提高了肺癌的诊断率。但某些肿瘤标志物单项检测的敏感性和特异性并不高。近年来,国内外学者开展多种肿瘤标志物的测定,以协助该病的诊断及疗效观察[1]。MicroRNA(miRNA)是19~22核苷酸大小的非编码RNA,是内源性表观基因表达的调控者,可能成为潜在的生物标记物。目前,检测这些分子的手段包括实时荧光定量聚合酶链反应(real time-polymerase chain reaction,RT-PCR)、基因芯片、原位杂交和基因测序[2]。本文探讨胸腔积液细胞DNA异倍体联合miRNA-192对肺非小细胞癌(non-small cell lung cancer,NSCLC)的诊断意义,并将上述指标与肺癌常见的危险因素,包括吸烟史、卡氏功能状态量表(karnofsky perfomance status,KPS)、血清人细胞角蛋白19片段抗原21-1(serum cytokeratin 19 fragments,CYFRA21-1)等项目进行对比,探讨联合检测在肺癌临床诊断中的应用价值,以期提高良、恶性胸腔积液的鉴别能力。
1 资料与方法
1.1一般资料
收集本院2013年9月-2014年7月肺癌合并胸腔积液61例住院患者的血清及胸水样本。男性43例,女性18例;平均年龄53.8岁。其中肺鳞癌31例,腺癌20例,腺鳞癌3例,大细胞癌7例。同时采集70例良性肿瘤患者的血清及胸水样本作为对照组。男性30例,女性40例;平均年龄54.4岁。所有诊断经组织学或细胞学证实。所有患者入院后登记一般情况、吸烟史。根据患者当前状况完成KPS量表评分,该量表分为10级,阈值0~100分。
1.2检测方法
1.2.1血清CYFRA21-1清晨空腹抽静脉血,离心取上清液待测。采用电化学发光法检测血清CYFRA21-1,使用Cobas E411免疫分析仪和配套试剂(德国Roche公司)质控进行检测。
1.2.2细胞DNA定量分析所有Feulgen染色片经MotiCytometer全自动细胞图像分析系统(厦门Motic公司)进行扫描处理。根据系统诊断软件所做的细胞DNA异倍体分析结果,分为3种情况:①正常细胞的DNA指数(DNA index,DI)为1,即为二倍体细胞(diploid cell,2C),无异倍体细胞和异常细胞峰;②4C细胞数>5%被检测细胞总数,但无异倍体细胞诊断为增生;③有≥3个DI≥2.5的细胞或有异倍体细胞峰诊断为阳性。
1.2.3miRNA-192测定①抽取患者胸腔积液,常规留取胸水样本50 ml置于肝素瓶中充分混匀。70μm尼龙筛网过滤至离心管,4℃、1 500 r/min离心10min,去除上清液。加入磷酸盐缓冲溶液(phosphate buffer saline,PBS)重悬制备细胞悬液,于-80℃冰箱冷冻保存。细胞悬液浓度调至1×106个/ml,置于-80℃冰箱冷冻保存,严格按照miRNA提取分离试剂(美国ABI公司)说明书提取胸腔积液中的miRNA,用核酸蛋白分析仪(美国Bio Rad公司)测定RNA的纯度和浓度。②逆转录miRNA:引物购自美国ABI公司。取焦碳酸二乙酯(diethypyrocarbonate,DEPC)16μl、提取的RNA 1μl、miRNA-192或U6的特异性引物3μl,70℃水浴5 min后立即取出置于冰水浴5 min。向每个逆转录体系中加入5×逆转录酶禽成髓细胞瘤病毒(avian myeloblastosis virus,AMV)缓冲液10μl、RNasin(40 u/μl)1μl、逆转录酶AMV(10 u/μl)1μl、三磷酸脱氧核糖核苷酸(de oxyribonucleoside-5'-triphosphate,dNTPs)(2.5mmol/L)4μl、DEPC 14μl,42℃反应60 min,95℃灭活5 min,反应产物置于-20℃冰箱冷冻保存。使用Applied Biosystems-7500 RT-PCR仪测定样本中的miRNA-192,反应体系总体积25μl,具体反应体系组成如下:逆转录反应产物(待测样品)或三蒸水(空白对照组)5μl、5×PCR反应缓冲液5μl、250 mmol氯化镁MgCl20.5μl、10 mmol dNTPs 0.75μl、5 u/μl Taq聚合酶0.25μl,正、反向miRNA-192引物各0.5μl,然后用三蒸水补足至25μl[3]。反应条件为:94℃预变性5 min,94℃变性30 s,60℃延伸1 min,共50个循环。每个循环结束时收集荧光,并按照每提高0.3℃收集1次荧光的方式做熔解曲线。PCR仪自动检测荧光值,以20.56μg/ml的标准品浓度,光密度260(optical density 260,OD260)/OD280比值为2.18倍,稀释107、106、105、104、103做标准曲线。③在RT-PCR实验中,计算机自动输出每个反应体系的扩增曲线、熔解曲线和CT值。以U6RNA作为内参,以N=2-ΔCt表示胸水miRNA相对表达量,其中ΔCt表示miRNA-192与内参U6RNA的Ct差。用分析软件依据上述公式自动计算待测样品miRNA-192的相对含量。
1.3统计学方法
采用SPSS 18.0统计软件进行数据分析,用逐步条件Logistic回归模型进行多因素回归分析,对单因素比较差异有统计学意义的危险因素进行校正,分析相关危险因素(自变量)与患者病因诊断(自变量)的相关性,计算回归系数最大似然估计值(b)、最大似然估计值的标准误[SE(b)]、Wald检验统计量值[Wald(χ2)]、比值比的估算值(OR)、比值比估算值的95%可信区间(OR 95%CI)。选用受试者工作特征曲线(receiver operating characteristic curve,ROC)评价检测指标的诊断价值,计算ROC曲线下面积(area under curve,AUC)、曲线下面积的95%可信区间(AUC 95%CI),依照公式计算危险因素的约登指数(Youden index,YI):YI=敏感性+特异性-1。设定AUC 0.5~0.7时诊断价值较低,AUC 0.7~0.9时诊断价值中等,AUC>0.9时诊断价值较高,P<0.05为差异有统计学意义。
2 结果
2.1两组患者的临床资料比较
单因素比较显示,两组患者吸烟史、KPS量表、CYFRA21-1、胸水细胞miRNA-192、胸水细胞DNA异倍体比较,差异有统计学意义(P<0.05)。见表1。

表1 两组患者的临床资料比较
2.2逐步条件Logistic回归分析
根据临床资料单因素分析结果,采取逐步引入法,以组别为因变量,以单因素比较差异有统计学意义的指标为自变量。采用逐步向前法建立Logistic回归方程,变量引入水准设置为0.05,剔除水准设置为0.10。依照自变量作用的大小进行排序并依次引入Logistic回归方程,直至作用无统计学意义为止,随即拟合主效应模型,分析上述指标与病因诊断的相关性。结果显示,吸烟史、KPS量表、CYFRA21-1、胸水细胞miRNA-192及胸水细胞DNA异倍体5个变量进入最终回归模型。其中KPS量表为诊断NSCLC的保护因素,其余4项指标为诊断NSCLC的危险因素。最终回归模型的变量及参数见表2。
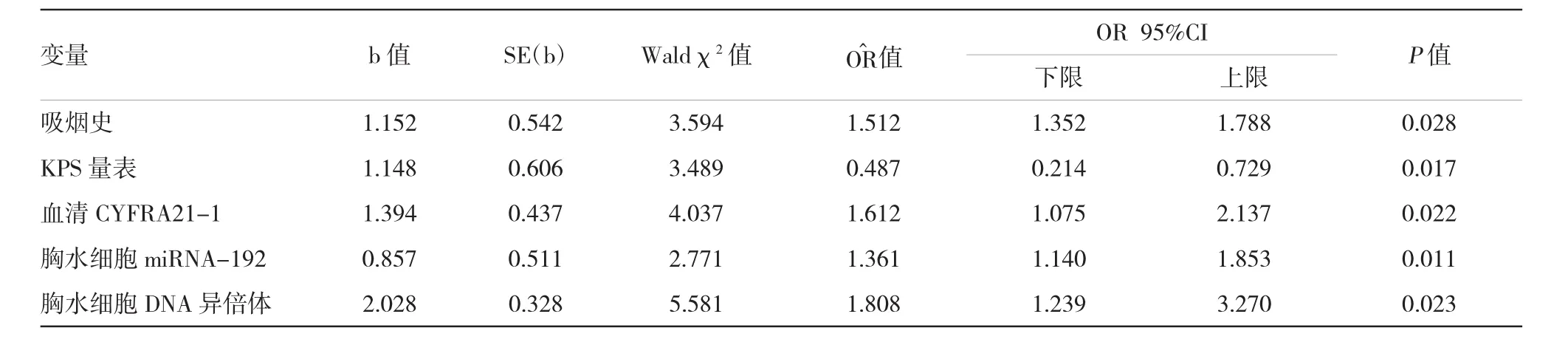
表25 种因素的Logistic回归分析
2.3各项危险因素对NSCLC的诊断价值
以敏感性为纵坐标,以误诊率即1-特异性为横坐标,分别绘制不同危险因素的ROC曲线以验证其诊断效能。
2.3.1胸水细胞miRNA-192和DNA异倍体联合诊断胸水细胞miRNA-192诊断NSCLC的AUC= 0.735[95%CI(0.623,0.773),P<0.05],YI=0.408。胸水细胞DNA异倍体诊断NSCLC的AUC=0.806[95%CI(0.736,0.835),P<0.05],YI=0.556。见图1。
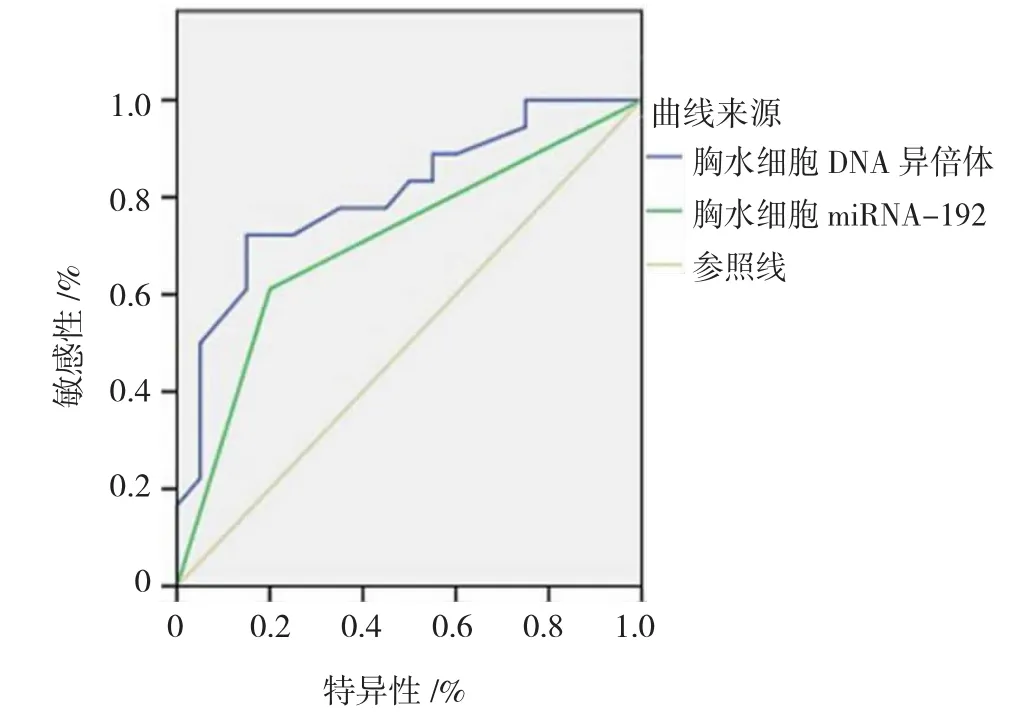
图1 胸水细胞miRNA-192和DNA异倍体诊断NSCLC的ROC曲线
2.3.2吸烟史、KPS量表及CYFRA21-1联合诊断联合吸烟史、KPS量表、CYFRA21-1 3项指标诊断NSCLC的AUC=0.839[95%CI(0.789,0.871),P<0.05],YI=0.596。见图2。
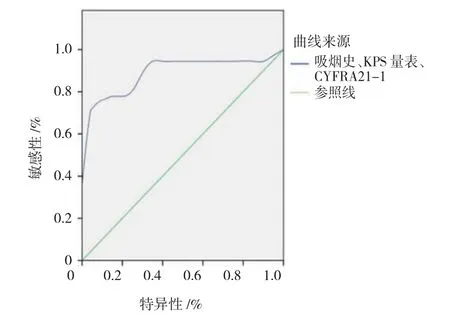
图2 吸烟史、KPS量表、CYFRA21-1联合诊断NSCLC的ROC曲线
2.3.3吸烟史、KPS量表、CYFRA21-1、胸水细胞miRNA-192及胸水细胞DNA异倍体联合诊断将5项因素联合应用诊断NSCLC的AUC=0.870 [95%CI(0.802,0.910),P<0.05],YI=0.628。各项危险因素的ROC曲线相关指标见表3和图3。
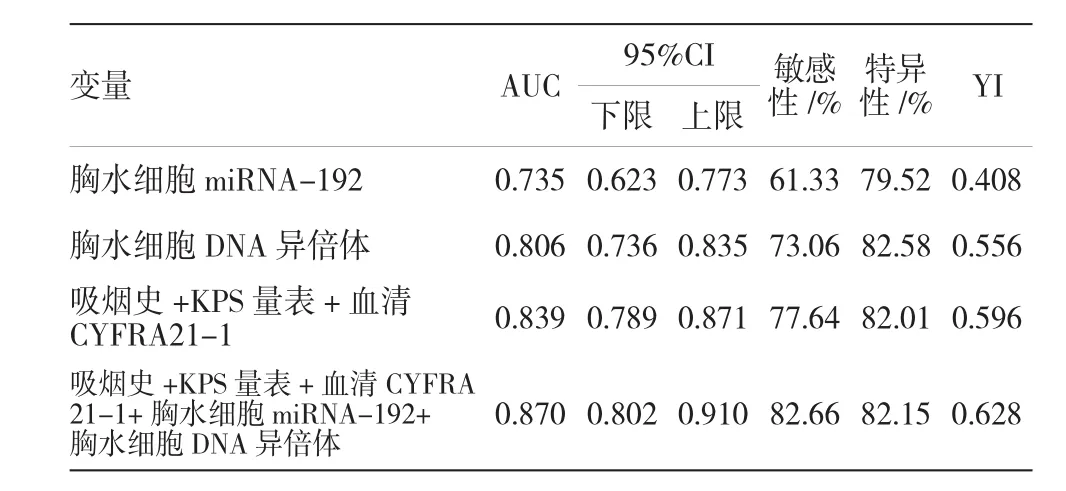
表3 各项危险因素的ROC曲线相关指标
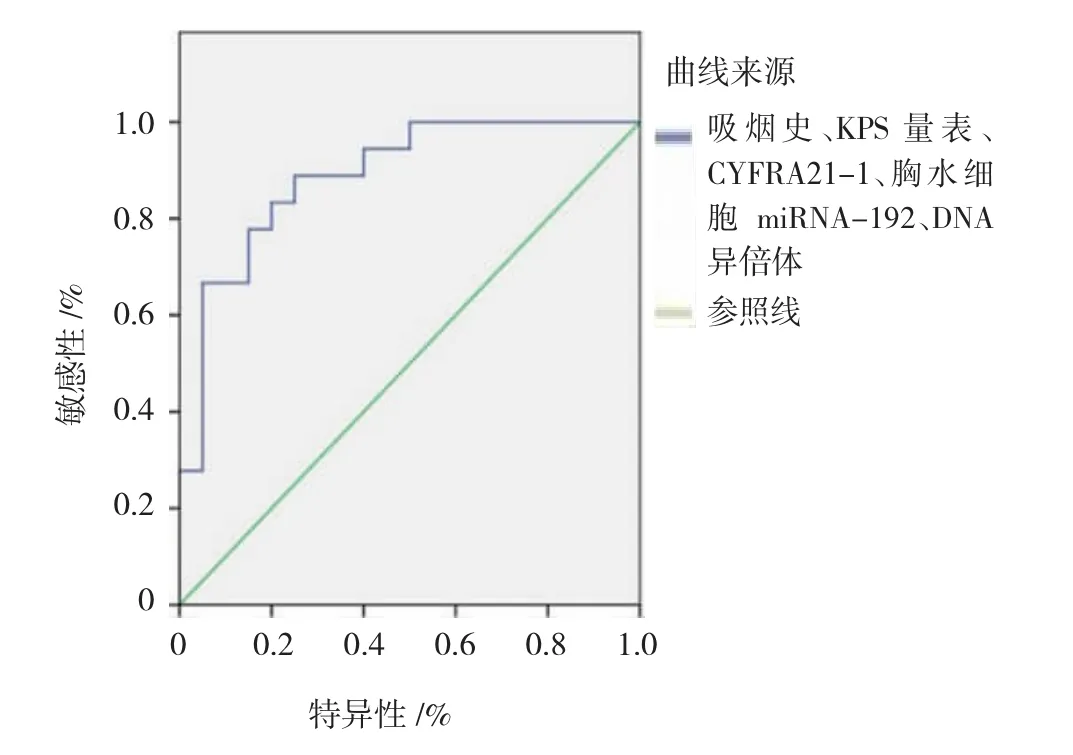
图3 吸烟史、KPS量表、CYFRA21-1、胸水细胞miRNA-192及胸水细胞DNA异倍体联合诊断NSCLC的ROC曲线
3 讨论
研究资料显示,约50%肺癌患者在疾病过程中出现胸腔积液,临床上常用生物化学常规、脱落细胞学及肿瘤标志蛋白等方法鉴别良、恶性肿瘤,并尽早排除恶性胸腔积液[4]。脱落细胞学检查寻找恶性细胞是目前临床上诊断恶性胸腔积液的金标准,文献报道其敏感性局限于70%左右。胸腔积液中常用的具有诊断意义的肿瘤标志蛋白有癌胚抗原、糖类抗原153(carbohydrate antigen-153,CA-153)、CA-199、CA-125、CA-724及CYFRA21-1[5],其可能有助于诊断恶性胸腔积液,但特异性较差。近来DNA定量、游离mRNA的表达水平也被用于恶性胸腔积液的诊断研究,由于其对肿瘤类型诊断的精确性欠佳,临床上尚未广泛应用。因此,寻找胸腔积液中稳定存在、对患者创伤小、特异性高、可重复性高、出现较早的标志物对良、恶性肿瘤的鉴别意义重大。不仅有助于尽早确诊恶性胸腔积液,而且有助于临床上对恶性胸腔积液患者尽早实施最佳治疗方案,减轻患者病痛[6]。
近年来,临床上应用细胞DNA定量分析新方法鉴别恶性与炎性胸、腹水。其与细胞学诊断比较,敏感性高;与细胞形态学检查相结合,可避免漏诊,为临床提供更明确的诊治依据。本实验中肺癌患者胸水细胞DNA异倍体的Logistic回归分析显示,其诊断NSCLC的AUC=0.806,说明该因素具有良好的诊断价值。XIE等[7]首次证明胸腔积液中游离miRNA可作为鉴别良、恶性胸腔积液的潜在指标,由此推测胸腔积液中miRNA的表达量可以作为良、恶性胸腔积液的鉴别指标。HAN等[8]利用RT-PCR检测良性胸腔积液及肺腺癌相关胸腔积液中miRNA的表达含量,发现miR-198有可能作为区分肺腺癌恶性胸腔积液及良性胸腔积液的鉴别指标。本研究发现,恶性胸腔积液中miRNA-192的表达明显高于对照组。ROC曲线分析提示,胸水细胞miRNA-192诊断NSCLC的AUC=0.735。Logistic回归分析表明,miRNA-192的表达水平可以作为良、恶性胸腔积液的鉴别指标。
近年来研究显示,联合检测肿瘤标志物对肺癌诊断有较好的应用价值,运用Logistic回归分析和ROC曲线综合分析可提高肺癌诊断的准确性[9]。本实验就NSCLC患者的胸水细胞miRNA-192和DNA异倍体与其他危险因素的相关性进行研究。多因素Logistic回归分析表明,吸烟史、胸水细胞DNA异倍体阳性、KPS量表评分降低、CYFRA21-1及胸水细胞miRNA-192含量升高为诊断NSCLC的的独立敏感因素。通过绘制上述敏感因素的ROC曲线显示,胸水细胞miRNA-192和DNA异倍体的AUC分别为0.735和0.806,说明这两项敏感因素对NSCLC具有良好的诊断价值。此外,联合吸烟史、KPS量表、CYFRA21-1 3项指标诊断NSCLC的AUC=0.839,YI=0.596;在该基础上加入胸水细胞miRNA-192和DNA异倍体联合诊断,5项敏感指标的AUC=0.870,YI=0.6281,较加入前明显升高,进一步体现胸水细胞miRNA-192和DNA异倍体对NSCLC的诊断价值。
综上所述,胸水细胞miRNA-192和DNA异倍体是NSCLC的独立敏感因素,单项检测指标已具有良好的诊断价值。其与吸烟史、KPS量表、CYFRA21-1联合检测有助于对良、恶性胸腔积液进行鉴别诊断,增加NSCLC的诊断价值。
[1]HUANG WW,TSAO SM,LAI CL,et al.Diagnostic value of Her-2/neu,Cyfra 21-1,and carcinoembryonic antigen levels in malignant pleural effusions of lung adenocarcinoma[J].Pathology, 2010,42(3):224-228.
[2]MORENO-MOYA JM,VILELLA F,SIMON C.MicroRNA:key gene expression regulators[J].Fertil Steril,2014,101(6):1516-1523.
[3]KATO M,ZHANG J,WANG M,et al.Micro RNA-192 in diabetic kidney glomeruli and its function in TGF-β-induced collagen expression via inhibition of E-box repressors[J].Proc Natl Acad Sci USA,2007,104(9):3432-3437.
[4]中华医学会呼吸病学分会肺癌学组,中国肺癌防治联盟.肺癌防治工作的回顾与展望[J].中华结核和呼吸杂志,2013,36(12):898-901.
[5]阳娟,刘崇梅,王彩霞.微小RNAs在良恶性胸腔积液中的研究进展[J].肿瘤防治研究,2015,42(4):399-402.
[6]SHE J,YANG P,HONG Q,et al.Lung cancer in china:challenges and interventions[J].Chest,2013,143(11):1117-1126.
[7]XIE L,CHEN X,WANG L,et al.Cell-free miRNAs may indicate diagnosis and docetaxel sensitivity of tumor cells in malignant effusions[J].BMC Cancer,2010,10:591-597.
[8]HAN HS,YUN J,LIM SN,et al.Downregulation of cell-free miR-198 as a diagnostic biomarker for lung adenocarcinoma-associated malignant pleural effusion[J].Int J Cancer,2013,133(3): 645-652.
[9]王英,李佩章,朱波,等.应用Logistic回归和ROC曲线综合评价肿瘤标志物联合检测对肺癌的诊断价值[J].中国现代医学杂志, 2015,25(19):47-50.
(童颖丹 编辑)
Combined detection of pleural effusion cell DNA aneuploidy and microRNA-192 and its related factors in diagnosis of non-small cell lung cancer*
Chong-mei LIU1,Cai-xia WANG1,Feng CHENG1,Hui-zhi YU2,Jie WANG1,Juang YANG1
(1.Department of Pathology,2.Department of Oncology,the Second People's Hospital of Yueyang,Yueyang,Hunan 414000,P.R.China)
【Objective】To study the diagnostic value of combined detection of pleural effusion cell DNA aneuploidy and the content of microRNA-192(miRNA-192)and its related factors so as to improve the ability of differentiating benign and malignant pleural effusion.【Methods】The smoking history,Karnofsky performance status(KPS)scale,serum cytokeratin 19 fragments(CYFRA21-1),pleural effusion cell miRNA-192 and DNA aneuploidy of 61 patients with non-small cell lung cancer(NSCLC)and 70 patients with benign lung disease control were detected and evaluated by ROC curve.【Results】The univariate analysis of clinical information of the two groups of patients showed that there were significant differences in smoking history,KPS scale,CYFRA21-1,pleural effusion cell DNA aneuploidy and miRNA-192(P<0.05).In diagnosing NSCLC,AUC=0.735,Youden index(YI)=0.408 for pleural effusion cell miRNA-192;AUC= 0.806,YI=0.556 for pleural effusion cell DNA aneuploidy;and AUC=0.839,YI=0.596 for a combination of smoking history,KPSscaleandCYFRA21-1.WhenthepleuraleffusioncellmiRNA-192andDNA aneuploidy were included into the diagnostic system,AUC=0.867,YI=0.628 using the five risk factors forcombined diagnosis of NSCLC.【Conclusion】Combined detection of smoking history,KPS scale,CYFRA21-1, pleural effusion cell miRNA-192 and DNA aneuploidy is favorable for identifying benign and malignant pleural effusion,which is associated with a significantly increased diagnostic value of NSCLC.
pleural effusion;DNA aneuploidy;microRNA-192;non-small cell lung cancer
R734.2
A
1005-8982(2015)32-0026-05
2015-06-25
湖南省科技厅科技资助项目(No:2014SK3144)

