酸樱桃种子提取物对大鼠类风湿性关节炎的作用及其机制研究
史栋梁,史桂荣
(1.河南省中医院风湿骨病科,河南 郑州 450002;2.商丘医学高等专科学校,河南 商丘 476100)
·论著·
酸樱桃种子提取物对大鼠类风湿性关节炎的作用及其机制研究
史栋梁1,史桂荣2
(1.河南省中医院风湿骨病科,河南 郑州 450002;2.商丘医学高等专科学校,河南 商丘 476100)
目的观察酸樱桃种子提取物(SCE)对大鼠类风湿性关节炎的作用,并探究其潜在的作用机制。方法随机将36只Sprague-Dawley(SD)大鼠分成对照组、模型组、CoPP处理组及SCE低、中、高剂量组(分别为10、20和30 g/kg),前3组生理盐水灌胃3 d,后3组上述剂量的SCE灌胃3 d;除对照组外,其余各组诱导类风湿性关节炎(RA)模型。于0、12、24、36和48 h测量各组大鼠右后足踝关节肿胀度,并抽取48 h时动脉血,用试剂盒检测血清肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、白介素-6(IL-6)及前列腺素E2(PGE2)含量;Western blot检测肿胀组织中过氧化物酶2、超氧化物歧化酶2(SOD2)、血红素加氧酶-1(HO-1)蛋白表达水平;对造模成功的大鼠,以6 mg/(kg·d)HO-1激动剂(CoPP)灌胃2 d,测血清TNF-α、IL-1β、IL-6及PGE2含量,肿胀组织中过氧化物酶2、SOD2及HO-1蛋白表达水平。结果各SCE剂量组大鼠右后足踝关节周长显著小于模型组并呈浓度依赖性。与模型组相比,SCE可以显著降低血清中TNF-α、IL-1β、IL-6及PGE2含量,并提高SOD2和过氧化物酶2蛋白及HO-1表达水平。SCE通过提高HO-1的表达来调节SOD2和过氧化物酶2表达水平,最终影响RA大鼠。结论SCE对大鼠RA有一定的治疗作用,其作用机制可能是SCE参与HO-1调控的抑制炎症过程和增强抗氧化应激能力。
酸樱桃种子;类风湿性关节炎;炎症因子;氧化应激
类风湿性关节炎(rheumatoid arthritis,RA)是临床上常见的慢性自身免疫结缔组织疾病,表现为对称性关节炎症、关节软骨和关节周围组织病变[1-3]。RA的发病机制尚未完全明确,推测与遗传因素、环境因素、微生物感染、免疫混乱和活性氧有关[4-5]。酸樱桃富含酚类防老剂花青素、各种花色苷及其他黄酮类化合物,具有抑制肿瘤发展和预防心血管病发生的功效,其提取物的药效越来越受到人们的重视[6-9]。既往实验证实,酸樱桃提取物具有抗氧化性,提示可能对类风湿性关节炎有潜在治愈能力[8-10]。本研究以RA大鼠为模型,观察酸樱桃种子提取物(sour cherry seed extract,SCE)对大鼠RA的作用,并对其潜在机制做进一步研究,为临床应用提供实验依据。
1 材料与方法
1.1实验动物
Sprague-Dawley(SD)大鼠30只,6~8周龄,雌雄各半,购于南京君科生物公司。室温饲养,自由饮水,10 d后活动和体征无异常后方可纳入实验。
1.2试剂与仪器
酸樱桃去核榨汁(4℃保存),完全Freund’s佐剂(美国Sigma公司),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)及前列腺素E2(prostaglandin E2,PGE2)检测试剂盒(美国Diaclone公司),兔抗过氧化物酶2、兔抗超氧化物歧化酶2(superoxide dismutase 2,SOD2)、兔抗血红素加氧酶-1(heme oxygenase-1,HO-1)及鼠抗β-actin(美国Santa Cruz公司),Chemidoc XRS凝胶成像分析仪(美国Bio-Rad公司)。
1.3实验方法
1.3.1RA大鼠模型建立选取SD大鼠36只,随机分为对照组、模型组、CoPP处理组和SCE低剂量组(10 g/kg灌胃)、中剂量组(20 g/kg灌胃)和高剂量组(30 g/kg灌胃),每组6只。对照组和模型组给予等体积生理盐水灌胃。灌胃3 d后在每只大鼠右后肢后跖皮下注入0.1 ml完全Freund’s佐剂(对照组除外),用于制备RA大鼠模型。并与0、12、24、32和48 h测量各组大鼠右踝关节周长。
1.3.2RA大鼠CoPP处理为验证HO-1对大鼠关节炎的影响,以6 mg/kg的HO-1激动剂CoPP对建模成功的RA大鼠进行灌胃,为CoPP处理组。48 h后酶联免疫吸附法测定血清TNF-α、IL-1β、IL-6和PGE2含量,并利用Western blot检测大鼠关节炎处HO-1、过氧化物酶2和SOD2的表达水平。
1.3.3大鼠血清炎症因子含量检测48 h后,分别从对照组、模型组、SCE中剂量组及CoPP处理组的大鼠股动脉取血5 ml,静置30 min后,3 000 r/min离心20 min,取上清液,并置于-20℃冰箱保存备用,用TNF-α、IL-1β、IL-6及PGE2检测试剂盒测定对应物质含量,严格按照说明书进行操作。
1.3.4Western blot检测处死取血清后的大鼠,并于踝关节上0.5 cm处剪下肿胀足,去皮后剪碎,磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗涤3次后加入细胞裂解液,4℃、20 000 r/min离心1 h,取上清液保存于-20℃冰箱备用。将总蛋白加入2×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液,1 000℃变性5 min,上样后电泳2 h,电转30 min。洗膜缓冲液封闭1 h后加兔抗过氧化物酶2、SOD2及HO-1过夜孵育。再洗膜3次×10 min,加入标记二抗室温孵育1 h。洗膜3次×10 min后用凝胶成像分析仪检测并保存图像。
1.4统计学方法
采用SPSS 13.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用方差分析及LSD多重比较,P<0.05为差异有统计学意义。
2 结果
2.1SCE对RA大鼠踝关节周长的影响
与对照组比较,模型组大鼠右后足踝关节肿胀更明显(P<0.05),表明RA造模成功。随着SCE浓度的增加,RA模型大鼠右后足踝关节肿胀严重程度得以缓解,SCE对大鼠类风湿性关节炎的治疗效果呈剂量依赖性(P<0.05)。SCE高剂量组大鼠与同一时间的模型组比较,踝关节肿胀程度明显减轻(P<0.01),表明SCE对类风湿性关节炎大鼠的治疗效果明显。见表1。
表1 各组大鼠右后足踝关节周长比较(n=6,mm±s)
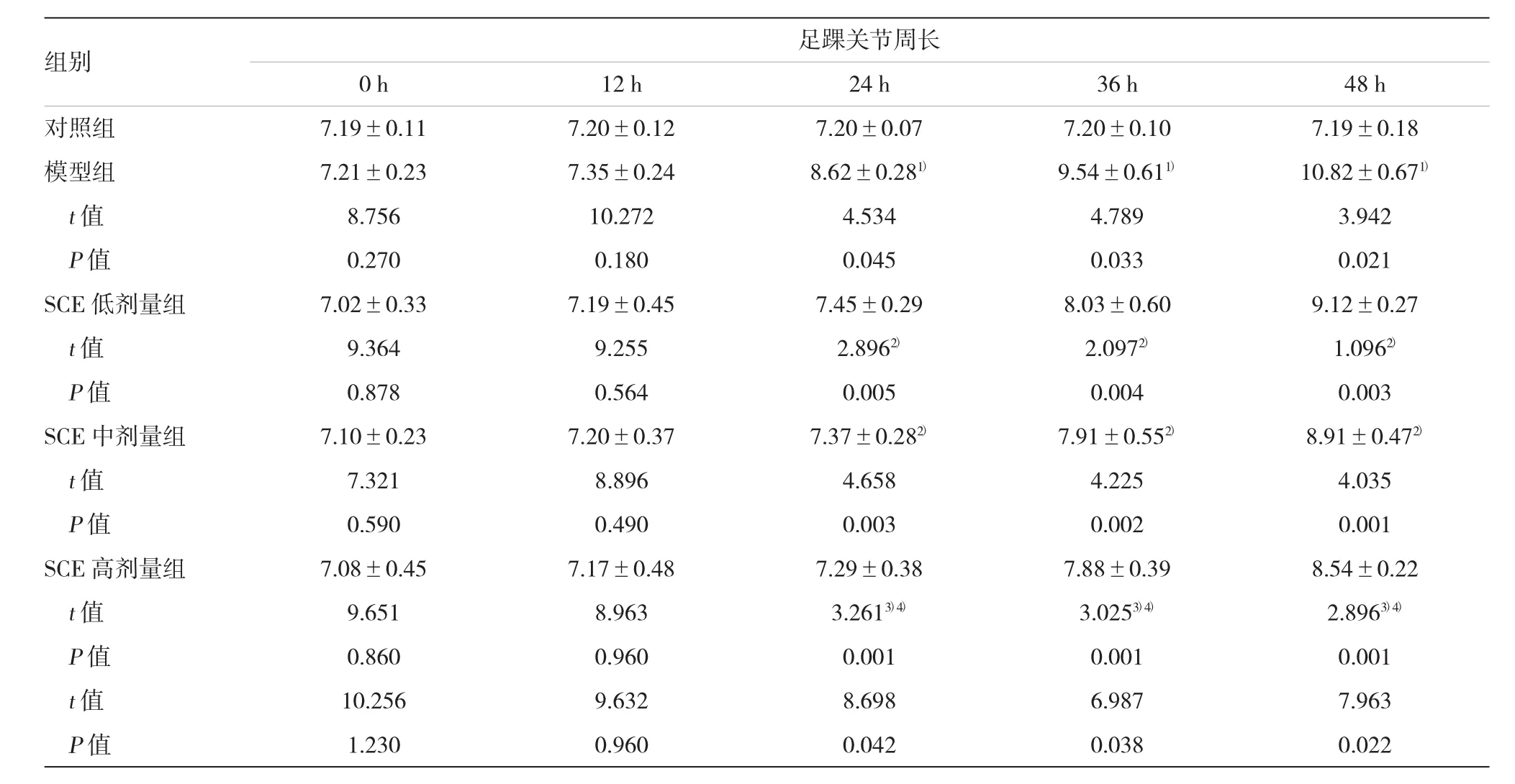
表1 各组大鼠右后足踝关节周长比较(n=6,mm±s)
注:1)与对照组比较,P<0.05;2)与模型组比较,P<0.05;3)与模型组比较,P<0.01;4)与SCE中剂量组比较,P<0.05
足踝关节周长0 h12 h24 h36 h48 h对照组7.19±0.117.20±0.127.20±0.077.20±0.107.19±0.18模型组7.21±0.237.35±0.248.62±0.281)9.54±0.611)10.82±0.671)t值8.75610.2724.5344.7893.942 P值0.2700.1800.0450.0330.021 SCE低剂量组7.02±0.337.19±0.457.45±0.298.03±0.609.12±0.27 t值9.3649.2552.8962)2.0972)1.0962)P值0.8780.5640.0050.0040.003 SCE中剂量组7.10±0.237.20±0.377.37±0.282)7.91±0.552)8.91±0.472)t值7.3218.8964.6584.2254.035 P值0.5900.4900.0030.0020.001 SCE高剂量组7.08±0.457.17±0.487.29±0.387.88±0.398.54±0.22 t值9.6518.9633.2613)4)3.0253)4)2.8963)4)P值0.8600.9600.0010.0010.001 t值10.2569.6328.6986.9877.963 P值1.2300.9600.0420.0380.022组别
2.2SCE对RA大鼠炎症因子的影响
模型组大鼠血清炎症因子TNF-α、IL-1β、IL-6及PGE2含量显著高于对照组(P<0.01)。经过喂食SCE后,血清中TNF-α、IL-1β、IL-6及PGE2含量下降明显,SCE对炎症因子的抑制作用显著(P<0.01),提示SCE可能通过对炎症因子水平的抑制来控制关节炎病情。见表2。
表2 各组大鼠血清不同炎症因子含量比较(n=6,pg/ml±s)

表2 各组大鼠血清不同炎症因子含量比较(n=6,pg/ml±s)
注:1)与对照组比较,P<0.05;2)与模型组比较,P<0.05
组别TNF-αIL-1βIL-6含量PGE2含量对照组31.2±4.632.3±2.622.6±3.10.013±0.004模型组12.1±7.61)118.6±12.31)76.8±9.91)0.026±0.0061)t值11.50310.23612.36915.356 P值0.0010.0010.0010.016 SCE高剂量组39.4±3.72)48.5±7.52)35.5±3.92)0.017±0.0032)t值12.56911.36213.69816.897 P值0.0020.0020.0030.029
2.3SCE对氧化应激的影响
Western blot检测结果显示,模型组中过氧化物酶2和SOD2蛋白水平显著高于对照组,而SCE处理组两种蛋白表达水平进一步上升,表明SCE抗氧化应激效果显著(P<0.05)。见图1。
2.4HO-1参与SCE对RA大鼠的影响
RA大鼠踝关节处HO-1表达较对照组明显增加(P<0.05),而与模型组相比,SCE提高RA大鼠HO-1的表达水平,且呈浓度依赖性。HO-1诱导剂CoPP大鼠体内实验表明,CoPP能有效提高大鼠踝关节HO-1表达水平(P<0.001)。CoPP提高大鼠过氧化物酶2和SOD2表达水平,抑制炎症因子及PGE2表达,与SCE的作用相同,表明HO-1参与SCE对RA大鼠的调控。见图2~4和表3。
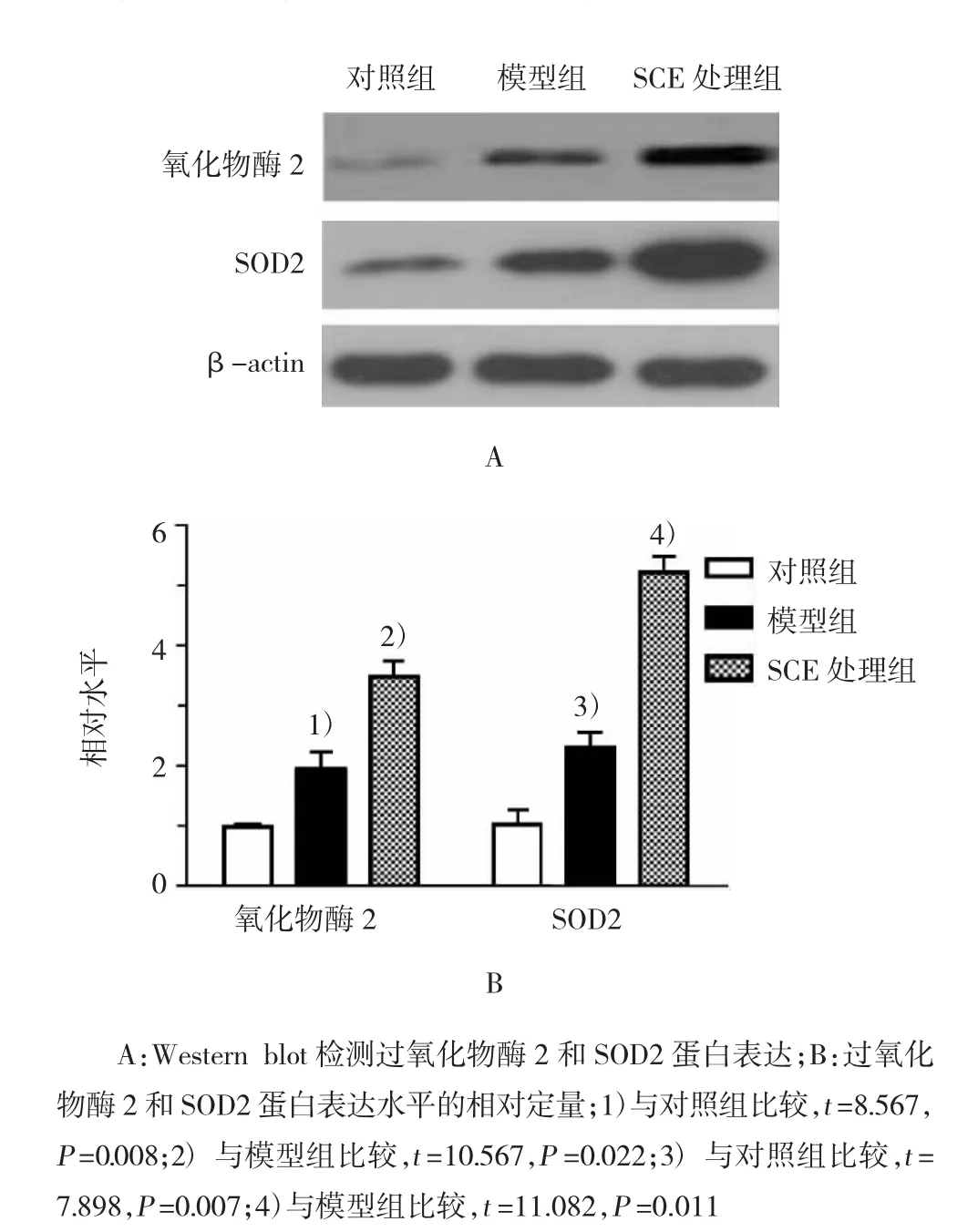
图1 SCE对氧化应激相关蛋白的影响
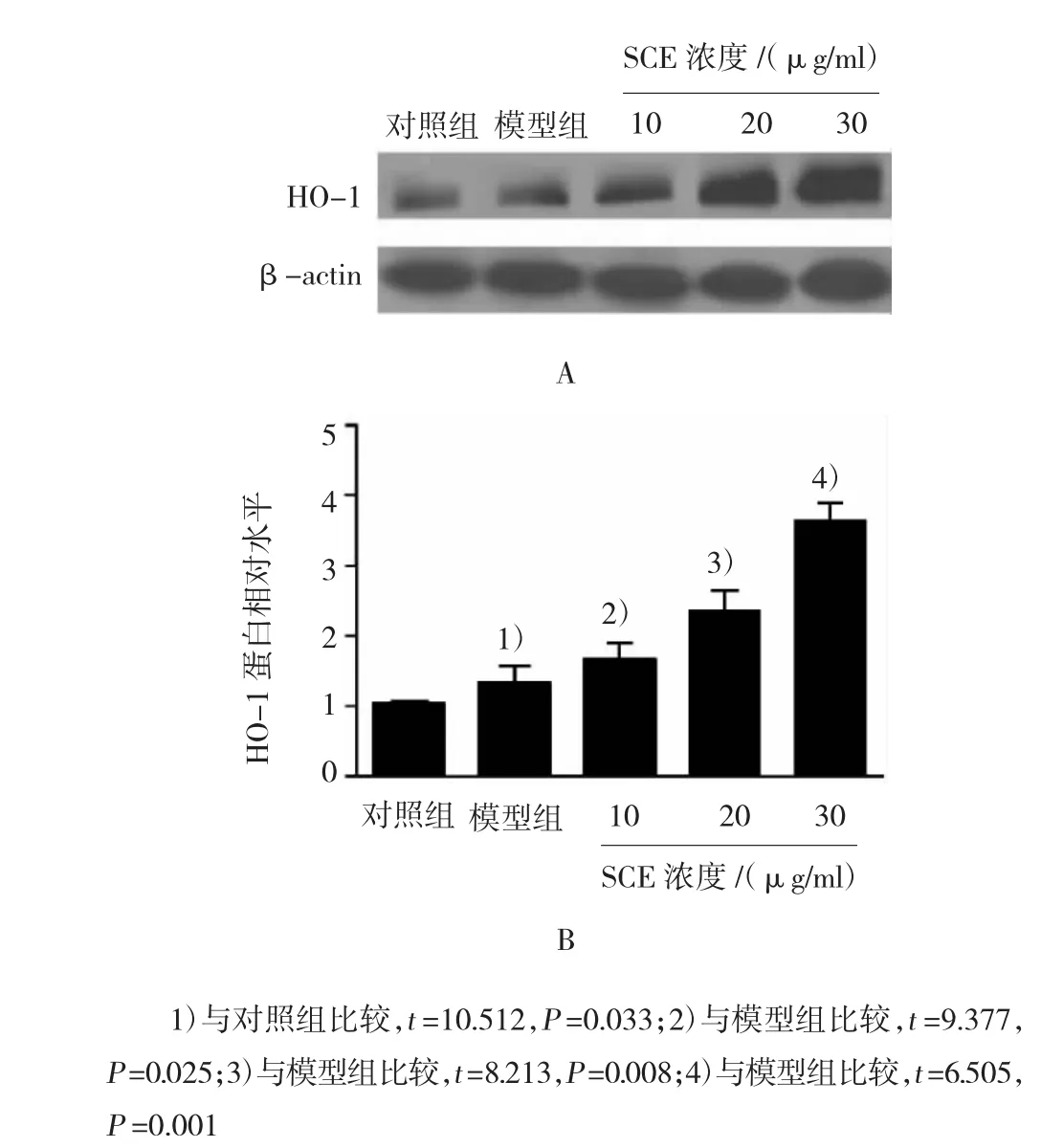
图2 SCE对HO-1蛋白表达的影响及相对蛋白定量
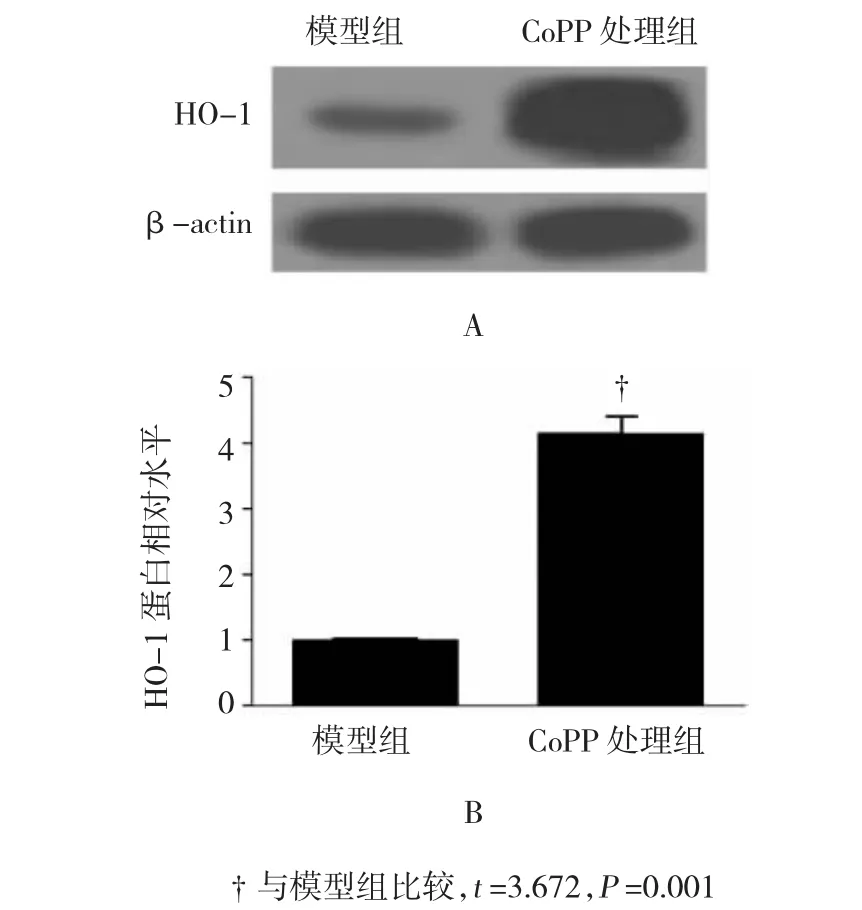
图3 CoPP对HO-1蛋白表达的影响
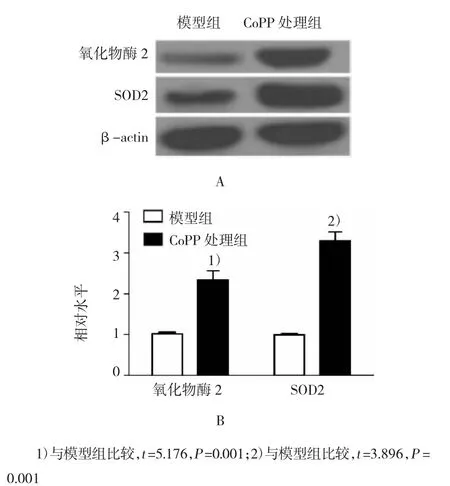
图4 CoPP对过氧化物酶2和SOD2蛋白表达的影响
表3 CoPP对RA大鼠细胞因子的影响(n=6,pg/ml±s)
表3 CoPP对RA大鼠细胞因子的影响(n=6,pg/ml±s)
注:†与SCE高剂量组、CoPP处理组比较,P<0.05
组别TNF-αIL-1βIL-6PGE2模型组105.3±5.1†116.3±10.6†79.4±8.7†0.024±0.005†SCE高剂量组39.4±3.748.5±7.535.5±3.90.017±0.003 CoPP处理组36.8±5.845.3±8.331.4±4.30.014±0.003 t值11.46110.37112.65213.421 P值0.0010.0010.0010.023
3 讨论
酸樱桃属蔷薇科李属树木,富含黄酮类化合物,能缓解关节炎和痛风带来的疼痛,并有抗癌、预防心血管疾病的功效[11]。酸樱桃果实中含较高的有机酸,在一定程度上具有抗癌、抗动脉硬化的功效。MAHMOUD等[12]最近对酸樱桃种子提取物作用于类风湿性关节炎患者的效果进行观察,发现SCE对类风湿性关节炎具有良好的调节作用。本实验用SCE灌胃的类风湿性关节炎大鼠右后足踝关节肿胀程度明显低于模型组,证实SCE对大鼠类风湿性关节炎有确切疗效。
RA是以慢性滑膜炎为特征的自身性免疫疾病,尽管大量实验对其发病机制进行研究,但具体发病机制尚未完全清楚。普遍认为,在类风湿性关节炎中,炎症因子比正常人异常活跃,尤其是血清TNF-α、IL-1β、IL-6及PGE2含量与RA紧密相关[13]。TNF-α在RA患者机体中过量表达,而抑制TNF-α可以缓解RA病情[14]。IL-1β、IL-6及PGE2通过调节多种细胞因子、免疫调节因子和前炎症因子的释放,在RA滑膜病变、白细胞浸润及软骨侵蚀过程中,介导重要机体反应[15]。研究表明,降低这些细胞因子在RA内的水平可以降低机体炎症反应,有效抑制类风湿性关节炎的发展[13]。本实验中,模型组血清TNF-α、IL-1β、IL-6及PGE2含量明显高于对照组,而SCE治疗组血清中两种炎症因子的水平较模型组大幅回落,表明SCE可能通过降低血清TNF-α和IL-1β含量对类风湿性关节炎起治疗作用。
氧化应激被视为诱发RA的原因之一经TNF-α和IL-1β诱导后,机体内SOD和过氧化物酶2表达量明显上调,清除病变中过多的活性氧,加强细胞抗氧化能力,从而减轻炎症程度[16]。本实验中酸樱桃种子提取物明显增加SOD2和过氧化物酶2含量,强化清除自由基、抵抗氧化应激及修复组织损伤的功能,也揭示SCE治疗RA的一个潜在的机制。MA HMOUD等[12]也证明SCE通过调控血红素氧合酶-1的表达,从而削弱氧化应激,加强前炎症因子信号通路,抑制类风湿性关节炎的发展。HO-1可为一系列引起氧化应激的刺激所诱导产生,包括细胞因子、活性氧、一氧化氮、紫外线等[17],同时也是机体对不利因素做出的保护性行为。HO-1对机体发挥抗炎症、抗氧化、抗凋亡等生理作用,提示HO-1的保护性作用可应用于多种疾病。BENALLAOUA等[18]发现药物诱导产生的HO-1能够缓解关节炎大鼠炎症程度。其原因可能是RA病变部位处于缺氧条件,核因子-κB和HO-1相关部位特异结合,增强HO-1表达,从而对关节炎产生抑制作用[19]。本实验中,SCE可明显提高HO-1的浓度;大鼠体内特异性诱导HO-1后,过氧化物酶2和SOD2水平显著提高,表明抗氧化应激能力增强。同时,HO-1抑制RA大鼠炎症反应,表明HO-1能调控RA病情。概括来讲,SCE通过升高HO-1水平,刺激SOD和过氧化物酶2的表达量,加速清除活性氧,增强抗氧化应激的能力,同时降低血清TNF-α、IL-1β、IL-6及PGE2含量,减轻类风湿性关节炎病情。由此得出结论,对炎症因子表达水平的下调和抗氧化能力的增加是SCE治疗RA的潜在机制,为SCE应用于抗RA提供重要理论依据,但有关SCE活性成分及其对应的详尽的机制尚需进一步研究。
[1]JURA-PÓŁTORAK A,KOMOSINSKA-VASSEV K,KOTULSKA A,et al.Alterations of plasma glycosaminoglycan profile in patients with rheumatoid arthritis in relation to disease activity[J]. Clin Chim Acta,2014,433:20-27.
[2]韩宏妮,孙艳,陈立忠.关节康颗粒联合小剂量甲氨蝶呤治疗老年类风湿关节炎的临床研究[J].中国现代医学杂志,2013,23(25): 73-75.
[3]石改绍,武新峰,王飞,等.TIPE2在类风湿性关节炎患者中的表达及其对NF-κB信号通路的影响[J].中国现代医学杂志,2014, 24(4):34-37.
[4]STAHLEA,RAYCHAUDHURIS,REMMERSEF,etal. Genome wide association study meta-analysis identifies seven new rheumatoid arthritis risk loci[J].Nat Genet,2010,42(6):508-514.
[5]梅湘,杨德乾,高秋莲,等.青藤碱对类风湿关节炎发病机制中Toll样受体及信号通路的影响[J].湖南中医杂志,2014,(4):160-162.
[6]CSIKI Z,PAPP-BATA A,CZOMPA A,et al.Orally delivered sour cherry seed extract(SCSE)affects cardiovascular and hematological parameters in humans[J].Phytother Res,2015,29(3): 444-449.
[7]CZOMPA A,GYONGYOSI A,CZEGLEDI A,et al.Cardioprotection afforded by sour cherry seed kernel:the role of heme oxygenase-1[J].J Cardiovasc Pharmacol,2014,64(5):412-419.
[8]JUHASZ B,KERTESZ A,BALLA J,et al.Cardioprotective effects of sour cherry seed extract(SCSE)on the hypercholesterolemic rabbit heart[J].Curr Pharm Des,2013,19(39):6896-6905.
[9]MAHMOUD FF,AL-AWADHI R,HAINES DD,et al.Sour cherry seed kernel extract increases heme oxygenase-1 expression and decreases representation of CD3+TNF-alpha+and CD3+IL-8+subpopulations in peripheral blood leukocyte cultures from type 2 diabetes patients[J].Phytother Res,2013,27(5):767-774.
[10]TOYDEMIRG,CAPANOGLUE,KAMILOGLUS,etal. Changes in sour cherry(prunus cerasus L)antioxidants during nectar processing and in vitro gastrointestinal digestion[J].Journal of Functional Foods,2013,5(3):1402-1413.
[11]BLANDO F,GERARDI C,NICOLETTI I.Sour cherry(prunus cerasus L)anthocyanins as ingredients for functional foods[J]. Bio Med Research International,2004,2004(5):253-258.
[12]MAHMOUD F,HAINES D,AL-AWADHI R,et al.Sour cherry (prunus cerasus)seed extract increases heme oxygenase-1 expression and decreases proinflammatory signaling in peripheral blood human leukocytes from rheumatoid arthritis patients[J].Int Immunopharmacol,2014,20(1):188-196.
[13]TIANJ,CHENJW,GAOJS,etal.Resveratrolinhibits TNF-α-inducedIL-1β,MMP-3productioninhuman rheumatoid arthritis fibroblast-like synoviocytes via modulation of PI3kinase/Akt pathway[J].Rheumatol Int,2013,33(7): 1829-1835.
[14]MOELANTS EA,MORTIER A,VAN DAMME J,et al.Regulation of TNF-α with a focus on rheumatoid arthritis[J].Immunol Cell Biol,2013,91(6):393-401.
[15]AKAOGI J,NOZAKI T,SATOH M,et al.Role of PGE2 and EP receptors in the pathogenesis of rheumatoid arthritis and as a novel therapeutic strategy[J].Endocrine Metabolic Immune Disorders Drug Targets,2006,6(4):383-394.
[16]WRUCK CJ,FRAGOULIS A,GURZYNSKI A,et al.Role of oxidativestressinrheumatoidarthritis:insightsfromthe Nrf2-knockout mice[J].Ann Rheum Dis,2011,70(5):844-850.
[17]CHEN HH,WANG TC,LEE YC,et al.A novel Nrf2/ARE activator,trans-coniferylaldehyde,INduces HO-1-mediated defense mechanism through A novel signaling pathway:Dual p38alpha/ MAPKAPK-2 and PK-N3 implication[J].Chem Res Toxicol, 2015,13:114-123.
[18]BENALLAOUA M,FRANCOIS M,BATTEUX F,et al.Pharmacologic induction of heme oxygenase 1 reduces acute inflammatory arthritis in mice[J].Arthritis Rheum,2007,56(8):2585-2594.
[19]FERNÁNDEZ P,GUILLÉN MI,GOMAR F,et al.Expression of heme oxygenase-1 and regulation by cytokines in human osteoarthritic chondrocytes[J].Biochem Pharmacol,2003,66(10): 2049-2052.
(申海菊 编辑)
Effect of sour cherry seed extract on rat with rheumatoid arthritis and its mechanism
Dong-liang SHI1,Gui-rong SHI2
(1.Department of Rheumatic Osteopathy,Henan Provincial Hospital of Traditional Chinese Medicine,Zhengzhou,Henan 450002,P.R.China;2.Shangqiu Medical College,Shangqiu,Henan 476100,P.R.China)
【Objective】To observe the effect of sour cherry seed extract(SCE)on rat with rheumatoid arthritis and explore its potential mechanism.【Methods】A total of 36 SD rats were randomly divided into control group,model group,CoPP group,10,20 and 30 g/kg SCE treatment groups.The control,model and Copp groups were given physiological saline for 3 days while other groups were given 10,20 or 30 g/kg SCE by gavage for 3 days.The rheumatoid arthritis(RA)model was induced in the rats except for the control group.Swelling of the posterior ankle joints of the rats was measured after 0,12,24,36 and 48 h.Arterial blood was drawn at 48 h and the levels of tumor necrosis factor-α(TNF-α),interleukin(IL)-1β,IL-6, prostaglandin E 2(PGE2)as well as uric acid were detected by ELISA kits.And finally peroxidase 2,superoxide dismutase 2(SOD2)and heme oxygenase-1(HO-1)in the swelling tissue were detected by Western blot.RA model rats were treated with 6 mg/(kg·d)HO-1 agonist CoPP by gavage for 2 days.The serum levels of TNF-α,IL-1β,IL-6 and PGE2 were measured by ELISA kits.The protein expression of peroxidase 2,SOD2 and HO-1 in the swelling tissue were examined by Western blot.【Results】The circumference of the posterior ankle joints of the treatment groups was shorter than that of the model group in a concentrationdependent manner.Compared to the model group,SCE in the treatment groups greatly inhibited the serum levels of TNF-α,IL-1β,IL-6 and PGE2 but increased the levels of peroxidase 2,SOD2 and HO-1.SCE-1 might mediate the expression of peroxidase 2 and SOD2 through regulating HO-1,leading to the relief of RA in rats.【Conclusions】SCE has certain therapeutic effect on rats with RA,and its mechanism may be that SCE attenuates the inflammatory process and enhances the capacity to resist oxidative stress by regulating HO-1.
sour cherry seed;rheumatoid arthritis;inflammatory factor;oxidative stress
R593.21
A
1005-8982(2015)32-0020-06
2015-04-28
史桂荣,E-mail:hbo_liu@126.com;Tel:13700838450

