脂肪酶产生菌的筛选
刘俊杰 刘茜 陈晓宁 姜俊慧
(山东绿叶制药有限公司,山东烟台 264003)
脂肪酶产生菌的筛选
刘俊杰 刘茜 陈晓宁 姜俊慧
(山东绿叶制药有限公司,山东烟台 264003)
脂肪酶主要应用于食品工业,本研究从10份土壤样品中通过富集培养分离出6株产脂肪酶发酵,平板划线;然后对脂肪酶的性质进行研究,以葡萄糖1.5%、硫酸铵0.7%、磷酸氢二钾0.1%、牛肉膏1.25%、硫酸镁0.211%、橄榄油乳化液1.41%为发酵培养基,在250r/min、30℃下培养72h。此时可获得高产的脂肪酶菌株。酶活力的最适条件:温度50℃,pH 8.5,水浴30min。此时测定的酶活力最大。最后,对分离菌株进行常规方法的细菌鉴定。
微生物;脂肪酶;筛选
脂肪酶是一类非常重要的水解酶,是目前应用最为广泛的工业用酶之一,脂肪酶目前主要应用于食品工业。利用脂肪酶作用后释放出的链较短的脂肪酸,增加和改进食品的风味和香味;利用脂肪酶催化的醇解和酯化反应来生产各种香精酯,作调料剂;使用具有1,3-专一性的微生物脂肪酶提高食用油营养价值和增加食用油的花色品种,制备代可可酯等高档油脂;另外,脂肪酶还可以用于酒类的去浊除渣、改善面包质量,改善蛋白的发泡等等方面。脂肪酶广泛存在于动植物和微生物中,来源广泛。在各种来源的脂肪酶中,以细菌脂肪酶在有机相催化的反应类型最多、反应活性及稳定性最高,其中假单孢菌属菌株所产脂肪酶尤为显著。脂肪酶(Lipase EC3.1.1.3)又称三酰基甘油酰基水解酶,是一种特殊的酯键水解酶,它不需要辅酶即可催化油水界面的甘油三酯水解生成甘油及长链脂肪酸。脂肪酶的水解底物一般为天然油脂,水解部位是底物甘油三酯中1(或3)位和2位的酯键,反应产物为甘油二酯、甘油单酯、甘油和脂肪酸。从催化特性来看,脂肪酶可以催化酯类化合物的分解、合成以及酯交换,具有化学选择性和高度的立体异构专一性,且此反应不需辅酶,反应条件温和,副产物少。脂肪酶反应的重要特征是异相系统反应(即在油—水的界面上作用)或有机相中的作用。这不仅发展了“界面酶学”,也促进了“非水酶学”的研究[1-5]。脂肪酶主要采用从生物体中提取的方法来获得,但由于动植物含酶量少、生长周期长、培养条件复杂,因此在制取酶时常以微生物作为原料,并且微生物资源丰富,生产不受自然环境的影响,可用人工控制来大量生产目的酶。此种方法产酶周期短,生产成本低,是一种经济而实用的方法。
脂肪酶作为新的生物催化剂有着得天独厚的优越性,其在此方面的应用需进行更深入的研究。利用脂肪酶催化技术转化废弃油脂为生物柴油,不仅拓宽了脂肪酶的应用范围,提供了可替代能源,而且可变废为宝,减少环境污染。本课题的目的是筛选具有脂肪酶高产活性的菌株,为下一步研究其催化活性作准备。
1 材料与设备
1.1 材料与试剂
聚乙烯醇(PVA),上海石化水处理厂。橄榄油,化学纯,上海化学试剂供应站。蛋白胨、牛肉膏、琼脂、黄豆粉、葡萄糖,青岛高科园海博生物技术有限公司。磷酸二氢钾,七水硫酸镁、氯化钠、硝酸钠、氢氧化钠,化学纯,国药集团化学试剂有限公司。硫酸铵,化学纯,天津市永大化学试剂有限公司。碳酸钠,化学纯,天津博迪化工股份有限公司。维多利亚蓝B,化学纯,天津河东区红岩试剂厂。
1.2 仪器与设备
HC-TP11-5架盘药物天平,上海精科天平仪器厂;
ALC110.4电子天平,北京赛多利斯仪器系统有限公司;
DK-S24型电热恒温水浴锅,上海精宏实验设备有限公司;
台式离心机,上海安亭科学仪器厂;
SW-CJ-1G型净化工作台,苏州净化设备有限公司;
SK-1快速混匀器,金坛市富华仪器有限公司;
SHP-2500型低温生化培养箱,上海精宏实验设备有限公司;
HZQ-Q全温振荡器,东联电子技术开发有限公司;
显微镜,奥林巴斯;
高温灭菌锅。
2 方法
2.1 培养基的制备
2.1.1 富集培养基的配置
富集培养基的组成包括橄榄油2.0%、硫酸铵0.5%、蛋白胨1.0%、磷酸氢二钾0.5%、七水硫酸镁0.1%,用碳酸钠调节pH至9.5~10.0。
2.1.2 肉汁胨培养基的配置
肉汁胨培养基的组成成分主要包括牛肉膏为0.3%,蛋白胨为1.0%,氯化钠为0.5%,琼脂为1.5%~2.0%,pH为7.0~7.2。
2.1.3 平板分离培养基的配置
在肉汁胨培养基中加入2.5%橄榄油和1.5%琼脂,用碳酸钠调节pH至9.5~10.0,灭菌后冷却到60℃,加入维多利亚蓝B(4mg/100mL),保持无菌条件乳化1min倒平板。
2.1.4 初筛培养基的配置
橄榄油双层琼脂平板,底层含琼脂1.5%、橄榄油0.5%,分装试管(10mL/支),灭菌后乳化(快速混匀),倒平板;表层为肉汁胨培养基(含1.5%琼脂),分装试管(10mL/支)灭菌,待底层凝固后倒平板。
2.1.5 复筛培养基的配置
复筛培养基的组成包括黄豆粉2.0%、玉米浆2.0%、可溶性淀粉1.0%、磷酸氢二钾0.5%、硝酸钠0.5%,pH为9.0,300mL三角瓶装液30mL,0.1MPa灭菌20min。
2.1.6 发酵培养基的配置组成
发酵培养基的组成包括葡萄糖1.5%、硫酸铵0.7%、磷酸氢二钾0.1%、牛肉膏1.25%、硫酸镁0.211%、橄榄油乳化液1.41%,300mL三角瓶装液,121℃灭菌20min。
2.2 土样的采集
从济南、威海、青岛、潍坊、烟台等地采集了啤酒厂、面粉厂、菜市场、污水场附近土样10份。
2.3 土样的处理
称取1g土样,加入盛有10mL无菌水的试管中,充分震荡,静置。
2.4 菌种的筛选
2.4.1 富集培养
取处理后的土样上清液5mL加入盛有25mL富集培养基的三角瓶中,30℃、150r/min摇瓶培养。3~5d后,移取5mL培养液至另一盛有富集培养基的三角瓶中继续培养。重复同样操作2~3次,平板分离[6]。
2.4.2 平板分离
用接种环沾取一定量的经过富集培养的菌液,在平板上划线,30℃培养2~3d。
2.4.3 斜面保藏
将平板中有蓝绿色变色圈的菌落挑至肉汁胨培养基上保藏,供初筛用。
2.4.4 初筛
将平板分离到的菌株从新鲜斜面上用无菌水洗下,经适当稀释后涂布初筛培养基,30℃培养3d。将初筛中透明圈较大的菌落挑至肉汁胨斜面培养基上保藏,供复筛用。
2.4.5 复筛培养
挑取一环新鲜肉汁胨斜面种子,接入肉汁胨液体种子培养基中,30℃、150r/min培养24h。然后取1mL液体种子于发酵培养基中,在温度30℃、摇床转速150r/min条件下,摇瓶发酵72h。发酵液离心(3000r/min,20min),取上清液测酶活。
2.4.6 发酵培养
取酶活性高的菌株发酵液5mL,接入到发酵培养集中,30℃、220r/min下72h。然后取发酵液于3000r/min条件下离心20min,取上清液测酶活。
2.5 脂肪酶活性的检测
2.5.1 酶活的定义
在40℃、pH9.0的条件下,水解橄榄油每分钟产生1μmol游离脂肪酸所需的酶量单位(U)[7]。
2.5.2 固体琼脂平板测定法
1)琼脂平板的制备
分别将2.5g琼脂粉、6.25mL橄榄油、0.2g/L聚乙烯醇18.75mL、0.1g/L维多利亚蓝B 2.5mL,加入500mL三角瓶中,加热溶解琼脂粉,趁热用高速组织捣碎机均质,倒平皿,静置冷却,制成含酶作用底物和指示剂的固体琼脂平板。
2)应用平板法测定酶活性
在已制成的固体琼脂平板上用打孔器打孔(直径3.5mm),打孔后用注射针头将孔内琼脂挑出,在酒精灯上烘烤背面,使琼脂与平皿底部贴紧,将30μL待测酶液加入孔中,置于30℃恒温培养箱中反应一段时间,定时观察孔周围的变色情况。变色圈越大说明产酶的能力越强,反之则越弱。
3)碱性脂肪酶活力测定
橄榄油与2%聚乙烯醇溶液以1:5体积比进行混合,高速匀浆,成为乳白色均匀稳定的乳化液。以橄榄油乳化液为底物,在pH 9.5、40℃下,反应30min,用滴定法测定产生的脂肪酸,以分解底物(橄榄油)释放出1mmol/min游离脂肪酸所需酶量定义为1个碱性脂肪酶活力国际单位(IU),以IU/mL表示[8]。
2.6 菌种的保藏
经过实验筛到合适的菌株后,需要将菌株进行保藏。
2.6.1 冻存液的配置
配置冻存液10mL,冻存液的组成包括甘油1g、氯化钠0.09g、纯化水9.2mL。
2.6.2 方法
10mL冻存液分装到10个无菌的1.5mL离心管,在无菌条件下,从相应斜面上挑取一大环菌体(因为在冻存过程中会有部分菌体死亡)接入离心管中,做好标记,然后放入冰箱中冻存。
2.7 脂肪酶酶学性质的测定
2.7.1 酶最适作用温度
在不同温度下(20℃、30℃、40℃、50℃、60℃)进行酶活测定,得到相同的酶液在不同的反应温度下所具有的酶活力单位[9]。
2.7.2 酶最适作用pH
配制11种从pH 5~10,间隔为0.5pH单位的缓冲液,利用平板测定法测出酶反应的最适pH。
2.7.3 反应时间对酶活的影响
将酶在不同的静置时间(5min、10min、15min、20min、25min、30min、35min)取样测定酶反应液中酶的活力,作图。
2.7.4 稳定时间对酶活的影响
根据反应时间的长短在5~40min间隔相同时间取样,测定反应结束后酶活性的变化情况并作图。
2.8 高活性菌株的分离鉴定
根据菌株的形态特征、培养特征及主要生理生化特征对筛选出的高活力的菌株进行鉴定。菌种生理生化鉴定主要参考《常见细菌系统鉴定手册》[10]。
通过对所筛选出的菌株进行普通的细菌染色,观察其形态特征。进行革兰氏染色进一步确定该菌株的各种主要特性。通过整个筛选过程了解菌株的培养特性了解该菌株生长所需的最佳温度、pH、产酶活性最高的反应时间及静置时间。采用生理生化及16sRNA方法鉴定最终确定我们所筛选出的菌株的类型。
3 结果与分析
3.1 脂肪酶产生菌的筛选
从10份土样中,经过富集培养、平板划线、初筛、斜面接种、复筛共获得6株产脂肪酶的菌株。根据菌株产生脂肪酶后再加入维多利亚蓝B的培养基中可产生蓝绿色变色圈这一特征,挑选出产脂肪酶的菌株,并与不产脂肪酶的菌株进行对照(图1)。

图1 菌种筛选结果Fig.1Strain screening results
3.2 酶活测定
3.2.1 固体琼脂平板法

图2 固体琼脂平板法测定结果Fig.2Test result with solid agar plate method
图2显示的是固体琼脂平板法测定结果。图中,平板上的1、2、3、4、5、6个透明圈分别代表所筛选出的六株不同的产脂肪酶的菌株菌悬液所产生的透明圈。平板中加入维多利亚蓝B作为指示剂,遇酸变蓝。其作用机理为:脂肪酶产生菌可产生脂肪酶,脂肪酶可以分解加入培养集中的橄榄油,使其转变成酸,维多利亚蓝B遇酸变蓝。所以可以根据所产生的变色圈的大小来判断其产脂肪酶的能力。图中变色圈的大小表示不同菌株产脂肪酶的能力,变色圈越大说明其产脂肪酶的能力越强。2号变色圈最大说明其产脂肪酶的能力最强。
3.2.2 滴定法
由于透明圈法只能定性测定脂肪酶酶活,不能定量,因此采用滴定法进行定量。利用脂肪酶可以分解脂肪产生酸,用0.05mol/L的氢氧化钠滴定,同时用酚酞作为指示剂。当指示剂由无色变成粉红说明到达到滴定终点。对筛选出来的6株具有较大透明圈的菌株在不同温度(20、30、40、50、60℃)、不同pH(7、7.5、8、8.5、9、9.5、10)下进行实验,同时作平行实验。共测定5次。酶活最高的一株到达7.2U。然后进行发酵培养,在同样的情况下测定3次酶活,最高的一株活性达到12U。酶活的计算如下列公式如下。
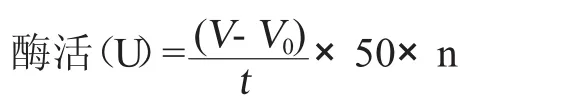
式中:V—样品所消耗碱的体积,mL;
V0—空白对照所消耗碱的体积,mL;
t—反应时间,min;
50—1 mL0.05mol/L氢氧化钠的微摩尔数;
n—稀释倍数。
3.3 酶学性质的研究
3.3.1 酶最适作用温度
酶都有其最适的反应温度,因而在不同温度下酶所表现的活性也不同。温度对酶促反应的影响表现为两个方面:一是,在一定范围内,当温度升高时,反应速度加快,酶活力高。二是,由于酶是生物催化剂,是一类特殊的蛋白质,超过一定的温度,酶会发生变性而失活。实验中酶液浓度相同,pH为8,温度选择20、30、40、50、60℃,研究温度对酶活的影响,反应30min,测量其在不同反应温度下对相同底物的作用酶活。实验中用的酶是上面实验分离得到酶活最高(12U)的脂肪酶(下同),实验结果见图3(见下页)。

图3 酶反应的最适温度Fig.3The optimum temperature of the enzyme reaction
由图3可以看出,在一定范围内温度升高反应速度加快,酶活力升高,当温度升高到50℃时,酶活力达到最大值,超过这个温度后,酶活力开始下降。因此,50℃为脂肪酶的最适温度。
3.3.2 酶最适作用pH
环境pH影响酶蛋白的构象和酶分子的解离状态,因此不同的酶具有各自的最适pH值。为了测定不同pH条件对酶活性的影响,选用碱性脂肪酶,在30℃及相同底物下,pH为7、7.5、8、8.5、9、9.5、10,反应30min,测定脂肪酶的酶活。利用平板测定法测出酶反应的最适pH。其原理是观察其产生变色圈直径的大小来粗测酶活性的大小。变色圈直径越大说明酶活性越大,反之则越小。实验结果见图4。

图4 酶反应的最适pHFig.4The optimum pH of the enzyme reaction
由图4可以看出,在一定范围内,pH升高,反应速度加快,酶活力升高,当pH升高到8.5时,酶活力达到最大值,超过这个pH后酶活力开始下降。
3.3.3 酶的最适反应时间
酶反应过程中达到最高活力需要一段时间。不同酶在相同的底物浓度、温度、pH的条件下,测量不同反应时间(5、10、15、20、25、30、35min),酶活的大小,研究该脂肪酶达到最高点所需的时间。这对酶在生产应用中时间的控制有一定的影响。在不同反应时间下对所筛出的脂肪酶进行了比较。
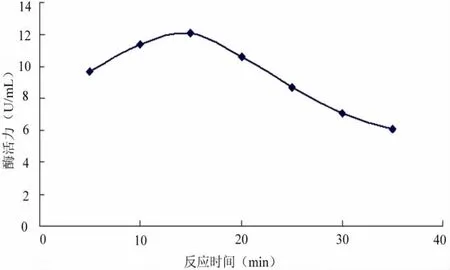
图5 反应时间对脂肪酶活力的影响Fig.5The influence of reaction time for Lipase activity
由图5可以看出,在一定反应时间内随时间延长,酶活力升高,当反应时间达到15min时酶活力达到最大值,随后酶活力开始下降。
3.3.4 稳定时间对酶活的影响
反应终止后体系并没有稳定,反应尚未结束,需要一段时间才能达到平衡。酶在30℃、pH8.5的条件下反应30min后终止,然后间隔不同的静置时间后测定酶反应液的酶活。

图6 稳定时间对脂肪酶活力的影响Fig.6The influence of standing time for Lipase activity
由图6可知,在一定稳定时间内随时间的推移,酶活力升高,当稳定时间达到10min时,酶活力达到最大值,超过这个稳定时间后酶活力开始下降。
3.4 菌种鉴定
通过对所筛出的高产菌株进行革兰氏染色和普通的细菌染色法最终确定该菌菌种,其显微镜照片显示为革兰氏阴性短杆菌,如图7(见下页)所示。
4 讨论
本文通过筛选到了预期的产脂肪酶的菌株,而且产量较高。特别是通过对筛选出的高产菌株进行发酵培养后,其产酶活性有了很大的提高,酶活达到12U。进一步的优化培养将在后续的工作中进行。
对脂肪酶酶活的测定是一个比较困难的问题,测定结果与底物的种类、底物的形态、体系的pH、温度、反应时间和稳定时间都有关系。除了上述影响条件以外,还有PVA的聚合度、乳化液制备的搅拌速度及终止剂等因素。需要以后进一步研究。
本文只对菌株进行了形态观察,采用生理生化及16sRNA方法鉴定正在进行中,有望筛选到一株具有自主知识产权的脂肪酶产生菌。
[1]孙宏丹,孟秀香,贾莉,等.微生物脂肪酶及其相关研究进展[J].大连医科大学学报,2001,(23):293-295.
[2]卢世珩,刘光烨,江跃林,等.合成己酸乙酯脂肪酶产生菌的筛选及产酶条件[J].微生物学通报,1994,(21):23-26.
[3]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:北京科学出版社,2001,(22):128.
[4]李江华,邬敏辰,邬显章,等.圆弧青霉PG37碱性脂肪酶的发酵工艺条件[J].无锡轻工大学学报,2000,19(2):100-104.
[5]施巧琴.碱性脂肪酶的研究[J].微生物学通报,1988,8(3): 108-110.
[6]陶文沂.微生物脂肪酶[D].无锡:无锡轻工大学学报,1998, (17):22-26.
[7]Daniel,Prieur.Microbiology of deep 2 sea hydrothermal vents[J]. Marine Biotechnology,1997,(15):242-244.
[8]李建武,余端元,袁明秀.生物化学实验原理和方法[M].北京:北京大学出版社,311-312.
[9]郑建丰,邬敏辰.碱性脂肪酶测定方法的研究[J].江苏食品与发酵,1996,(4):8-11.
[10]中国科学院微生物研究所细菌分类组.一般细菌常用鉴定方法[J].北京:科学出版社,1978,(2):7-8.
Screening of Lipase Producing Strain
LIU Jun-jie LIU Qian CHEN Xiao-ning JIANG Jun-hui
(Shandong Lvye Pharmaceutical Co.,Ltd.,Yantai 264003,China)
The main research aspects and results are as following:First,6 strains producing lipase were isolated from 10 soil samples by enrichment culture,plate streaking and fermentation.Second,the properties of lipase were studied,after fermentation under the medium including 1.5%glucose,0.7%(NH4)2SO4,0.1%K2HPO4,1.25%beef cream,0.211% MgSO4·7H2O,1.41%olive oil and the conditions 250r/min,30℃and 72h.The optimum reaction temperature,pH,reaction time were 50℃,8.5 and 30min respectively.Finally,the isolated strain was conserved and identified by using conventional methods for bacteria identification.
Microorganism;lipase;screening
X172
A
1008-1038(2015)04-0033-06
2014-10-25
刘俊杰(1984—),男,助理工程师,研究方向为菌种筛选

