BAT3过表达提高内源朊蛋白的表达量
宋志琦,杨利峰,王运盛,朱 婷,赵德明
(中国农业大学动物医学院 国家动物海绵状脑病实验室,北京 海淀 100193)
BAT3过表达提高内源朊蛋白的表达量
宋志琦,杨利峰,王运盛,朱 婷,赵德明
(中国农业大学动物医学院 国家动物海绵状脑病实验室,北京 海淀 100193)
为了检测BAT3蛋白与朊蛋白的相互作用,探讨BAT3蛋白在朊蛋白合成和降解以及海绵状脑病发生过程中所起的作用。构建能够在细胞中表达全长朊蛋白的真核表达载体pGEFP-N1-PRNP和表达全长BAT3蛋白的真核表达载体pcDNA3.1-HA-BAT3,应用脂质体方法分别将质粒转染进入Hela细胞,原代神经元,Neuro2a细胞。利用免疫荧光技术观察内源BAT3与全长朊蛋白的相互作用情况,利用免疫印迹技术检测BAT3过表达对内源朊蛋白表达的影响。结果在Hela细胞和原代神经元内,转染pGEFP-N1-PRNP后,自发绿色荧光蛋白的全长朊蛋白与内源BAT3发生共定位;Hela细胞和Neuro2a细胞转染pcDNA3.1-HA-BAT3后,随着外源全长BAT3表达量的增加,内源朊蛋白的表达量表现为剂量依赖性增加。表明BAT3能与朊蛋白发生相互作用,过表达BAT3能促进内源朊蛋白的表达,提示BAT3可能影响朊蛋白的合成。
BAT3;朊蛋白;原代神经元;蛋白合成;传染性海绵状脑病
朊病毒病(Prion disease)是一组累积人类和动物的传染性神经退行性疾病,随着疯牛病和人类变异性克雅氏病(variant Creutzfeldt-Jacob dis⁃ease,vCJD)的出现,该类疾病对公共卫生和人类健康的威胁日益显著。组织病理学病变局限于中枢神经系统(CNS),以神经元空泡化、灰质海绵状病变、神经元丧失、神经胶质和星状细胞增生、病原因子PrPsc蓄积和淀粉样蛋白斑块为特征。朊蛋白(PrPC)是机体中正常的糖基化蛋白,能够被蛋白酶所降解,但是当它改变了构象变成了异常朊蛋白(PrPSc)后就不能被蛋白酶所降解,逐步聚集,从而引起中枢神经系统变性,最终导致死亡[1-2]。BAG-6(又称Scythe;HLA-B基因相关转录因子3,BAT-3),最初是在蟾卵提取物中纯化得
到的,分子量为150 kDa。BAT3是一个多功能蛋白,其中一项重要的功能是其对细胞内错误折叠蛋白的合成及降解的影响[3-4]。但是BAT3在神经细胞中的过表达对由朊蛋白的影响尚未见相关报道。研究BAT3与朊蛋白的相互作用,对朊病及由错误折叠蛋白引起疾病的治疗可能有重要意义。
1 材料与方法
1.1 试验材料 BAT3鼠源单克隆抗体,细胞色素c兔源多克隆抗体,购自Santa Cruz公司;HA标签鼠源单克隆抗体,β-actin兔源多克隆抗体,辣根过氧化物酶标记的山羊抗兔二抗,购自Bio⁃world公司;辣根过氧化物酶标记的山羊抗鼠二抗,Alexa Fluor594标记的山羊抗小鼠IgG二抗,购自北京中杉金桥生物技术有限公司;FITC标记的山羊抗兔二抗和Cy5标记的山羊抗兔二抗,兔源TUBB3/betaIII tubulin(神经元标记物),购自北京博奥森生物技术有限公司,神经元III族-β-Tubu⁃lin(Tuj1)抗体,DAPI二氢氯化物和碘化丙啶(PI),免疫荧光染色用的免疫固定液、免疫洗涤液,免疫封闭液,购自碧云天生物技术公司;脂质体转染试剂Lipofectamine 2000和无血清培养基Opti-MEM,购自Invitrogen公司;电泳仪:BIORAD美国;电转仪:BIO-RAD美国。
1.2 试验方法
1.2.1 Hela细胞和N2a细胞的复苏与培养 取出液氮罐中装有N2a细胞的冻存管,立即放入预热至37℃的水浴中并摇动,使管中细胞悬液快速融化,然后低速800 r/min离心5min,离心后弃去冻存液,取1 m L完全DMEM培养基加至管中反复吹打,吸出吹打后的液体加至培养瓶中,重复冲洗吹打1次。用含20%胎牛血清的完全DMEM培养基4~5mL,37℃、5%CO2、饱和湿度培养。
1.2.2 原代神经元的分离与培养 出生24 h内的SD乳鼠75%酒精浸泡消毒5~10min,在解剖显微镜下分离出双侧大脑皮层,仔细剥除软脑膜和血管,然后沉淀洗涤分离出的组织5~6次(每次静止2min,弃上清),将分离的大脑皮质部分剪碎成1~2 mm3的小组织块。将组织悬液置于无菌的瓶中消化,加入终浓度3mg/mL木瓜蛋白酶+适量(0.05 mg/mL)DNA酶。37℃培养箱消化30~40min,每10 min稍微摇动一下。加入少许血清终止反应,1 000 r/min,离心5 min弃上清,加入DMEM。用大口径吸管(配合枪头吹打)轻轻吹打组织块使细胞均匀分散为初细胞悬液。胎盘蓝染色后细胞计数。然后1 000 r/min离心5min,用10%胎牛血清的DMEM/F12+0.5%B27培养液悬起细胞沉淀。将初细胞悬液经计数稀释到2× 106个/mL。
1.2.3 构建质粒 带绿色荧光蛋白全长PRP质粒pGEFP-N1-PRNP的构建:根据GenBank中AYp 456,Homo sapiens prion protein(PRNP)mRNA,设计扩增PrP全长基因序列的PCR引物(由上海生工生物工程技术服务有限公司合成)。以Hela细胞的cDNA作为模板,上游引物:ATA CTCGAGATGGCG AACCTTGGC TGC T;下游引物ACTAAGCTTTCC CAC TATCAG GAA GATGAG,两端分别插入Hind III、Xho I酶切位点。经用Hind III、Xho I双酶切的目的基因与同样双酶切的pGEFP-N1进行连接,构建重组表达质粒。经双酶切和测序鉴定质粒构建成功。pcDNA3.1-HA-BAT3重组质粒由中国农业大学动物医学院基础兽医学唐军教授赠送。
1.2.4 质粒转染 收获处于对数生长期的Hela细胞、N2a细胞或原代神经元细胞,以2×105/孔接种于12孔培养板中,37℃,5%CO2环境中培养24 h,细胞长至80%~90%融合,按转染试剂说明书进行转染。用于Western Blot检测的细胞分为阴性对照组(转染pcDNA3.1-HA空载体)和实验组(转染pcDNA3.1-HA-BAT3重组质粒)。用于免疫荧光试验的细胞接种于之前铺好爬片的12孔培养板中。转染48 h后收集蛋白进行相应的检测。
1.2.5 免疫荧光试验 用洁净的盖玻片,70%乙醇中浸泡后,用无菌的镊子放置到12孔板内,然后用无菌的生理盐水、PBS或培养液洗去残留的乙醇。种入细胞进行培养,待细胞贴在盖玻片上生长良好后,进行过表达或用毒性多肽处理。前期试验结束后,进行免疫荧光染色。用免疫染色固定液室温固定30min以上。固定完毕后,用免疫染色洗涤液洗涤两次,每次5min。加入免疫染色封闭液,封闭60 min。按照适当比例用稀释一抗。吸尽封闭液,立即加入稀释好的一抗,37℃孵育2 h。之后弃去一抗,洗涤液洗涤5min,共洗涤3次。按照适当比例稀释二抗:Alexa Fluor 594标记的山羊抗小鼠IgG二抗、FITC标记的山羊抗兔二抗和Cy5标记的山羊抗兔二抗稀释比例都为1∶100。 吸尽洗涤液后,立即加入稀释好的二抗,37℃孵育1 h。之后加入免疫染色洗涤液,洗涤5min,共洗涤3次。最后加入DAPI
染核3min,洗涤5min,共洗涤3次。用抗淬灭剂封片,在正置激光共聚焦显微镜(Olympus,Tokyo,Japan)下观察试验结果。
2 试验结果
2.1 原代神经元细胞的鉴定 首先,用两种神经元特异性抗体TUBB3/beta III tubulin神经元标记物和Tuj1对分离的神经元进行鉴定,如中插彩版图1所示,两种抗体的荧光染色都显示分离的神经元纯度很高,达到90%以上可以用于后续试验。
2.2 内源BAT3与全长朊蛋白发生共定位 将构建好的带绿色荧光标签的全长PrP载体,分别转染进入Hela细胞(见中插彩版图2 A)和原代神经元细胞(见中插彩版图2 B)。用免疫荧光染色方法观察到内源BAT3与外源全长朊蛋白发生共定位,在Hela细胞中,外源朊蛋白主要以颗粒及聚集形式分布于胞浆,并且与BAT3在胞浆中发生共定位,在原代神经元中,外源朊蛋白散在分布于胞浆,在核周围的胞浆与BAT3发生共定位。
2.3 过表达BAT3后,内源性朊蛋白的表达呈剂量依赖性增加 将不同剂量的BAT3转染进入Hela细胞(图3 A)和Neuro2a细胞(图3 B),通过免疫印迹检测蛋白的表达情况。经过对免疫印迹条带的密度分析,我们发现,随着BAT3转染剂量的增加,内源朊蛋白的表达量也逐渐升高,并且它们之间的关系呈正相关。
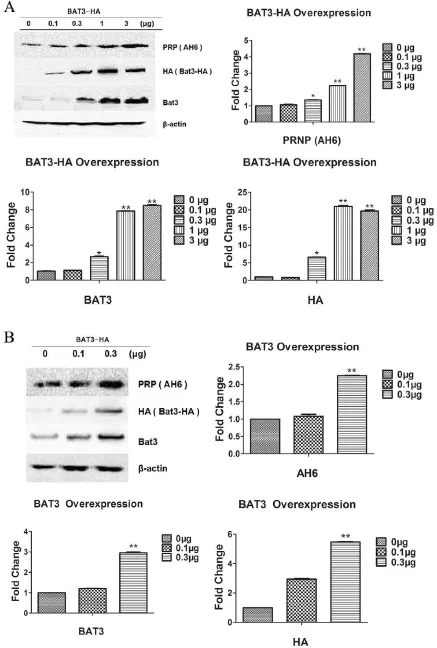
图3 外源BAT3的表达与内源朊蛋白的表达呈剂量依赖性A:BAT3在Hela细胞中过表达,并分别检测朊蛋白(PrP)、BAT3、内参蛋白β-actin的变化情况,密度分析量化免疫印迹结果;B:对N2A细胞的分析结果。*:P<0.05,**:P<0.01
3 讨论
不能正确靶向的膜蛋白要被释放到细胞浆中。这种错误定位的蛋白需要被及时清除以保持细胞的内稳态,否则可能会发生蛋白聚集物的积聚现象。BAT3作为内质网蛋白降解过程中核心的分子伴侣,它与错误折叠和定位的朊蛋白之间关系尚未研究清楚。异常朊蛋白可以在去污剂作用下发生沉淀反应和在细胞外聚集形成淀粉样斑块,这说明异常朊蛋白具有很强的聚集、聚合的特性[7-8]。了解BAT3与朊蛋白之间的关系,有利于分析异常朊蛋白的合成与降解,为异常朊蛋白的细胞内清除,维持细胞内蛋白稳态提供相关依据,也将为朊蛋白病的早期诊断和药物治疗开辟新的思路。
[1]Brown P,Gibbs C J,Rodgers-Johnson P,et al.Human spongi⁃form encephalopathy:the National Institutes of Health series of 300 cases of experimentally transmitted disease[J].Ann Neurol,1994,35(5):513-529.
[2]Prusiner S B.Novel proteinaceous infectious particles cause scra⁃pie[J].Science,1982,216(4542):136-144.
[3]Hegde R S,Keenan R J.Tail-anchored membrane protein inser⁃tion into the endoplasmic reticulum[J].Nat Rev Mol Cell Biol,2011,12(12):787-798.
[4]MinamiR,Hayakawa A,Kagawa H,et al.BAG-6 is essential for selective elimination of defective proteasomal substrates[J].JCell Biol,2010,190(4):637-650.
[5]Chakrabarti O,Rane N S,Hegde R S.Cytosolic aggregates per⁃turb the degradation of nontranslocated secretory and membrane proteins[J].Mol Biol Cell,2011,22(10):1625-1637.
[6]Emerman A B,Zhang ZR,ChakrabartiO,etal.Compartment-re⁃stricted biotinylation reveals novel features of prion protein metab⁃olism in Vivo[J].Mol Biol Cell,2010,21(24):4325-4337.
Overexpression of BAT3 enhanced cellular levels of endogenous prion protein
SONG Zhi-qi,YANG Li-feng,WANG Yun-sheng,ZHU Ting,ZHAODe-ming
(State Key Laboratories for Agrobiotechnology,Key Lab of Animal Epidemiology and Zoonosis,Ministry of Agriculture,National Animal Transmissible Spongiform Encephalopathy Laboratory,College of Veterinary Medicine,China Agricultural University,Beijing 100193,China)
To investigate the relationship between BAT3 and prion protein in vitro and exp lore the possible function of BAT3 in the expression of prion protein and associated diseases.The overexpression p lasm id PGEFP-N1-PRNP was constructed and transfected into Hela cells and primary cortical neurons.The immunofluorescencemicroscopy was chosen to analyze the relation⁃ship between BAT3 and prion protein.pcDNA3.1-HA-BAT3 was constructed and transfected into Hela cells and Neuro2a cells in different amounts.Western blotting was used to examine the expression levels of prion protein after the transfection with different doses of BAT3.BAT3 and prion protein co-localized in the cytoplasm of Hela cells and primary neuronal cells.With the increasing expression of exogenous BAT3,the endogenous prion protein levels were enhanced in Hela cells and Neuro2a cells.Conclusion BAT3 interacted with prion protein in cytoplasm and markedly increased the endogenous expression of prion protein in Hela and Neuro2a cells.It is possible that BAT3m ightstabilize prion protein and influence its subsequent cellular function(s).
BAT3;prion protein;primary cortical neurons;protein synthesis
ZHAODe-ming
R 5893
A
0529-6005(2015)11-0009-03
2014-08-22
国家自然科学基金(31272532)
宋志琦(1989-),女,博士生,主要从事动物海绵状脑病致病机制方面研究和兽医病理学方面工作,E-mail:song⁃zhiqi1989@gmail.com
赵德明,E-mail:zhaodm@cau.edu.cn

