氯离子敏感的YFP-H 148Q/V163S在FRT细胞中的表达及其应用研究
郑 锴,张雲乔,许会静,方 芳,杨紫嫣,郑 岩,董校汝,李荣霞,郝 峰
(吉林医药学院检验学院,吉林 吉林 132013)
氯离子敏感的YFP-H 148Q/V163S在FRT细胞中的表达及其应用研究
郑 锴,张雲乔,许会静,方 芳,杨紫嫣,郑 岩,董校汝,李荣霞,郝 峰
(吉林医药学院检验学院,吉林 吉林 132013)
运用点突变试剂盒构建pcDNA3.1-YFP-H148Q/V163真核表达载体,脂质体介导YFP-H148Q/V163S转染稳定表达Ano1的FRT细胞,荧光淬灭动力学试验检测YFP-H148Q/V163S对其氯离子的敏感性。测序结果显示,YFP(yellow fluorescent protein)特异编码序列上第508-510位碱基CAC突变为CAG,148位组氨酸H突变为谷氨酰胺Q;第553-555位碱基GTG突变为AGC,163位缬氨酸V突变为丝氨酸S。荧光淬灭动力学试验结果显示,向表达YFP-H148Q/V163S的FRT细胞加入Ano1激活剂ionomycin和Cl-,其相对荧光强度明显下降。pcDNA3.1-YFP-H148Q/V163真核表达载体成功构建,并证实表达于FRT胞浆中的YFP-H 148Q/V163S具有对氯离子敏感的特性。
YFP-H148Q/V163S;FRT;相对荧光强度
氯离子是机体内含量最多的阴离子,可通过跨膜转运改变细胞内外的氯离子浓度来维持细胞外液渗透压和细胞正常功能。氯离子通道(cal⁃cium-activated chloride channels,CaCCs)是一类广泛表达机体多种细胞膜上可通透Cl-的阴离子通道,是多种疾病诊断的生物标志物和治疗的潜在药物靶点[1]。传统检测细胞内氯离子的方法常用氯离子敏感的荧光染料,但易出现荧光漂白现象,重复操作易污染细胞[2]。近年来从水母提取出来的绿色荧光蛋白(green fluorescent protein,GFP)作为新型的分子标记物备受青睐,具有通用性好、细胞毒性低、在活细胞内可长久表达、并且相对荧光信号不易发生淬灭等特性[3-4],此外在一系列基于GFP的生物传感器已经成为检测活细胞内离子活动的一个重要工具[5]。相关文献报道对黄色荧光蛋白(yellow fluorescent protein,YFP)进行一系列点突变,改变其氨基酸组成可提高其对氯离子亲和力[6],因
此本实验构建黄色荧光蛋白(yellow fluorescent protein,YFP)突变体的真核表达载体pcDNA3.1-YFP-H148Q/V163,研究YFP-H148Q/V163S对氯离子具有敏感性,对细胞内外氯离子的测定和检测氯离子通道开放情况等相关研究奠定基础。
1 材料与方法
1.1 主要试剂与仪器 pRSETB-YFP和pcDNA3.1由大连医科大学麻彤辉教授馈赠;QuickchangeTM点突变试剂盒,购自Stratagene公司;稳定表达pEGFPAno1的FRT细胞由本实验室前期制备;Lipofectamine LTX,购自Invitrogen公司;NMDG-Cl、MgCl2、MnCl2、CdCl2、GdCl3、glucose、HEPES和70d-mannitol,购自BBI公司;Ionomycin和T16Ainh-A01,购自Sigma公司;倒置荧光显微镜,购自Nikon公司;FluoStar Optima多功能酶标仪,购自德国BMG LABTECH;引物和测序由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 YFP-pcDNA3.1质粒的构建和鉴定 以pR⁃SETB-YFP为模板,PCR扩增YFP基因。PCR产物经琼脂糖凝胶电泳后切胶回收,BamH I和Not I双酶切目的片段和pcDNA3.1载体,酶切产物切胶回收后T4连接酶进行连接反应。将pcDNA3.1-YFP质粒转化DH5α大肠杆菌感受态细胞,提取质粒并测定浓度,酶切鉴定正确后回收阳性片段,并送测序公司鉴定。
1.2.2 pcDNA3.1-YFP-H148Q/V163质粒的构建和鉴定 根据YFP特异编码序列,分别设计第148位和163位氨基酸定点突变引物a和b,见表1。
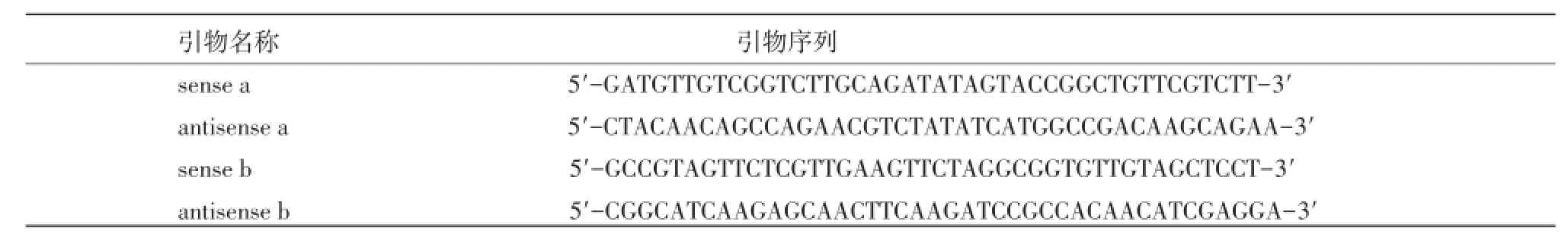
表1 YFP-H148Q/V163S双突变体的引物设计
以pcDNA3.1-YFP为模板,利用引物a参照点突变试剂盒说明书构建YFP-H148Q突变体。限制性内切酶DpnI纯化突变产物后转化E.coli XL1-Blue感受态细胞,其转化、质粒提取、酶切和测序步骤与上述大致相同。以pcDNA3.1-YFP-H148Q为模板,用引物b突变合成pcDNA3.1-YFP-H148Q/V163S,步骤与YFP-H148Q突变步骤一致。
1.2.3 pcDNA3.1-YFP-H148Q/V163质粒转染FRT细胞 pcDNA3.1-YFP-H148Q/V163S质粒和脂质体Lipofectamine LTX以0.5μg:2.5μL配比稀释后充分混匀,转染稳定表达Ano1的FRT细胞,48 h后观察YFP-H148Q/V163S在FRT细胞中的表达情况。
1.2.4 荧光淬灭动力学试验 选取转染效率高的FRT细胞,用PBS反复洗涤细胞3次,每次200 μL,最后一次留50μL PBS。利用FluoStar Optima多功能酶标仪,以5 s/点的速度连续测定14 s,记录下胞浆相对荧光强度随时间变化的动态曲线。前2 s为基线,2 s后以170μL/s的速度向96孔板中每孔注入200μmol/L ionomycin和120μL的高Cl-溶液,继续测定12 s。不加ionomycin的高Cl-溶液和加Ano1抑制剂T16Ainh-A01的高Cl-溶液作为阴性对照。
2 结果
2.1 pcDNA3.1-YFP-H148Q/V163S质粒酶切和测序结果 pcDNA3.1-YFP-H148Q/V163S质粒经BamH I和Not I双酶切产生2条清晰条带,大小分别与pcDNA3.1载体片段(5 597 bp)和YFP片段(729 bp)相符(见图1)。测序结果经NCBI与YFP序列Blast显示YFP突变位置,YFP序列第508-510位碱基CAC突变为CAG,组氨酸H突变为谷氨酰胺Q;第553-555位碱基GTG突变为AGC,缬氨酸V突变为丝氨酸S(见图2)。酶切与测序结果表明,成功构建YFPH148Q/V163S真核表达载体。

图1 YFP-H148Q/V163S酶切1:BamH I单酶切;2:Not I单酶切;3:BamH I/Not I双酶切;4:YFP-H148Q/V163S;M:Trans2K Plus DNAMarker
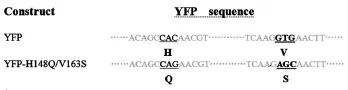
图2 YFP突变位置示意
2.2 转染前后FRT细胞形态特点 转染前期已将Ano1稳定转染FRT细胞中,倒置荧光显微镜观察到细胞膜上发出绿色荧光,证实FRT细胞已稳定表达Ano1。见中插彩版图3A和B。转染YFP-H148Q/ V163S后胞浆可见到黄色荧光,证实YFP-H148Q/ V163S在FRT胞浆内表达。见中插彩版图3C。
2.3 荧光淬灭动力学试验结果 转染后FRT细胞中加入含ionomycin的高Cl-溶液,结果表明,FRT胞浆中相对荧光强度显著下降(见图4A)。不加ionomycin的高Cl-溶液和加Ano1抑制剂T16Ainh-A01的高Cl-溶液注入后相对荧光强度均不变,(见图4B)。结果证实,YFP-H148Q/V163S对氯离子具有敏感性。
3 讨论
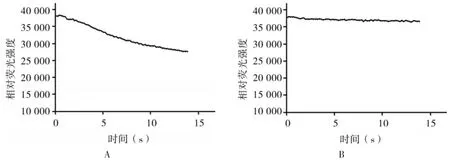
图4 荧光淬灭动力学试验A:加入ionomycin后荧光淬灭动力学试验结果;B:未加ionomycin和加入T16Ainh-Aol后荧光淬灭动力学试验结果
正常生理条件下哺乳动物细胞内氯离子浓度<40mmol/L且相对比较稳定[7],YFP对细胞内氯离子浓度变化敏感程度不高。相关研究表明,YFP序列上的氨基酸单突变体可提高YFP对氯离子的亲和力,生物信息学和后续研究表明YFP相应的双突变体具有更强的氯离子敏感性。本试验采用PCR定点突变技术[8]成功将第148位组氨酸H突变为谷氨酰胺Q,第163位缬氨酸V突变为丝氨酸S。Ano1(TMEM16A)是表达在细胞膜上的一种钙激活氯离子通道[9],将YFP-H148Q/ V163S转染入在前期工作我们已经建立了稳定表达Ano1的FRT细胞模型,荧光淬灭动力学实验证实YFP-H148Q/V163S对Cl-具有敏感性。
氯离子及氯离子通道在多种生理功能和病理过程中发挥重要作用[1-7],发展敏感、简便的氯离子浓度测定方法不仅可检测细胞内外氯离子浓度的动态变化,而且可同时反映氯离子通道的功能状态,可极大促进该领域的研究。本实验证实了YFP-H148Q/V163S对氯离子具有敏感性,可用以发展监测活细胞内氯离子动态变化的特异性生物传感器,为后期纯化蛋白研制检测氯离子浓度试剂盒和开发高通量细胞检测技术具有重要意义。YFP-H148Q/V163S感受氯离子跨膜转运引起的胞质中氯离子浓度变化,能够反映Ano1的开放情况及功能状态,为后续研究Ano1钙激活氯离子通道以及其他氯离子通道的开放情况与调节剂的筛选奠定基础。
[1]Bill A,Hall M L,Borawski J,et al.Smallmolecule-facilitated degradation of ANO1 protein:a new targeting approach for anti⁃cancer therapeutics[J].JBiol Chem,2014,289(16):11029-41.
[2]Kornreich BG.The patch clamp technique:principles and techni⁃cal considerations[J].JVet Cardiol,2007,9(1):25-37.
[3]Pan Y,Leifert A,Graf M,etal.High-sensitivity real-time analy⁃sis ofnanoparticle toicity in green fluorescentprotein-express⁃ing zebrafish[J].Small,2013,9(6):863-869.
[4]辛文文,王景林.基于荧光检测的新型细胞传感器[J].生物化学与生物物理进展,2011,38(2):185-190.
[5]Galietta L J,Haggie P M,Verkman A S.Green fuorescent pro⁃tein-based halide indicators with improved chloride and iodide af⁃finities[J].FEBSLett,2001,499(3):220-224.
[6] George Patterson,Rich N.Day,David Piston.Fluorescent protein spectra[J].Cell Science,2001,11(5):837-838.
[7]Hong L,Xie Z Z,Du Y H,et al.Alteration of volume-regulated chloride channel during macrophage-derived foam cell formation in atherosclerosis[J].Atherosclerosis,2011,216(1):59-66.
[8]张金凤,侯振中.TEAD1和YAP1对牛干扰素Tau基因表达调控的试验[J].中国兽医杂志,2013,49(5):26-29.
[9]Terashima H,Picollo A,Accardi A.Purified TMEM16A is suffi⁃cient to form Ca2+-activated Cl-channels[J].Proc Natl Acad SciU SA,2013,110(48):19354-19359.
[10]Filippin L,Abad M C,Gastaldello S,et al.Improved strategies for the delivery of GFP-based Ca2+sensors into themitochondrial matrix[J].Cell Calcium,2005,37(2):129-136.
Expression and app lication of YFP-H148Q/V163Sas chloride ion Sensor in FRT cells
ZHENG Kai,ZHANG Yun-qiao,XU Hui-jing,FANG Fang,YANG Zi-yan,ZHENG Yan,DONG Xiao-ru,LIRong-xia,HAO Feng
(DepartmentofMedicine Laboratory,Jilin Medical College,Jilin 132013,China)
To study the chloride ion sensitivity of YFP-H 148Q/V163S in FRT cells,pcDNA3.1-YFP-H 148Q/V163 was con⁃structed using the QuickChange Site-Directed Mutagenesis Kit.YFP-H148Q/V163Swas transfected into FRT cells stably express⁃ing Ano1 by liposome.The chloride ion sensitivity of YFP-H148Q/V163Swas detected by the fluorescence quenching kinetics test. Sequence analysis indicated that CAC at 508-510 bp site of YFP was substituted for CAG,in which the 148-amino acid H was substituted for Q;GTG at553-555 bp sitewas substituted for AGC,in which the 163-amino acid V was substituted for S.The re⁃sults of fluorescence quenching kinetics test confirmed that the relative fluorescence intensity of YFP-H148Q/V163Swas signifi⁃cantly decreased upon the addition of ionomycin and extracellular Cl-.pcDNA3.1-YFP-H148Q/V163 was successfully established and YFP-H148Q/V163S in FRT cellswas significantly sensitive to chloride ion.
YFP-H148Q/V163S;FRT;the relative fluorescence intensity
HAO Feng
Q785.786,Q256
A
0529-6005(2015)11-0006-03
2015-03-24
吉林省卫生计生科研计划(2014Z103);吉林省教育厅基金资助课题(2013-351);国家自然科学基金资助项目(812022031);2013年吉林省大学生创新创业训练计划;吉林医药学院大学生科研基金资助课题[吉医学科字(2012)第12号]
郑锴(1980-),女,讲师,硕士,研究方向为氯离子通道结构和功能的研究,E-mail:carane@163.com
郝峰,E-mail:haof863@126.cn

