不同氯盐溶液中钙矾石与氯离子结合的研究
张金山, 姚 燕, 王 昕, 郭随华, 董 刚
(中国建筑材料科学研究总院有限公司,北京 100024)
在海洋和高氯盐环境中,氯盐侵蚀是引起钢筋混凝土中钢筋锈蚀的主要因素.水泥水化产物的化学结合或物理吸附可以减少钢筋的锈蚀[1-2].钙矾石(AFt)是水泥水化的主要产物,其结构单元是{Ca3[Al(OH)6]·12H2O}3+[3].
长期以来,人们认为在适当条件下有相当广泛的阴离子团如CO2-3、Cl-等,可以取代SO2-4形成“三盐”或“高盐”型四元化合物[4-5].然而,近些年对于AFt 能否与氯离子结合提出了不同的观点.Buck[6]认为,在掺杂氯盐时,AFt可以跟氯离子化学结合生成Friedel盐(F 盐);Zibara[7]和Ekolu 等[4]认为只有在氯离子浓度较高时,AFt才能跟氯离子化学结合生成F 盐;也有学者认为AFt并不具备与氯离子结合的能力[8-9];勾密峰等[2]研究表明,AFt 与氯离子的结合是通过物理吸附实现的,不存在化学结合氯离子的能力.
这些研究多是基于AFt 在不同浓度的NaCl 溶液中讨论的,但对多种离子共存的海水溶液研究讨论相对较少.为明确AFt 在不同氯盐环境中的吸附固溶机制,本文通过溶液法合成AFt,再采用X 射线衍射(XRD)、热分析(TG-DSC)和红外光谱(IR)对其进行分析,对比研究相同浓度的纯NaCl 溶液与模拟海水溶液中AFt 对氯离子的结合能力及其机制,以期为海洋工程中硅酸盐水泥抗海水侵蚀的研究提供理论支持.
1 试验
1.1 原材料制备
将1.111 5 g 分析纯Ca(OH)2和1.666 7 g 分析纯Al2(SO4)3·18H2O(摩尔比为6∶1)分别加到500 mL去离子水中,充分搅拌后混合在一起,加入适量的分析纯NaOH,使pH=12.0.室温下养护7 d 后,将样品低压抽滤,用无水乙醇冲洗2 次,并在室温下的真空干燥箱中干燥,研磨成粉末.配置不同浓度模拟海水溶液(H),其离子浓度如表1所示,其中K为模拟海水中的氯离子浓度与实际海水离子浓度之比.按照相应氯离子浓度称取不同质量的NaCl配置不同浓度的纯NaCl溶液(Na,氯离子浓度分别为0.054、0.270、0.540、1.700 mol/L,编号分别为Na0.1、Na0.5、Na1.0、Na3.0).称取适量干燥的AFt 粉末分别置于纯NaCl 溶液和模拟海水溶液中,静置7 d,将样品低压抽滤,用无水乙醇冲洗2次,并在室温下的真空干燥箱中干燥,研磨成粉末.采用P·O 42.5 水泥,制作20 mm×20 mm×20 mm立方体净浆试件,分别放入淡水(编号为W)、纯NaCl 溶液(氯离子浓度为1.700 mol/L)、模拟海水溶液(氯离子浓度为1.700 mol/L)中标准养护28 d,再将试件制作成粉末.
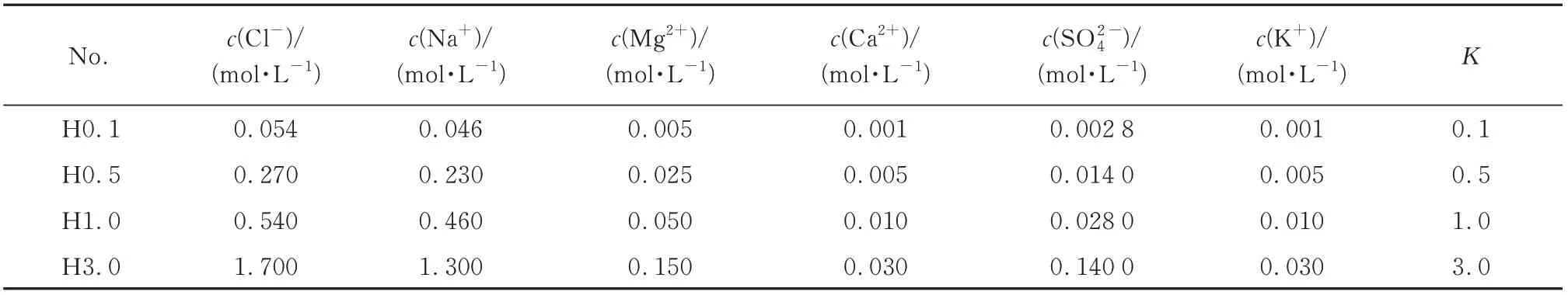
表1 不同倍数模拟海水离子浓度Table 1 Ion concentration of simulated seawater in different multiples
1.2 氯离子结合率的计算
AFt对氯离子的结合率(q)按式(1)计算.

式中:v为滤液体积总量,mL;ω为滤液中氯离子质量浓度,mg/L;w为溶液中氯离子总质量,g.
1.3 测试方法
物相分析采用德国Bruker AXS D8-Advance 型XRD. 热分析采用德国Netzsch STA449F3 型TG-DSC,N2氛围,升温速率10 ℃/min,最大加热范围为25~1 100 ℃.光谱分析采用德国Bruker Tensor 27 型IR,波数范围400~4 000 cm-1,分辨率1 cm-1.
2 结果与讨论
2.1 AFt对氯离子的结合率
表2 为2 种溶液中AFt 与氯离子结合率的比较.由表2 可见:无论在模拟海水中还是在纯NaCl 溶液中,AFt对氯离子的结合率均随着氯离子浓度的增加而升高;相同氯离子浓度情况下,模拟海水溶液中AFt 对氯离子的结合率高于纯NaCl 溶液,随着氯离子浓度的增加,两者逐渐接近,当氯离子浓度增加到1.700 mol/L 时,两者趋于相同.

表2 2 种溶液中AFt 与氯离子结合率的比较Table 2 Comparison of q values in two kinds of solution%
2.2 XRD 分析AFt与氯离子的结合
图1 为不同浓度NaCl 溶液中AFt 对氯离子的吸附.由图1 可见:在纯NaCl 溶液环境中,当氯离子浓度为0.540 mol/L(1 倍海水)或氯离子浓度低于0.540 mol/L 时,样品中并未出现F 盐;当氯离子浓度为1.700 mol/L(3 倍海水)时,样品中出现了少量F盐.即在纯NaCl 溶液中,AFt 对氯离子结合能力较弱,达到相当于3 倍海水的氯离子浓度时,AFt 可以结合少量氯离子,形成F 盐;溶液中NaCl浓度增加使得AFt 峰位有所偏移,氯离子的侵蚀作用使得AFt的晶格参数发生了改变.
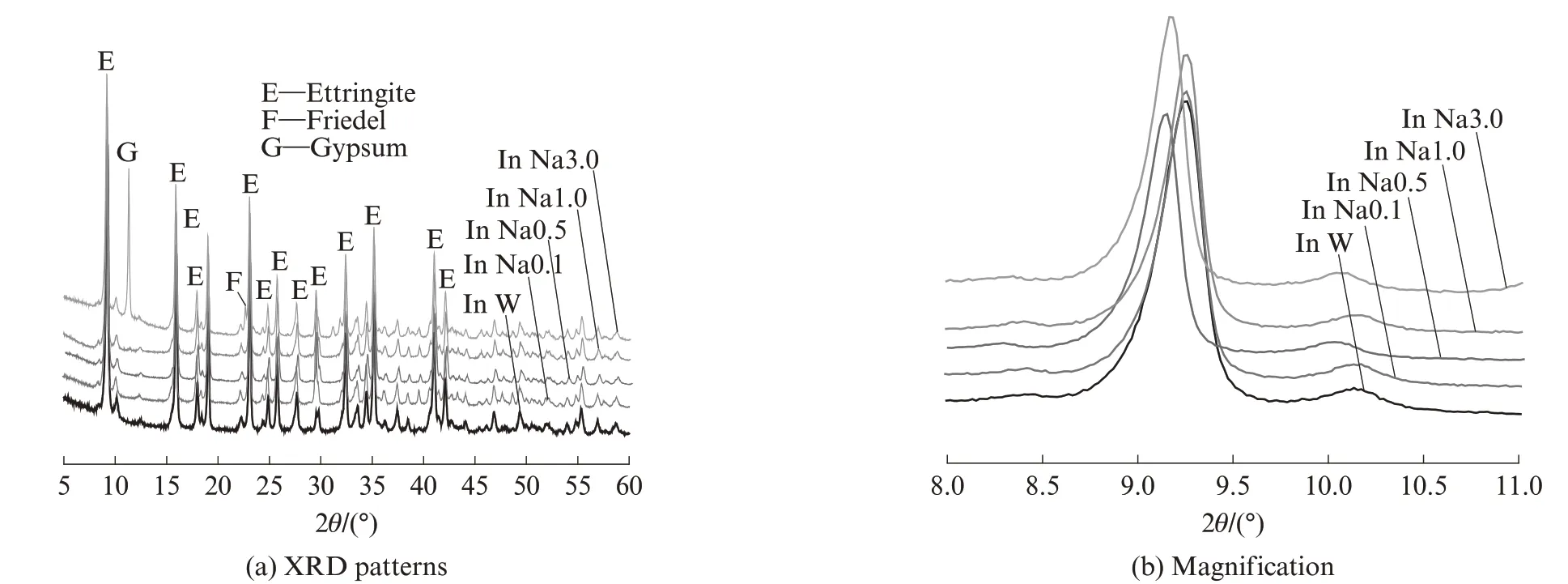
图1 不同浓度NaCl 溶液中AFt 对氯离子的吸附Fig.1 Adsorption of chloride ion by ettringite in NaCl solution of different concentrations
图2 为不同浓度模拟海水溶液中AFt 对氯离子的吸附.由图2 可见:当模拟海水溶液中氯离子浓度较低(氯离子浓度0.054 mol/L,即0.1 倍海水浓度)时,衍射特征峰强度未发生明显变化;当模拟海水溶液中氯离子浓度升至0.270 mol/L 时,样品中开始有少量F 盐和Mg(OH)2形成,同时衍射特征峰的位置发生偏移;当模拟海水溶液中氯离子浓度升至0.540、1.700 mol/L(即1 倍海水和3 倍海水浓度)时,AFt的衍射特征峰消失,但出现了较强的F 盐和石膏衍射峰;当模拟海水溶液中的氯离子浓度达到1 倍海水及以上时,AFt 的主峰已经消失,低于1 倍海水浓度时,AFt的峰位向左偏移,表明海水的侵蚀使得AFt晶格参数发生了改变.
图2 不同浓度模拟海水溶液中AFt 对氯离子吸附Fig.2 Absorption of chloride ion by ettringite in simulated seawater solution with different concentrations
对比图1、2 可知,纯AFt对氯离子的结合能力可能是因为高浓度海水环境对AFt 的形成和稳定性产生了影响,在多种离子共同作用下AFt 的结构稳定性变差,转变为单硫型水化硫铝酸钙(AFm)和石膏,氯离子与AFm 结合形成F 盐.
2.3 IR 分析AFt与氯离子的结合
图3 为不同浓度NaCl溶液中AFt吸附氯离子的IR 图谱.由图3 可见:在纯NaCl 溶液中,AFt 的主要吸收峰位(3 635、3 420、1 640、1 120、850、620、550、420 cm-1)并未随着氯离子浓度的增加产生明显的偏移,表明没有新的官能团产生.
图4为不同浓度模拟海水溶液中AFt吸附氯离子的IR图谱.由图4可见:当模拟海水溶液中氯离子的浓度达0.270 mol/L后,随着氯离子浓度的增加,550 cm-1附近的吸收峰([Al(OH)6]振动)消失;当氯离子浓度达到1.700 mol/L时,620 cm-1附近的吸收峰(S—O 弯曲振动)消失,并在668、601 cm-1附近形成吸收峰,为石膏特征波数,与图3(a)相互印证,表明样品中生成了石膏;550 cm-1处的吸收峰消失,为氯离子取代AFt晶体中[Al(OH)6]八面体形成的F盐[2,10-15].

图3 不同浓度NaCl 溶液中AFt 吸附氯离子的IR 图谱Fig.3 IR spectra of sorption of chloride ions by ettringite in different concentrations of NaCl solution
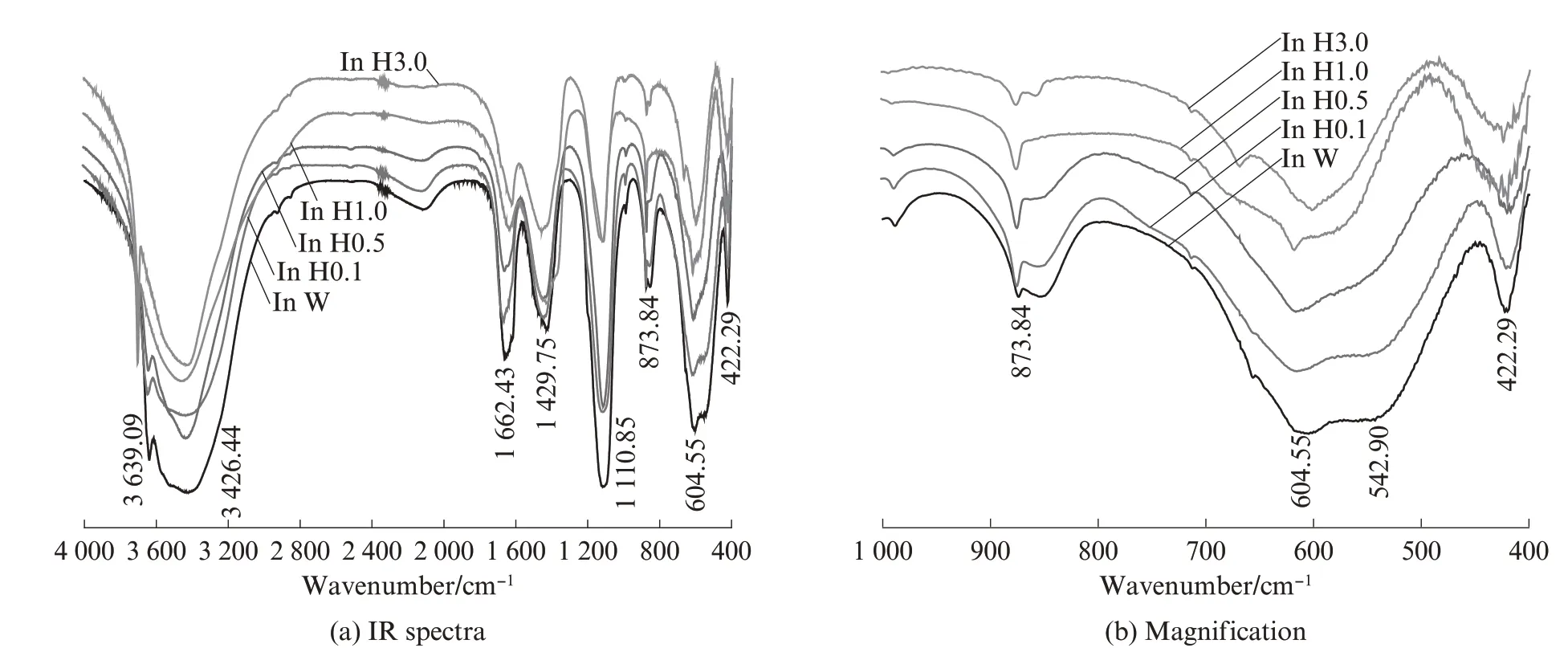
图4 不同浓度模拟海水溶液中AFt 吸附氯离子的IR 图谱Fig.4 IR spectra of sorption of ettringite on chloride ion in simulated seawater solution with different concentrations
2.4 TG-DSC 分析AFt与氯离子的结合
图5 为不同浓度NaCl 溶液中AFt 吸附氯离子的DSC 曲线.由图5 可见:在纯NaCl 溶液中,随着氯离子浓度的增加,AFt 分解温度逐渐降低,但没有产生新物质的吸热放热峰.因此,在纯NaCl 溶液中,氯离子浓度的增加降低了AFt的热稳定性,但并未与AFt结合产生F 盐.
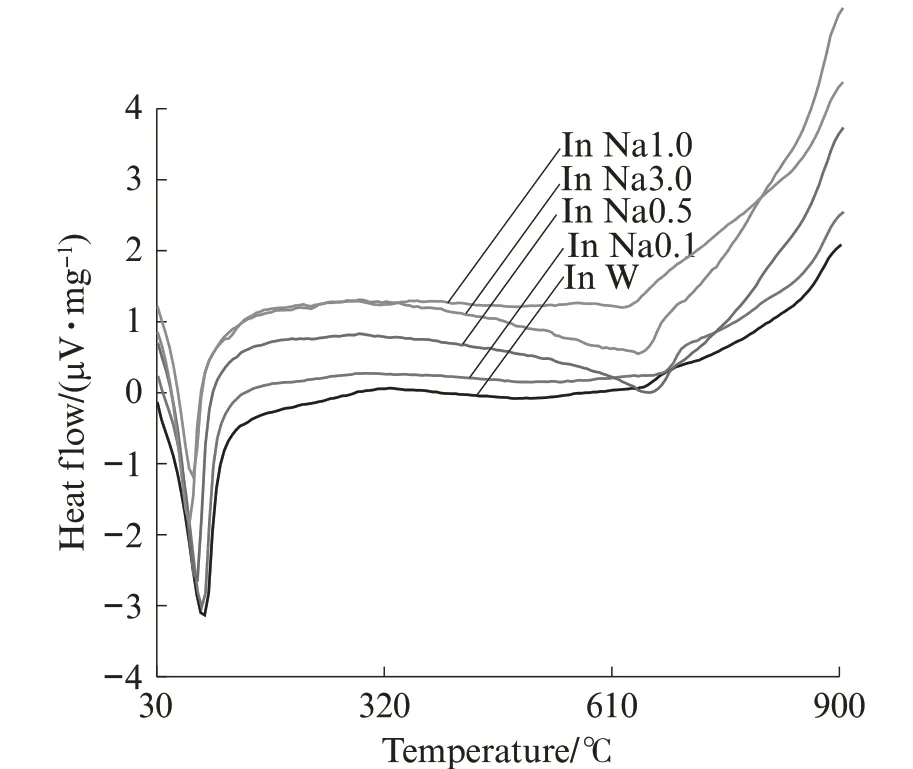
图5 不同浓度NaCl 溶液中AFt 吸附氯离子的DSC曲线Fig.5 DSC curves of sorption of ettringite to chloride ion in NaCl solution of different concentrations
图6为不同浓度模拟海水溶液中AFt 与氯离子结合的的DSC 曲线.由图6 可见:在0.5 倍海水及以下浓度时,随着模拟海水溶液中各离子浓度的增加,AFt的分解温度升高;当模拟海水溶液中氯离子的浓度为0.270 mol/L 及以上时,在170 ℃附近产生失重,在370 ℃附近产生第2 次失重,分别为F 盐失去层间水和羟基脱水产生的失重[10,16].因此,在模拟海水溶液中,当氯离子浓度达到0.270 mol/L(0.5 倍海水)时,AFt就会与氯离子结合生成F 盐.

图6 不同浓度模拟海水溶液中AFt 与氯离子结合的DSC 曲线Fig.6 DSC curves of binding of ettringite to chloride ion in simulated seawater solution with different concentrations
2.5 水泥净浆中AFt与氯离子的结合情况
图7 为水泥净浆在不同溶液中AFt 结合氯离子的XRD 图谱.由图7 可见:经过不同溶液浸泡28 d后,净浆中的水化产物有了明显的变化,在经过纯NaCl 溶液和模拟海水溶液浸泡的净浆水化产物中,发现了F 盐的衍射峰,这表明水泥水化反应生成的AFt可以与溶液中的氯离子结合,生成F 盐.

图7 水泥净浆在不同溶液中AFt 结合氯离子的XRD 图谱Fig.7 XRD patterns of the chloride binding of ettringite in different solutions of cement paste
2.6 分析与讨论
由以上分析可知,在纯NaCl 溶液中,只在XRD分析中发现氯离子与AFt结合生成少量F 盐的现象,而IR 分析与DSC 结果并不支持这一现象,故不能确定在纯NaCl 溶液中AFt 是否能够化学结合氯离子;在模拟海水溶液中,氯离子浓度达到0.270 mol/L 时就会与AFt结合生成F 盐,可能是在模拟海水溶液中多种离子的共同作用下,降低了AFt 结构的稳定性,促进了AFt 分解成石膏与AFm,而后氯离子与AFm结合生成F 盐.因此,在相同氯离子浓度情况下,模拟海水溶液中AFt 对氯离子的结合率高于纯NaCl 溶液.由此可见,在纯NaCl 溶液中,AFt 对氯离子结合作用主要为物理吸附,不确定AFt 是否会与氯离子会产生化学结合,生成F 盐;在模拟海水溶液中,AFt与氯离子的结合作用不仅有物理吸附,还有化学结合,氯离子的浓度达到0.270 mol/L 时,AFt 与氯离子化学结合生成F 盐.
3 结论
(1)在纯NaCl 溶液中,钙矾石(AFt)与氯离子发生物理吸附,不确定是否产生化学结合.
(2)在模拟海水溶液中,当氯离子浓度达到0.270 mol/L 时,AFt 会与氯离子结合生成F 盐.
(3)模拟海水溶液中多种离子的共同作用,降低了AFt的结构稳定性,促进了AFt与氯离子的结合.
(4)在纯NaCl溶液中,AFt与氯离子主要为物理吸附;在模拟海水溶液中,AFt 与氯离子不仅有物理吸附,还有化学结合.

