聚乙二醇干扰素与普通干扰素抗病毒治疗的比较研究
刘素芬,冯爱东,李静,张海丛,郑欢伟,黄艳,李兵顺,董正洪
(河北省石家庄市第五医院传染科,河北 石家庄 050021)
·临床论著·
聚乙二醇干扰素与普通干扰素抗病毒治疗的比较研究
刘素芬,冯爱东,李静,张海丛,郑欢伟,黄艳,李兵顺,董正洪
(河北省石家庄市第五医院传染科,河北 石家庄 050021)
目的探讨聚乙二醇干扰素α-2a对慢性乙型肝炎患者疗效观察。方法随机选取76例慢性乙型肝炎患者,分为聚乙二醇干扰素α-2a组(38例)和普通干扰素组(38例),分别接受96周治疗。观察治疗前后肝组织中乙肝病毒共价闭合环状DNA(HBV cccDNA)检出率及含量、肝组织和血清HBV DNA水平以及肝功能。结果治疗96周,普通干扰素组和聚乙二醇干扰素α-2a组HBV cccDNA检出率和含量、肝组织和血清HBV DNA水平、丙氨酸氨基转移酶,天门冬氨酸氨基转移酶以及总胆红素的含量都明显降低(P<0.05),聚乙二醇干扰素α-2a组的降低量更为显著(P<0.05)。结论聚乙二醇干扰素α-2a对慢性乙型肝炎患者肝组织中cccDNA的清除疗效显著优于普通干扰素。
慢性乙型肝炎;聚乙二醇干扰素α-2a;共价闭合环状DNA
慢性乙型肝炎治疗的重要目标是清除或持续抑制乙肝病毒(hepatitis B virus,HBV),减轻肝脏损伤,从而延长患者的生存期[1]。乙型肝炎病毒共价闭合环状DNA(cccDNA)是HBV基因组复制中间体mRNA和前基因组RNA的模板,是HBV持续感染的关键,也是各种药物治疗慢性乙型肝炎复发的关
键所在[2]。干扰素α-2a(IFN-α-2a)是目前临床应用于抗肝炎病毒的重要药物,但在临床应用中存在半衰期短、易被肾脏清除、需要频繁给药以及用药后出现“峰谷”效应等副作用[3],并不适宜长期给药。聚乙二醇干扰素α-2a(长效干扰素)同时具有抗病毒效应和免疫调节效应。因此,这种药物可能比抗病毒药更有效[4]。
为了更好的评价聚乙二醇干扰素α-2a治疗慢性乙型肝炎患者的近、远期疗效及安全性,本研究对聚乙二醇干扰素α-2a与普通干扰素的临床疗效进行了比较。对慢性乙型肝炎患者肝组织进行活检,同时采用血清学方法对肝组织中HBV cccDNA、肝组织和血清HBV DNA以及肝功能进行了临床疗效观察,以期为临床应用聚乙二醇干扰素α-2a治疗慢性乙型肝炎患者提供实验依据。
1 资料与方法
1.1病例资料及分组
76例慢性乙型肝炎患者,男59例,女17例,年龄(29~47)岁,平均38.1岁,均为河北省石家庄市第五医院住院患者。本研究病例符合以下条件:①血清HBsAg持续阳性6个月以上;②血清HBV DNA连续2次阳性(HBV DNA>103copies/ml);③血清ALT超过参考值上限2~9倍;④无HAV、HCV、HDV、HEV和HIV重叠感染;⑤不伴有失代偿期肝硬化;⑥无明显的心、脑、肾病史,无精神病和糖尿病病史,无酗酒和吸毒史;⑦非妊娠或哺乳期妇女;⑧近6个月内未使用过抗病毒药物及免疫调节药;⑨血常规正常。
将76例患者随机分为两组,普通干扰素组与聚乙二醇干扰素α-2a组,每组38例。两组患者年龄、性别、病情变化等临床资料,差异无统计学意义,具有可比性。本研究遵循本院人体试验的委员会所制定的伦理学标准并得到该委员会的批准,且取得受试对象或其亲属的知情同意。
1.2治疗方法
普通干扰素组给予普通干扰素(α-IFN),300万U,隔日1次肌肉注射。聚乙二醇干扰素α-2a组给予聚乙二醇干扰素α-2a(上海罗氏制药有限公司产品),180μg,每周1次皮下注射,疗程均为96周。
1.3实验方法
1.3.1肝组织学检查普通干扰素组和聚乙二醇干扰素α-2a组所有患者在治疗前和治疗后经局部麻醉,在彩色B超的定位和引导下应用活检枪、18G肝穿针进行快速肝活检,切取的肝组织送本院病理科进行病理检查。
1.3.2血清标志物检测方法HBV血清标志物HBsAg、HBeAg用酶联免疫吸附试验检测。
1.3.3肝组织中HBV cccDNA含量检测所有标本收集后采用HBV跨双缺口的特异引物进行荧光PCR定量检测进行肝内病毒DNA分析。引物由上海生工生物技术有限公司合成。序列为:5'-CGACC ACGGGGCGCACCTCTCTTTAC-3';5'-CAAGGCACA GCTTGGAGGCTTGAACAG-3'。TaqMan荧光探针5'-TCTCCTCCCCAGCTCCTCCCAG-3',检测值用copies/mg表示,检测结果进行统计学分析。
1.3.4肝组织和血清HBV DNA病毒检测指标普通干扰素组和聚乙二醇干扰素α-2a组所有患者在治疗前和治疗后抽取清晨空腹血液10 ml,分离血清,采用荧光实时定量PCR仪(美国ABI公司)进行血清HBV DNA检测。检测值用copies/ml表示,检测下限为100 copies/ml,同时对检测结果进行统计学分析。
1.3.5肝功能检测普通干扰素组和聚乙二醇干扰素α-2a组所有患者在治疗前和治疗后抽取血液,分离血清,采用美国BeckMan全自动生化分析仪检测血清中丙氨酸氨基转移酶(ALT),天门冬氨酸氨基转移酶(AST)和总胆红素(TBIL)含量。
1.4统计学方法
采用SPSS 13.0软件进行数据处理,计量资料用均数±标准差(±s)表示,两个样本均数比较用t检验,两样本率比较用χ2检验或Fisher’s精确检验,组内时间的显著性研究用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1肝组织学检查
治疗前后的肝组织病理标本经10%中性甲醛溶液固定,石蜡包埋切片,常规HE染色。治疗前后的病理检测图如附图所示,根据2000年中华医学会病毒性肝炎防治方案组织病理学诊断标准,治疗前肝组织炎症活动分级为G2~G3,纤维化分期为S1~S2。治疗后炎症分级为G1~G2,纤维化分期为S1。聚乙二醇干扰素α-2a组和普通干扰素组治疗后较治
疗前炎症、纤维化程度均下降。
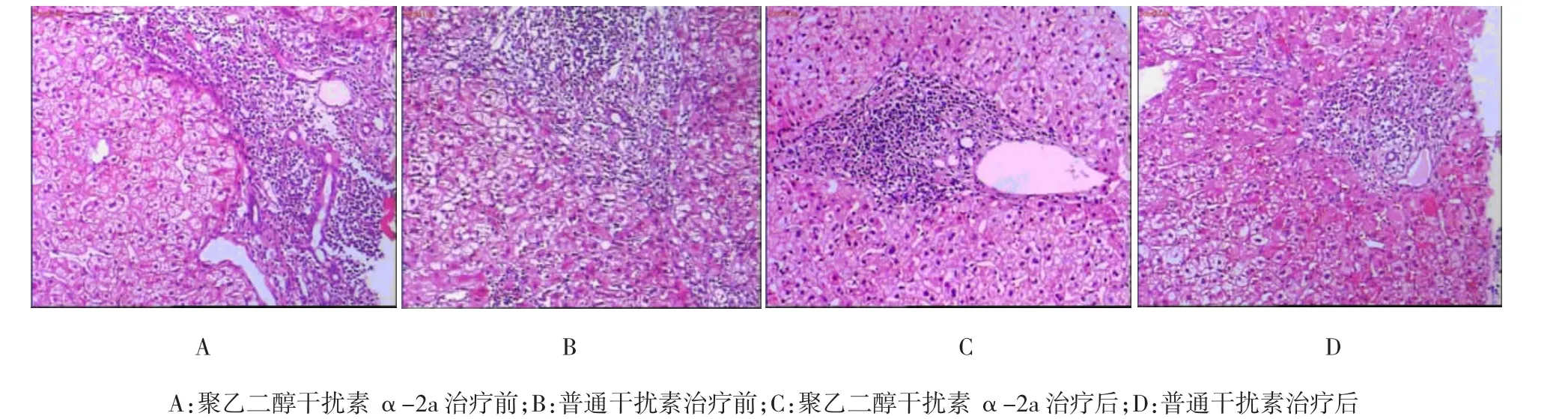
附图 治疗前后肝组织病理检测图(HE染色×400)
2.2HBV血清标志物及HBV-DNA的变化
聚乙二醇干扰素α-2a组和普通干扰素组治疗前基线情况见表1。在治疗96周后,聚乙二醇干扰素α-2a组HBe Ag阳转阴22例,阴转率为95.7%,HBV-DNA阴转率为100%;普通干扰素组HBeAg阳转阴15例,阴转率为68.2%,HBV-DNA阴转率92.1%。聚乙二醇干扰素α-2a组的HBeAg阴转率及HBV-DNA阴转率均明显高于普通干扰素组,差异有统计学意义(P<0.05)。

表1 两组治疗前基线情况比较
2.3两组患者肝组织中HBV cccDNA含量和检出率的变化
随着抗病毒时间的延长,聚乙二醇干扰素α-2a组中HBV cccDNA含量以及检出率均显著降低。48周后,与治疗前比较,普通干扰素组治疗后肝组织中HBV cccDNA的检出率和含量也显著降低(P<0.05);而聚乙二醇干扰素α-2a组肝组织中HBV cccDNA的检出率和含量与普通干扰素组比较,下降更为明显(P<0.05)。见表2。
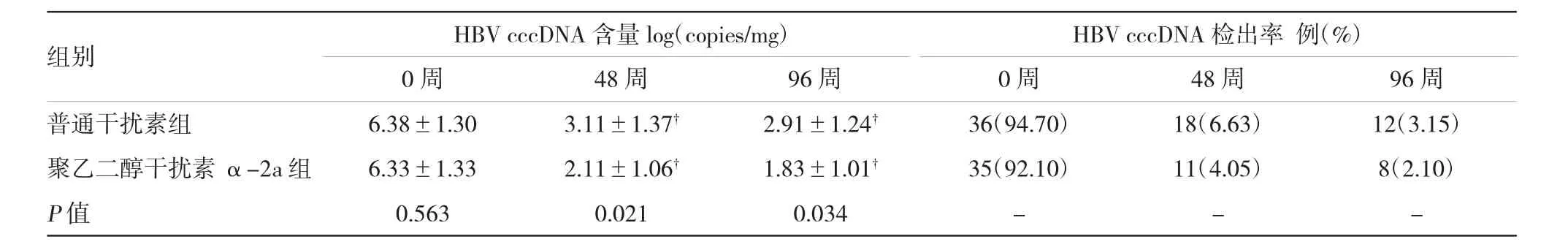
表2 两组治疗48、96周后肝组织中HBV cccDNA含量和检出率的变化
2.4肝组织和血清HBV DNA病毒检测结果
经过96周给药治疗后,与治疗前比较,普通干扰素组和聚乙二醇干扰素α-2a组的肝组织和血清HBV DNA含量均显著降低(P<0.05);但与普通干扰素组比较,聚乙二醇干扰素α-2a组中肝组织和血清中HBV DNA的含量下降更多,差异有统计学意义(P<0.05)。见表3。
2.5肝脏活组织检查
聚乙二醇干扰素α-2a组中治疗前肝组织HBe Ag阳性23例,治疗48周时4例阳性,96周时1例阳性;普通干扰素组中HBeAg阳性22例,治疗48周时,12例阳性,而96周时7例阳性。经过治疗后,随着患者HBV DNA对数值的降低,肝组织炎症活动度(G)明显降低,且患者肝组织纤维的活动度也相应降低。
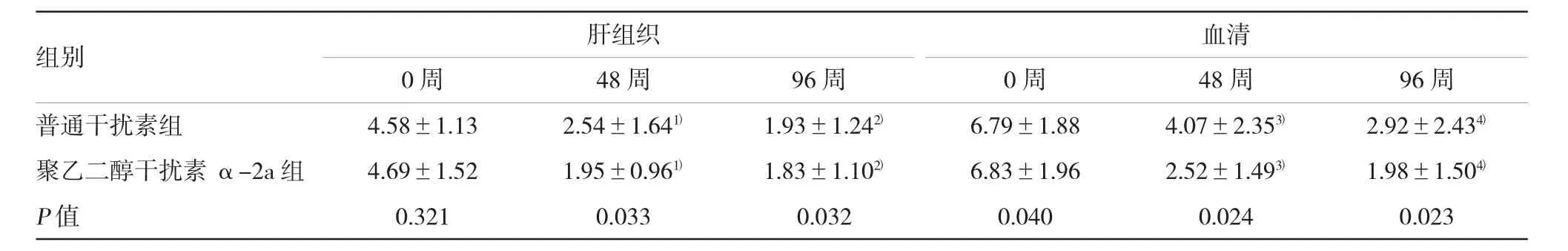
表3 两组治疗不同时间后肝组织和血清HBV DNA结果
2.6治疗前后血清肝功能变化
普通干扰素组患者在抗病毒治疗48周后,转氨酶水平较基线水平有明显好转(P<0.05),同时,与治疗前基线比较,聚乙二醇干扰素α-2a组经12周治疗后,血清中ALT、AST和TbiL的含量均显著降低(P<0.05);随着抗病毒时间的延长,两组的ALT复常率均有所增加,而聚乙二醇干扰素α-2a组明显优于普通干扰素组,差异有统计学意义(P<0.05)。见表4。
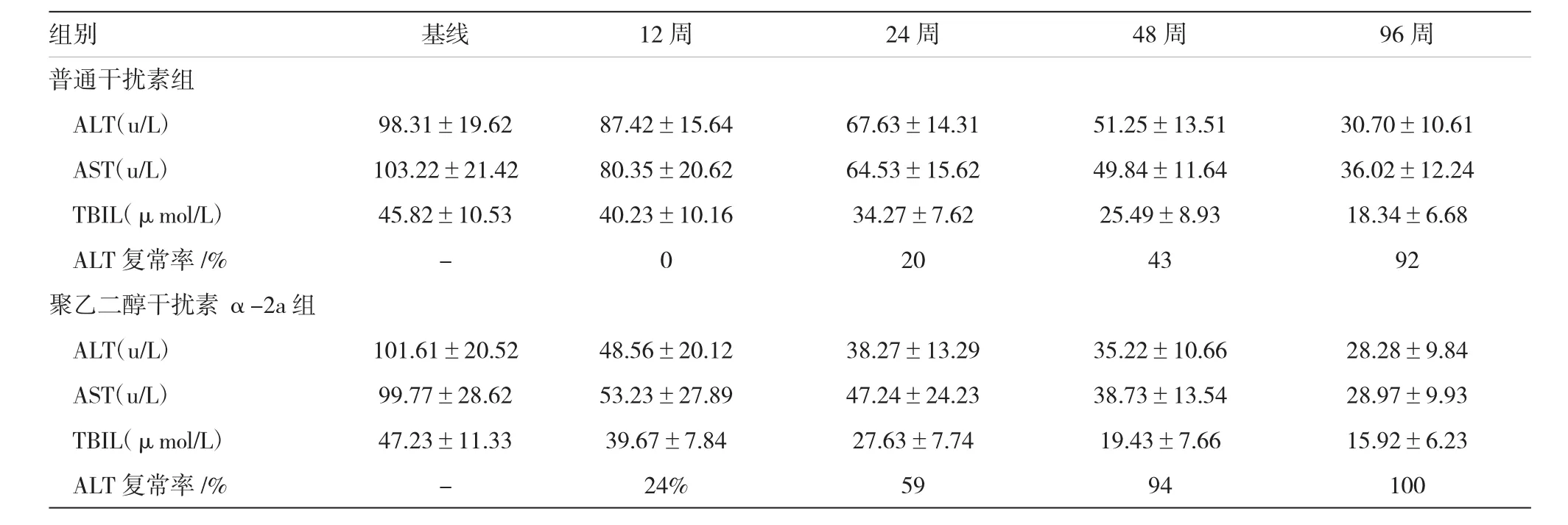
表4 两组干扰素治疗乙型肝炎患者肝功能情况
3 讨论
蛋白质聚乙二醇修饰技术起源于上世纪70年代,1977年DAVIS等研究人员发现,蛋白质经PEG偶联之后免疫原性极大降低,体内的循环半衰期增加,药效学等性质都得到了明显改善[5-6]。
聚乙二醇干扰素α-2a是40 kD聚乙二醇与普通干扰素α-2a结合形成的长效干扰素。2002年FDA批准瑞士罗氏公司的聚乙二醇干扰素α-2a上市。聚乙二醇分子的大小和支链结构决定药物的吸收、分布和消除特点,在干扰素表面形成分子屏障,使其免受酶的分解,与器官、细胞的接触时间延长,同时溶解度和稳定性增加,清除率减慢,聚乙二醇干扰素α-2a可使患者体内干扰素有效血药浓度持续时间延长,每周给药一次即可达到持续抑制病毒的目的[7-8]。聚乙二醇干扰素α-2a与肝细胞表面的Α受体结合,触发细胞内复杂的信号转导途径并激活基因转录,调节多种生物信号,其中包括抑制感染细胞内的病毒复制和细胞增殖,有免疫调节作用[9-10]。因此,聚乙二醇干扰素α-2a可以持续有效地抗病毒,长期应用可能起到清除乙肝病毒,改善肝功能,改变肝病预后的作用。
研究表明,肝细胞内持续HBV感染是以核内HBV cccDNA的存在为特征,HBV cccDNA是HBV mRNA和前基因组RNA的合成模板,也是HBV持续感染的关键因素,因此抑制或清除HBV cccDNA是治疗慢性乙肝的关键[11-12]。有研究显示,拉米夫定对外周血HBV DNA清除效果显著,但对细胞内的HBV cccDNA的清除几乎无效[13]。口服单一抗病毒药物,如恩替卡韦或阿德福韦酯,对肝组织内和血清中的HBV DNA清除效果显著,而对肝组织内HBV cccDNA的清除作用微小[14],因此寻找能够清除肝组织内HBV cccDNA的有效药物是治疗慢性乙型肝炎的关键。
本研究通过肝组织活检及血清检测显示,聚乙二
醇干扰素α-2a治疗后肝组织中HBV cccDNA检出率和含量均明显降低,肝组织中和血清中HBV DNA含量同样显著降低;丙氨酸氨基转移酶、天门冬氨酸氨基转移酶和总胆红素也显著降低,提示两种治疗方法对慢性乙型肝炎的治疗均有效,而聚乙二醇干扰素α-2a的治疗效果比普通干扰素更加显著。
本研究观察到聚乙二醇干扰素α-2a对慢性乙型肝炎患者肝组织内HBV cccDNA的清除及肝功能的改善明显优于普通干扰素,有较持久的疗效,同时以其独特的药代动力学特点,简单的每周1次给药方式,可使患者具有更好的依从性。
[1]LIEVELD FI,VAN VLERKEN LG,SIEREMA PD,et al.Patient adherence to antiviral treatment for chronic hepatitis B and C:a systematic review[J].Ann Hepatol,2013,12(3):380-391.
[2]WANG M,QIU N,LU S,et al.Serum hepatitis B surface antigen is correlated with intrahepatic total HBV DNA and cccDNA in treatment-naïve patients with chronic hepatitis B but not in patients with HBV related hepatocellular carcinoma[J].J Med Virol,2013,85(2):219-227.
[3]DAVIS D A,BONI R,VON WUSSOW P,et al.Adjuvant immunotherapy in malignant melanoma:impact of antibody formation against interferon-alpha on immunoparameters in vivo[J].J Immunother,1997,20(3):208-213.
[4]BAILON P,PALLERONI A,SCHAFFER CA,et al.Rational design of a potent,long-lasting form of interferon:A 40 kD branchedpolyethyleneglycol-tonjugatedinterferon-2aforthe treatment of hepatitis C[J].Bioconjugate Chem,2001,12(2):195-202.
[5]ABUCHOWSKI A,VAN E,PALCZUK NC,et al.Alteration of immunological properties of bovine serum albumin by covalent attachment of polyethylene glycol[J].J Biol Chem,1977,252(11): 3578-3581.
[6]LEE CR,MCKENZIE CA,WEBSTER KD,et al.Pegademase bovine:replacement therapy for severe combined immunodeficiency disease[J].DICP,1991,25(10):1092-1095.
[7]HUI CK,LAU GK.Peginterferon-alpha 2a(40 kD)(Pegasys)for hepatitis B[J].Expert Rev Anti Infect Ther,2005,3(4):495-504. [8]COOKSLEY WG.Peginterferon-alpha 2a for the treatment of hepatitis B infection[J].Expert Opin Pharmacother,2005,6(8): 1373-1380.
[9]CHEN J,WANG Z,GUO Y,et al.Serum HBsAg changes in HBeAg positive chronic hepatitis B patients with continuous viral load reductions during treatment with adefovir or peg-interferon-alpha-2a[J].Antiviral Res,2009,81(1):88-91.
[10]KWON JH,KIM YS,KIM SG,et al.The efficacy and safety of peginterferon-α-2a in korean patients with chronic hepatitis B: A multicenter study conducted in a real clinical setting[J].Gut Liver,2013,7(2):197-205.
[11]MALMSTROM S,LARSSON SB,HANNOUN C,et al.Hepatitis B viral DNA decline at loss of HBeAg is mainly explained by reduced cccDNA load-down-regulated transcription of PgRNA has limited impact[J].PLoS One,2012,7(7):e36349.
[12]WANG M,QIU N,LV S,et al.Serum hepatitis B surface antigen is correlated with intrahepatic total HBV DNA and cccDNA in treatment-naive patients with chronic hepatitis B but not in patients with HBV related hepatocellular carcinoma[J].J Med Virol,2013,85(2):219-227.
[13]MORALEDA G,SAPUTELLI J,ALDRICH CE,et al.Lack of effect of antiviral therapy in nondividing hepatocyte cultures on the closed circular DNA of woodchuck hepatitis virus[J].J Virol,1997,71(12):9392-9399.
[14]CHENG PN,LIU WC,TSAI HW,et al.Association of intrahepatic cccDNA reduction with the improvement of liver histology in chronic hepatitis B patients receiving oral antiviral agents[J].J Med Virol,2011,83(4):602-607.
(张蕾 编辑)
Comparison of antiviral effect of Peginterferon with interferon
Su-fen LIU,Ai-dong FENG,Jing LI,Hai-cong ZHANG,Huan-wei ZHENG, Yan HUANG,Bing-shun LI,Zheng-hong DONG
(Department of Infectious Diseases,the Fifth Hospital of Shijiazhuang, Shijiazhuang,Hebei 050021,P.R.China)
【Objective】To explore the effect of Peginterferon alph-2a treatment on intrahepatic hepatitis B virus covalently closed circular DNA(cccDNA).【Methods】A total of 76 patients were randomly divided into control group treated with common interferon(38 patients)and Peginterferon alph-2a treatment group(38 patients).Both groups were treated for 96 weeks.The detection rate and content of intrahepatic hepatitis B virus(HBV)cccDNA were tested,the level of HBV DNA in hepatic tissue and serum was measured and the hepatic functions were observed.【Results】After treatment for 96 weeks,the detection rate and the level of intrahepatic HBV cccDNA,the level of HBV DNA in hepatic tissue and serum,ALT,AST and TBIL in serum were decreased significantly after therapy in both groups(P<0.05).Importantly,the above parameters had more obvious declines after therapy in the Peginterferon alph-2a treatment group compared to the control group(P<0.05).【Conclusions】The effect of Peginterferon alph-2a treatment on intrahepatic HBV cccDNA is predominant compared to the effect of common interferon.
chronic hepatitis B;Peginterferon alpha-2a;covalently closed circular DNA
1005-8982(2015)27-0045-05
R575.1;R453
A
2015-06-19

