Roux-en-Y胃旁路术后对2型糖尿病大鼠肾脏胰岛素受体表达的影响及意义*
文艺,祁巧,冯犁,张少华,陈振宇,汤礼军
(1.成都军区总医院普通外科中心,四川 成都 610083;2.95879部队门诊部,四川 成都 610083)
·论著·
Roux-en-Y胃旁路术后对2型糖尿病大鼠肾脏胰岛素受体表达的影响及意义*
文艺1,祁巧2,冯犁1,张少华1,陈振宇1,汤礼军1
(1.成都军区总医院普通外科中心,四川 成都 610083;2.95879部队门诊部,四川 成都 610083)
目的研究胃旁路术对2型糖尿病大鼠肾脏胰岛素受体表达的影响,探讨其改善肾脏胰岛素抵抗的可能机制及意义。方法采用高脂饮食加腹腔注射小剂量链脲佐菌素(STZ)方法建立2型糖尿病大鼠模型。将造模成功的糖尿病大鼠随机分为3组:糖尿病模型组(DM组),假手术组(SRYGB组),手术组(RYGB组);另取8只正常SD大鼠作为正常对照组(NC组)。分别于术前及术后4周检测各组大鼠总胆固醇(TC)、甘油三酯(TG)、游离脂肪酸(FAA)、尿素氮(Bun)和肌酐(Cr);术前、术后1、2、4周,检测各组大鼠空腹胰岛素,行口服糖耐量试验(OGTT),计算血糖浓度-时间曲线下面积(AUC)和胰岛素敏感指数(ISI)。术后4周,采用实时荧光定量聚合酶链反应(RT-PCR)检测肾脏组织中糖异生关键酶:葡萄糖6磷酸酶(G-6-P)和磷酸烯醇式丙酮酸激酶(PEPCK)的mRNA的相对表达,采用Western blot技术检测肾脏皮质中胰岛素受体α(InR-α)和胰岛素受体β(InR-β)蛋白含量。结果术后4周,手术组大鼠较糖尿病模型组和假手术组血脂相关指标以及血清尿素氮降低(P<0.05),空腹血糖及OGTT 2 h血糖值呈明显下降趋势(P<0.05),血糖浓度-时间曲线下面积明显减小(P<0.05),胰岛素敏感性明显升高(P<0.05),手术组葡萄糖6磷酸酶(G-6-P)及磷酸烯醇式丙酮酸激酶(PEPCK)mRNA的相对表达较糖尿病模型组和假手术组均有不同程度降低(P<0.05),手术组胰岛素受体α(InR-α)的蛋白表达较糖尿病模型组和假手术组有一定程度升高(P<0.05),但胰岛素受体β(InR-β)的蛋白表达在各组间差异无统计学意义(P>0.05)。结论胃旁路术能显著降低糖尿病大鼠血糖,提高胰岛素敏感性,改善肾脏胰岛素抵抗,减弱肾脏糖异生,其机制可能术后上调肾脏InR-α的蛋白表达以及下调PEPCK和G-6-P mRNA表达有关。
胃旁路术;糖尿病;肾脏;胰岛素抵抗;糖异生
糖尿病已成为威胁人类健康的主要慢性疾病之一,其中90%以上为2型糖尿病。目前饮食控制和口服降糖药物的治疗方式对血糖的长期控制并不理想。一项前瞻性研究表明,结合各种治疗方法,仅有不到1/3的糖尿病患者血糖可以得到较好的控制[1]。相较于传统治疗,以Roux-en-Y胃旁路术为代表的减重手术对2型糖尿病的治疗能取得意想不到效果,手术不仅可以明显的改善2型糖尿病患者的血糖、胰岛素和糖化血红蛋白,同时也可纠正糖耐量异常和胰岛素抵抗[2]。近年来的研究表明胰岛素及其下游信号通路对肾脏正常功能的维持发挥着重要地作用,在糖尿病状态时肾脏胰岛素受体的表达会发生变化,产生胰岛素抵抗现象,进而影响正常的肾脏功能[3]。本研究拟采用高脂高糖饮食加腹腔注射小剂量链脲佐菌素建立大鼠2型糖尿病模型,观察胃旁路术后对肾脏胰岛素受体表达的影响,对胃旁路术改善肾脏胰岛素抵抗可能机制及意义进行初步探讨。
1 材料与方法
1.1动物及饲料
8周龄SPF级SD大鼠40只,雄性,体重170~190 g,由简阳达硕动物科技有限公司提供,许可证号:SCXK(川)2004。实验动物基础饲料由简阳达硕动物科技有限公司提供,高脂饲料由基础鼠饲料(72%)、炼猪油(15%)、蔗糖(10%)和蛋黄(3%)按比例搭配制成高脂高糖饲料。
1.2试剂和器材
链脲佐菌素(streptozotocin,STZ)购自Sigma公司,柠檬酸缓冲液(0.1 mol/L、pH 7.4),稳步型血糖仪购自美国雅培公司,胰岛素放射免疫试剂盒购自海博研生物科技有限公司,Trizol购自碧云天生物技术研究所,逆转录荧光定量PCR试剂盒购自日本TaKaRa公司(R0086A),全蛋白提取试剂盒购自南京凯基生物科技发展有限公司,山羊抗兔IgG购自武汉博士德生物工程有限公司,兔抗InR-α和InR-β多克隆抗体购自美国Santa Cruz公司
1.3糖尿病动物模型复制、分组及处理
雄性SD大鼠40只,分为正常对照组8只和糖尿病建模动物32只。正常组动物给予基础饲料,建模动物给予高脂饲料。喂养4周后,禁食12 h,左下腹腔一次性注射STZ 35 mg/kg(用0.1 mol/L、pH 7.4的柠檬酸缓冲液在避光和冰浴下配制成浓度1% STZ溶液,现配现用)。1周后行口服糖耐量试验(oral glucose tolerance test,OGTT)试验(禁食12 h,葡萄糖1.5 g/kg灌胃,测2 h血糖),筛选血糖值>11.1 mmol/L的大鼠确定为糖尿病大鼠(成模30只,成模率93.8%)[3]。模型稳定1周后,将成模的糖尿病大鼠30只随机分为3组,即糖尿病模型组8只,假手术组8只和手术组14只。假手术组行胃窦十二指肠离断原位吻合术,手术组行胃旁路术[大鼠术前禁食12 h,不限饮水,0.5%戊巴比妥钠(50 mg/kg)腹腔内注射麻醉后固定于手术台,无菌条件下,上腹部正
中切口长3 cm切开进腹,闭合胃远端,距Treitz韧带10 cm切断空肠,远端肠襻行胃空肠吻合,距胃肠吻合口远端10 cm行空肠侧侧吻合,完成吻合后用甲硝唑溶液5 ml冲洗腹腔后关腹],手术14只,存活8周6只,存活率42.9%。
1.4检测方法
1.4.1大鼠血清总胆固醇、甘油三酯、游离脂肪酸、尿素氮和肌酐的测定分别于术前及术后4周获取大鼠眶静脉血,采用全自动生化分析仪测定各组大鼠甘油三酯(trigly ceride,TG)、总胆固醇(total cholesterol,TC)、游离脂肪酸(free fatty acid,FFA)、尿素氮(Bun)和肌酐(Cr),ELISA法测定FFA。
1.4.2口服糖耐量试验术前及术后1、2和4周,禁食12 h后,50%葡萄糖灌胃1.5 g/kg,取大鼠尾尖血分别测定给葡萄糖后0、0.5、1和2 h的血糖值,用梯形法计算血糖浓度-时间曲线下面积(area under the curve,AUC)。AUC=0.25×(0 h血糖浓度+4× 0.5 h血糖浓度+3×2 h血糖浓度)。
1.4.3大鼠血清Insulin测定术前及术后1、2和4周,获取大鼠眶静脉血,采用放射免疫法测定各组大鼠各时间点空腹血胰岛素水平。
1.4.4计算胰岛素敏感指数(insulin sensitivity index,ISI)ISI=1/(空腹血糖×空腹胰岛素),分析时取其自然对数值,即ISI=In(空腹血糖×空腹胰岛素)-1。
1.4.5实时荧光定量-聚合酶链反应(RT-PCR)法检测肾脏皮质PEPCK、G-6-P mRNA的相对表达水平采用Trizol法提取肾脏皮质总RNA,严格按照试剂说明书进行操作。用Thermo Nano Drop 2000分光光度仪检测RNA的含量和纯度,取A260/A280在1.8~2.1之间的RNA进行实验。引物由上海生物工程公司合成,为相对定量检测mRNA表达量,用β-actin作为内参(引物序列见表1)。采用一步法逆转录荧光定量PCR试剂盒(TaKaRa R0086A)配制25μl体系,BIO-RAD C1000进行目标序列扩增,用2-△△Ct法分析PEPCK、G-6-P mRNA的水平变化。

表1 PCR引物序列及反应条件
1.4.6Western blot检测肾脏皮质InR-α和InR-β的蛋白表达参照南京凯基全蛋白提取试剂盒说明提取肾脏皮质总蛋白,采用BCA法进行总蛋白定量,取80μg总蛋白经SDS-PAGE电泳分离蛋白,将蛋白转印至PVDF膜上,用含5%脱脂奶粉的TBST室温封闭1 h,封闭后分别加入兔抗InR-α多克隆抗体和兔抗InR-β多克隆抗体(1∶200),4℃杂交过夜。洗膜后用辣根过氧化物酶标记的山羊抗兔IgG(1∶1 000)室温下二抗杂交1 h,洗膜后用ECL化学发光试剂显色,暗室曝光成像,应用UVP Bio Spectrum 410 Imaging System分析密度并计算。
1.5统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多样本之间的比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠TC、TG、FFA的检测结果
术前与正常对照组比较,糖尿病模型组TC、TG、FFA均有明显升高(P<0.05);术后4周,手术组大鼠较糖尿病模型组和假手术组,TC、TG、FFA均有不同程度降低,差异有统计学意义(P<0.05),表明手术能不同程度降低糖尿病大鼠的血脂。见表2。
2.2各组大鼠尿素氮和肌酐的检测结果
与正常对照组比较,术后4周糖尿病模型组和假手术组血清Bun、Cr有不同程度升高,肾脏功能受到一定程度损伤,差异有统计学意义(P<0.05);手术组术后4周血清Bun、Cr水平与糖尿病模型组和假手术组比较均有一定程度降低,血清Bun差异有统计学意义(P<0.05),血清Cr差异不明显(P>0.05)。见表3。
2.3 各组大鼠OGTT试验的检测结果
术前糖尿病模型组空腹血糖及OGTT 2 h血糖均显著高于正常对照组(P<0.05);术后手术组空腹血糖及OGTT 2 h血糖呈明显下降趋势,术后4周其血糖值显著低于糖尿病模型组和假手术组(P<0.05),表明手术能快速的降低糖尿病大鼠空腹和OGTT 2 h血糖含量,具有显著的降血糖作用。见表4。
表2 各组大鼠血脂相关指标的检测结果(mmol/L±s)
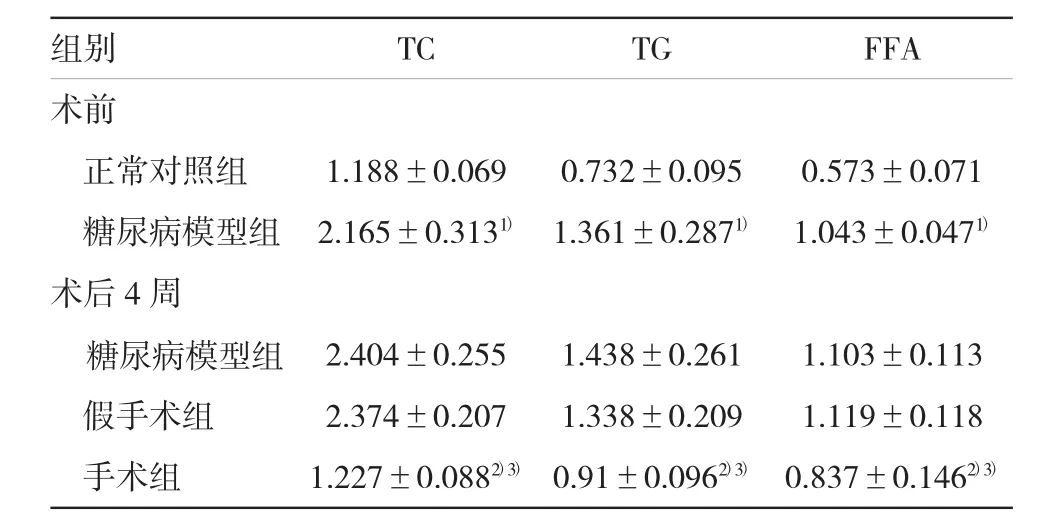
表2 各组大鼠血脂相关指标的检测结果(mmol/L±s)
注:1)与正常对照组比较,P<0.05;2)与糖尿病模型组比较,P<0.05;3)与假手术组比较,P<0.05
组别TCTGFFA术前正常对照组1.188±0.0690.732±0.0950.573±0.071糖尿病模型组2.165±0.3131)1.361±0.2871)1.043±0.0471)术后4周糖尿病模型组2.404±0.2551.438±0.2611.103±0.113假手术组2.374±0.2071.338±0.2091.119±0.118手术组1.227±0.0882)3)0.91±0.0962)3)0.837±0.1462)3)
表3 各组大鼠血清尿素氮和肌酐的检测结果(±s)
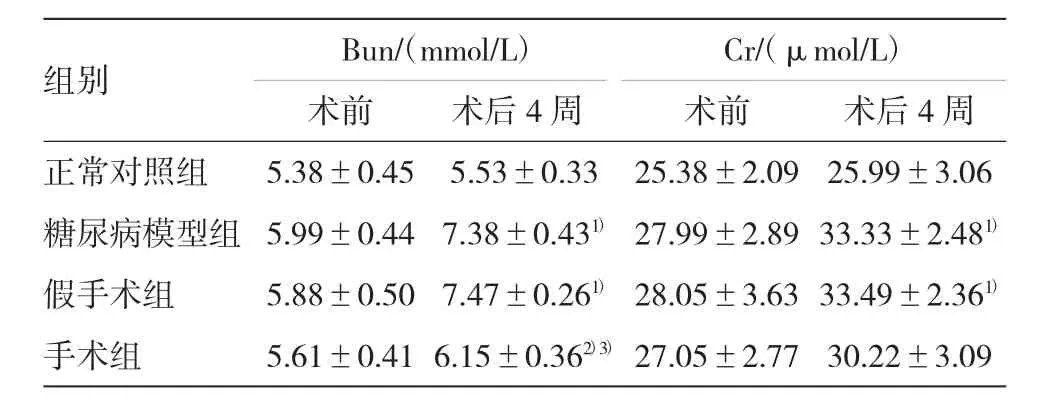
表3 各组大鼠血清尿素氮和肌酐的检测结果(±s)
注:1)与正常对照组比较,P<0.05;2)与糖尿病模型组比较,P<0.05;3)与假手术组比较,P<0.05
组别Bun/(mmol/L)Cr/(μmol/L)术前术前术后4周正常对照组5.38±0.455.53±0.3325.38±2.0925.99±3.06糖尿病模型组5.99±0.447.38±0.431)27.99±2.89 33.33±2.481)假手术组5.88±0.507.47±0.261)28.05±3.63 33.49±2.361)手术组5.61±0.41 6.15±0.362)3)27.05±2.7730.22±3.09术后4周
表4 各组大鼠OGTT试验的检测结果(mmol/L±s)
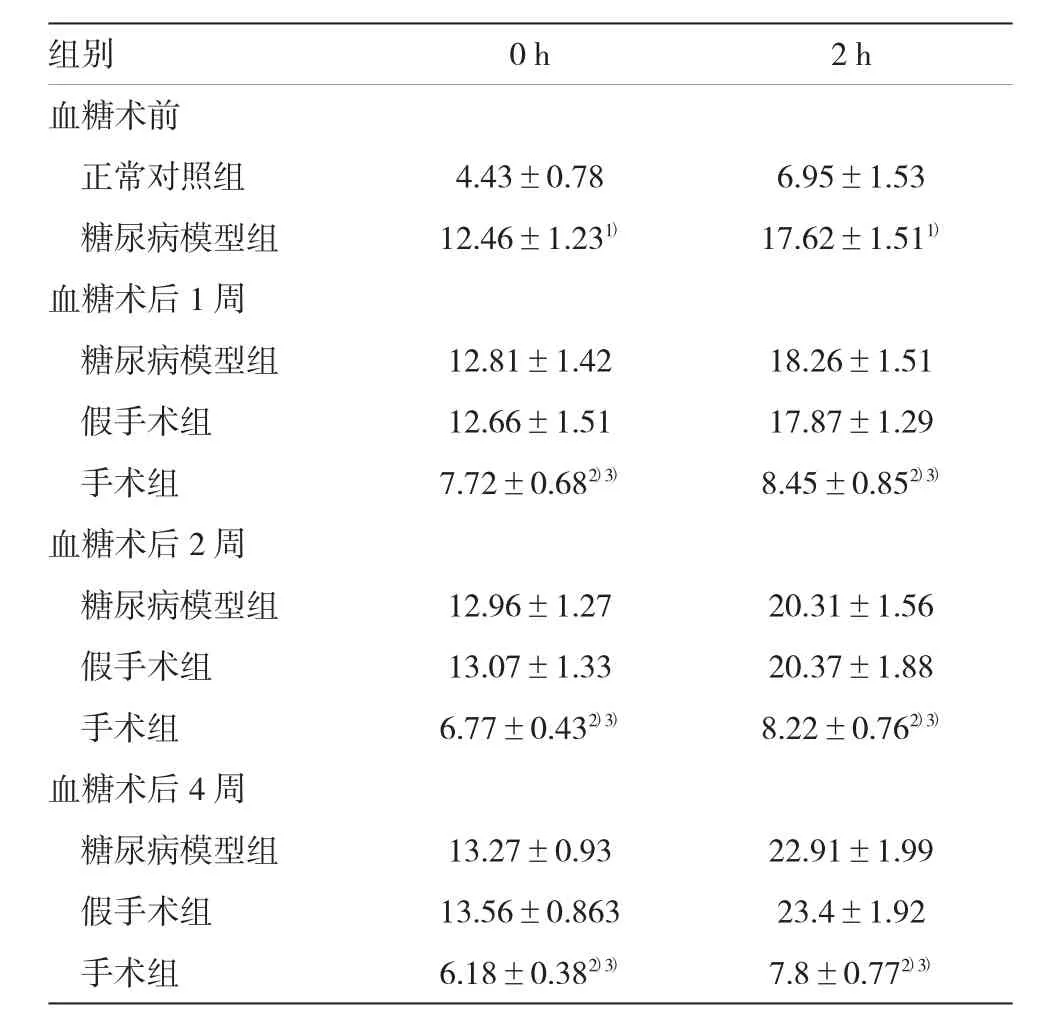
表4 各组大鼠OGTT试验的检测结果(mmol/L±s)
注:1)与正常对照组比较,P<0.05;2)与糖尿病模型组比较,P<0.05;3)与假手术组比较,P<0.05
组别0 h2 h血糖术前正常对照组4.43±0.786.95±1.53糖尿病模型组12.46±1.231)17.62±1.511)血糖术后1周糖尿病模型组12.81±1.4218.26±1.51假手术组12.66±1.5117.87±1.29手术组7.72±0.682)3)8.45±0.852)3)血糖术后2周糖尿病模型组12.96±1.2720.31±1.56假手术组13.07±1.3320.37±1.88手术组6.77±0.432)3)8.22±0.762)3)血糖术后4周糖尿病模型组13.27±0.9322.91±1.99假手术组13.56±0.86323.4±1.92手术组6.18±0.382)3)7.8±0.772)3)
2.4各组大鼠葡萄糖曲线下面积AUC的检测结果
如表5所示,糖尿病模型组葡萄糖曲线下面积显著高于正常组(P<0.05),表明模型组大鼠糖耐量严重受损;术后,手术组AUC较糖尿病模型组和假手术组显著降低(P<0.05),表明手术能显著提高糖尿病大鼠的糖耐量。见表5。
表5 各组大鼠AUC的检测结果[mmol/(h·L)±s]
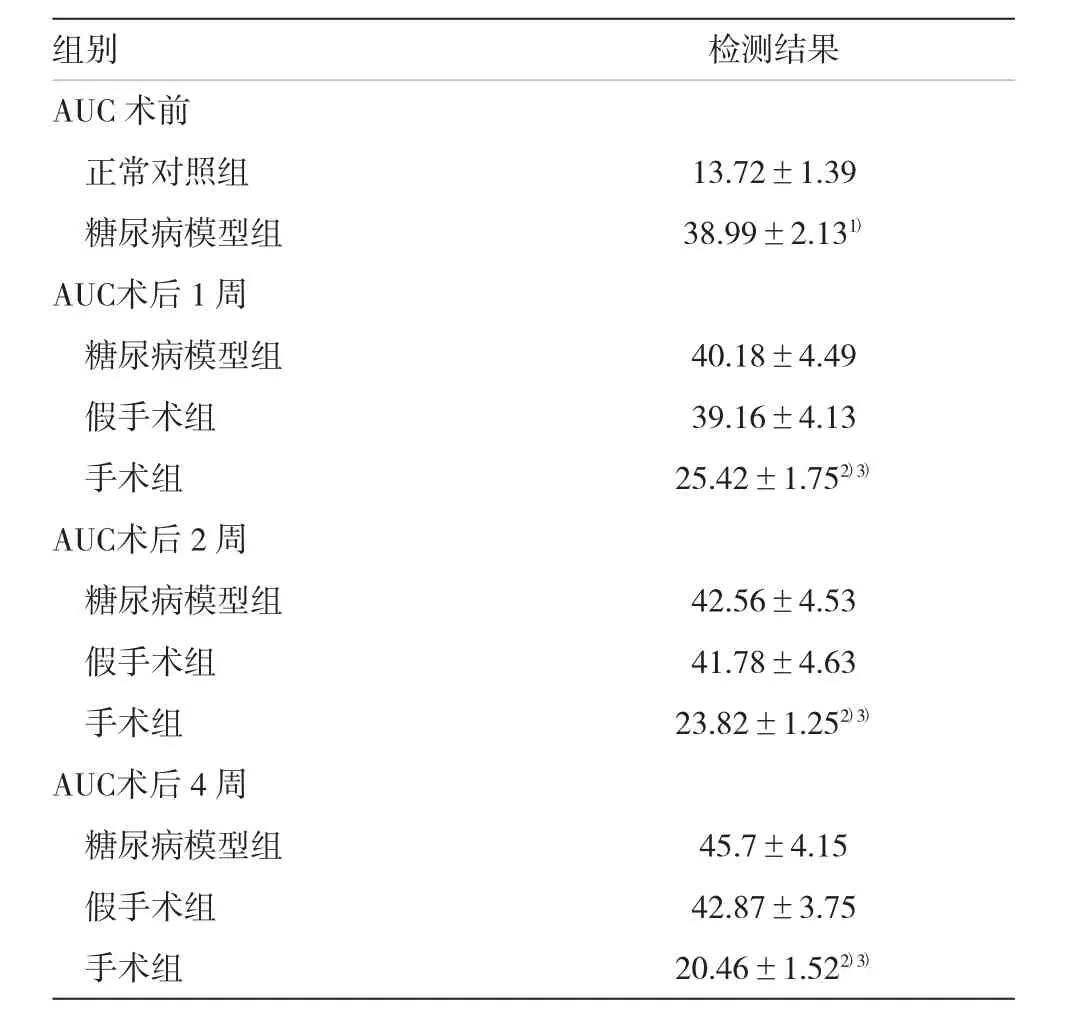
表5 各组大鼠AUC的检测结果[mmol/(h·L)±s]
注:1)与正常对照组比较,P<0.05;2)与糖尿病模型组比较,P<0.05;3)与假手术组比较,P<0.05
组别检测结果AUC术前正常对照组13.72±1.39糖尿病模型组38.99±2.131)AUC术后1周糖尿病模型组40.18±4.49假手术组39.16±4.13手术组25.42±1.752)3)AUC术后2周糖尿病模型组42.56±4.53假手术组41.78±4.63手术组23.82±1.252)3)AUC术后4周糖尿病模型组假手术组45.7±4.15 42.87±3.75手术组20.46±1.522)3)
2.5各组大鼠空腹胰岛素和胰岛素敏感性的检测结果
术前糖尿病模型组空腹胰岛素水平较正常组稍高,但差异无统计学意义(P>0.05);糖尿病模型组胰岛素敏感性较正常组明显降低,差异有统计学意义(P<0.05);术后1周,手术组较糖尿病模型组和假手术组胰岛素敏感性明显升高,空腹胰岛素水平降低,差异有统计学意义(P<0.05),手术效果一直维持到术后4周,表明手术能显著改善糖尿病大鼠的胰岛素敏感性。见表6。
2.6各组大鼠肾脏皮质PEPCK、G-6-P mRNA相对表达的检测结果
手术后4周,糖尿病模型组及假手术组大鼠肾脏皮质PEPCK、G-6-P mRNA的相对表达明显高于正常对照组大鼠(P<0.05),分别增高近6倍和4倍;手
术组大鼠肾脏皮质PEPCK、G-6-P mRNA的相对表达较糖尿病模型组及假手术组均有不同程度降低,尤以G-6-P降低明显,差异有统计学意义(P<0.05)。见表7和图1。
表6 各组大鼠空腹胰岛素和胰岛素敏感性的检测结果(±s)
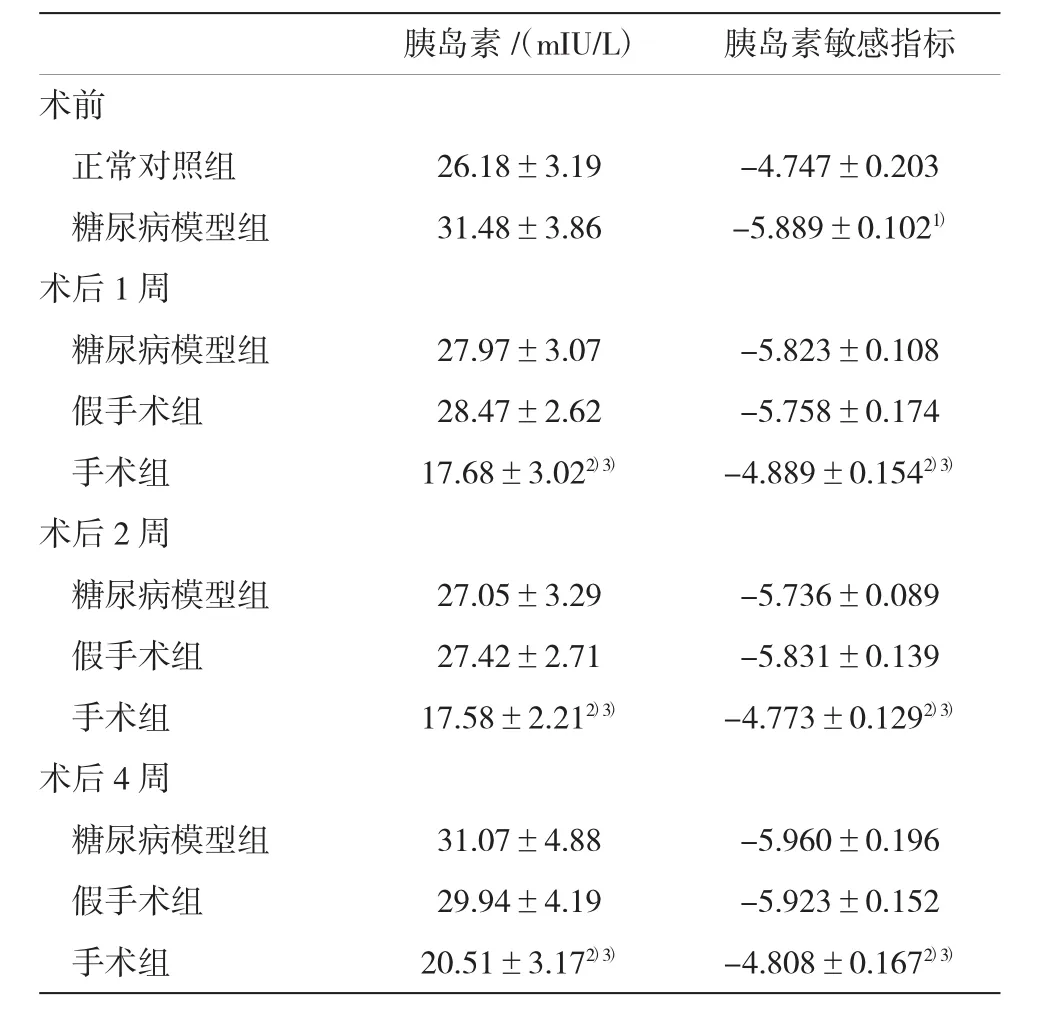
表6 各组大鼠空腹胰岛素和胰岛素敏感性的检测结果(±s)
注:1)与正常对照组比较,P<0.05;2)与糖尿病模型组比较,P<0.05;3)与假手术组比较,P<0.05
胰岛素/(mIU/L)胰岛素敏感指标术前正常对照组26.18±3.19-4.747±0.203糖尿病模型组31.48±3.86-5.889±0.1021)术后1周糖尿病模型组27.97±3.07-5.823±0.108假手术组28.47±2.62-5.758±0.174手术组17.68±3.022)3)-4.889±0.1542)3)术后2周糖尿病模型组27.05±3.29-5.736±0.089假手术组27.42±2.71-5.831±0.139手术组17.58±2.212)3)-4.773±0.1292)3)术后4周糖尿病模型组31.07±4.88-5.960±0.196假手术组29.94±4.19-5.923±0.152手术组20.51±3.172)3)-4.808±0.1672)3)
表7 各组大鼠肾脏皮质PEPCK和G-6-P mRNA表达的比较(±s)
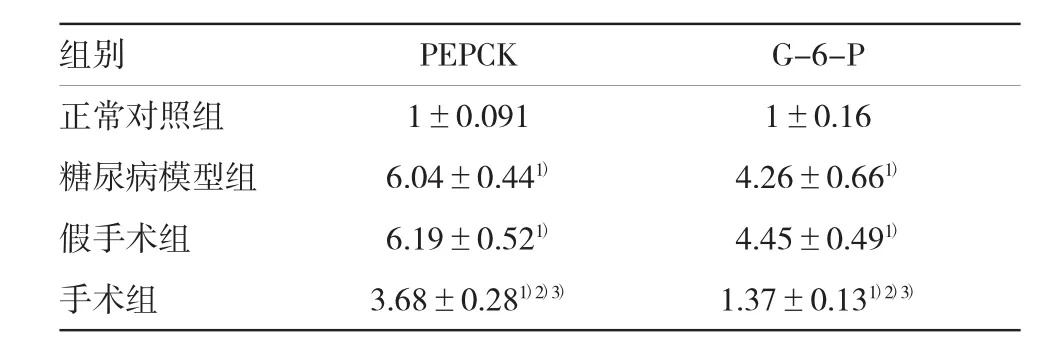
表7 各组大鼠肾脏皮质PEPCK和G-6-P mRNA表达的比较(±s)
注:1)与正常对照组比较,P<0.05;2)与糖尿病模型组比较,P<0.05;3)与假手术组比较,P<0.05
组别PEPCKG-6-P正常对照组1±0.0911±0.16糖尿病模型组6.04±0.441)4.26±0.661)假手术组6.19±0.521)4.45±0.491)手术组3.68±0.281)2)3)1.37±0.131)2)3)
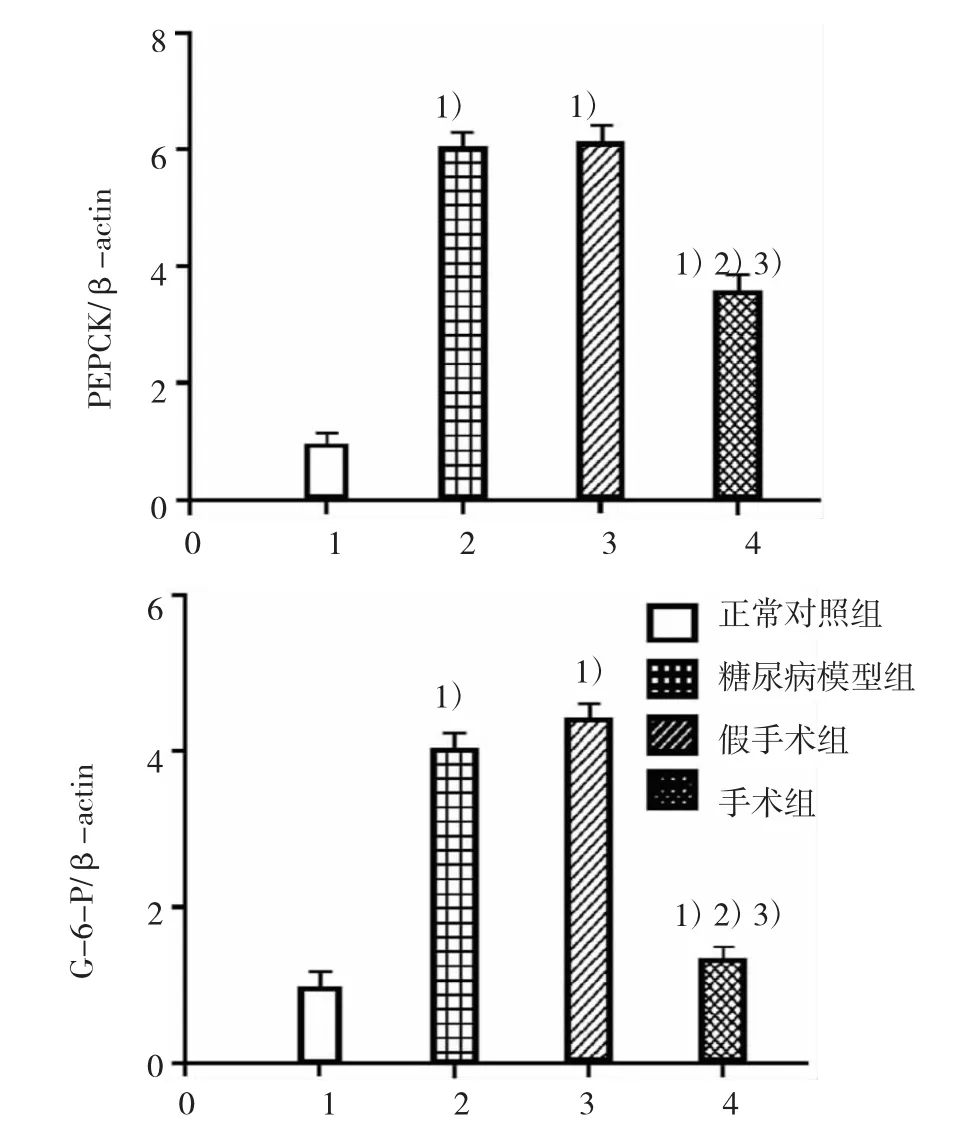
图1 各组大鼠肾脏皮质PEPCK和G-6-P mRNA表达的比较
2.7各组大鼠肾脏皮质InR-α和InR-β蛋白表达的检测结果
手术后4周,糖尿病模型组及假手术组大鼠肾脏皮质InR-α的蛋白表达低于正常对照组大鼠(P<0.05),表明糖尿病大鼠肾脏存在胰岛素抵抗,手术组大鼠肾脏皮质InR-α的蛋白表达较糖尿病模型组及假手术组有一定程度升高(P<0.05),而InR-β的蛋白表达在各组间差异无统计学意义(P>0.05)。见图2。

图2 各组大鼠肾脏皮质InR-α和InR-β蛋白表达的比较
3 讨论
2型糖尿病是目前一种常见病和多发病,其病理生理特点主要是以胰岛素抵抗为主伴或不伴胰岛素分泌的相对不足。胰岛素抵抗使人体器官和组织对胰岛素敏感性低,导致机体对糖利用减少,内源性糖生成增多。当前以饮食控制和口服降糖药物的治疗方式虽然能在短期内减轻约5%体质量,且较为有效的控制血糖,但长期效果并不理想[4]。而以Roux-en-Y胃旁路术为代表的减重手术对代谢综合征及2型糖尿病患者取得了意想不到的治疗效果。Roux-en-Y胃旁路术是目前治疗2型糖尿病的新手段和主要手术方法,其临床治疗有效率高达80%以上[5]。长期随访调查显示胃旁路术后患者血糖控制稳定,胰岛素分泌绝对值增加,且患者血脂、血压等都有一定程度改善,降低了糖尿病并发症的危险因素及发病率,是一种理想的治疗糖尿病的方式[6]。本实验也证实,术后4周,糖尿病大鼠空腹及OGTT 2 h血糖明显降低,胰岛素敏感指数升高,一定程度上改善了受损的糖耐量。此外临床研究还显示胃转流术后能够显著改善2型糖尿病患者胰岛素抵抗,提高机体对胰岛素的敏感性和反应性。动物实验也表明手术后能够上调糖尿病动物肝脏和骨骼肌的胰岛素信号通路,提高胰岛素受体及其底物的蛋白表达和磷酸化水平[7],增加上述器官组织对糖的利用和贮存,减少内源性糖的产生,从而降低血糖。
近年来胰岛素受体及其下游信号通路对肾脏功能的重要作用也逐渐得到阐述,糖尿病状态时肾脏胰岛素受体的表达也会发生变化,产生胰岛素抵抗[8]。本实验也发现糖尿病大鼠肾脏InR-α的表达明显低于正常组大鼠,表明该模型糖尿病大鼠肾脏存在胰岛素抵抗现象,与SWASTI等[9]的研究结果一致。胰岛素受体属于受体酪氨酸激酶家族(receptor tyrosine kinases,RTK),是一个四聚体,由2个α亚基和2个β亚基通过二硫键连接,2个α亚基位于细胞质膜的外侧,其上有胰岛素的结合位点;2个β亚基是跨膜蛋白,起信号转导作用[10]。肾脏肾小球内足细胞、系膜细胞、内皮细胞以及整个肾小管上皮细胞都有胰岛素受体表达。同肝脏、骨骼肌一样,肾脏也是受胰岛素调控的靶器官,胰岛素受体对于肾小球和肾小管的功能至关重要,当发生胰岛素抵抗时,胰岛素受体下游信号通路传导发生障碍会引起肾脏功能损害以及相关并发症的发生,如蛋白尿和高血压等[11]。足细胞是一类胰岛素敏感细胞,胰岛素受体对足细胞的功能有重要作用,敲除足细胞上胰岛素受体的表达后会产生一系列糖尿病肾病的特征性改变。最近的研究数据显示,雷帕霉素在足细胞内营养传感及蛋白质生物合成中的作用可能是受到胰岛素受体的调控[11]。肾小管上皮细胞对钠的排泄是受到胰岛素受体的调控,肾小球内胰岛素受体表达的变化也会影响肾小球率过滤,进而影响对血压的控制[11]。本实验术后4周的检测结果发现糖尿病模型组大鼠血清Bun和Cr的水平升高,肾脏功能出现一定程度损害,推测可能和肾脏胰岛素抵抗也有一定关系。另外,肾脏具有在各种生理和病理条件下产生和释放糖的能力,肾脏对血糖稳态的重要作用已经得到公认。除了肝脏,肾脏皮质也含有大量糖异生相关的酶,且肾脏是唯一能够通过糖异生产生足够多的糖并释放进入血液循环的器官[12]。研究表明,2型糖尿病患者内源性糖的产生增加近300%,肝糖的释放和肾糖的释放各占一半,糖尿病患者与非糖尿病患者相比,其肾糖的释放增加近3倍,与此相比,糖尿病患者肝糖的释放只增加30%[13]。因此本实验检测糖异生关键酶G-6-P和PEPCK的mRNA表达,结果发现较正常对照组大鼠,糖尿病大鼠肾脏糖异生关键酶G-6-P和PEPCK的mRNA表达明显增高,肾脏糖异生增强。而手术后大鼠G-6-P和PEPCK的mRNA表达较糖尿病大鼠均有一定程度降低,肾脏糖异生减弱。有研究报道胰岛素可以通过下调糖异生关键酶基因的表达而对糖异生起到负性调节作用[14],抑制肝脏和肾脏内源性糖的产生[15],因此肾糖输出的减少可能主要和胰岛素的作用有关。相关的是胰岛素发挥作用需要与其特异性的酪氨酸激酶受体结合,进而激活下游信号分子对糖异生关键酶基因及蛋白的表达起到调控作用。该结果表明,肾脏皮质胰岛素受体的表达与肾脏糖异生的调控似乎有着密切的联系。本实验的结果显示,糖尿病大鼠肾脏皮质InR-α的表达降低,而手术后大鼠肾脏皮质InR-α的表达明显上调,表明肾脏胰岛素抵抗得到一定改善。因此,本研究推测手术组大鼠肾脏糖异生的减弱可能与其术后胰岛素敏感性增加和肾脏胰岛素抵抗改善有关。最后,胃旁路术后诸多胃肠道激素及脂肪因子的分泌也会发生改变[16],是否有其他的因素在其中产生作用和影响都仍需要实验研究去进一步证实。
综上所述,Roux-en-Y胃旁路术能迅速降低糖
尿病大鼠血糖,改善受损糖耐量和肾脏胰岛素抵抗,减弱肾脏糖异生,对延缓糖尿病状态下肾脏功能的持续损害及减少肾糖输出有着积极的意义,其机制可能和术后上调InR-α的蛋白表达以及下调PEPCK和G-6-P的基因表达有关。
[1]TUNER RC,CULL CA,FRIGHI V.Glycemic control with diet, sulphonylurea,metformin,or insulin in patients with type 2 diabetesmellitus:progressiverequirementformultipletherapies (UKPDS 49).UK Prospective Diabetes Study(UKPDS)Group[J]. JAMA,1999,281(21):2005-2012.
[2]汤礼军,陈涛,崔建峰,等.胃旁路术治疗非肥胖型2型糖尿病的近期疗效[J].中华消化外科杂志,2011,10(3):214-216.
[3]HALE LJ,COWARD RJ.Insulin signaling to the kidney in health and disease[J].Clin Sci(Lond),2013,124(6):351-370.
[4]LONEY-HUTCHINSON LM,PROVILUS AD,JEAN-LOUIS G, et al.Group visits in the management of diabetes and hypertension:effect on glycemic and blood pressure control[J].Curr Diab Rep,2009,9(3):238-242.
[5]HONGTAO YAN,LIJUN TANG,TAO CHEN.Defining and predicting complete remission of type 2 diabetes:a short-term efficacy study of open gastric bypass[J].Obesity facts,2013,6(2): 176-184.
[6]RUBINO F,SCHAUER PR,KAPLAN LM,et al.Metabolic surgery to treat type 2 diabetes:clinical outcomes and mechanisms of action[J].Annual Rev Med,2010,61:393-411.
[7]SANDRA BONHOMME,ANA GUIJARRO,STEFAN KESLACY, et al.Gastric bypass up-regulates insulin signaling pathway[J]. Nutrition,2011,27(1):73-80.
[8]GATICA R,BERTINAT R,SILVA P,et al.Altered expression and localization of insulin receptor in proximal tubule cells from human and rat diabetickidney[J].J Cell Biochem,2013,114(3): 639-649.
[9]SWASTI TIWARI,VEERENDRA K.M.HALAGAPPA,et al.Reduced expression ofinsulinreceptors inthe kidneys ofinsulin-resistant rats[J].J Am Soc Nephrol,2007,18(10):2661-2671.
[10]LEE J,PILCH PF.The insulin receptor:structure,function,and signaling[J].Am J Physiol,1994,266(2 Pt 1):C319-334.
[11]HALE LJ,COWARD RJ.The insulin receptor and the kidney [J].Curr Opin Nephrol Hypertens,2013,22(1):100-6
[12]GERICH JE,MEYER C,WOERLE HJ,et al.Renal gluconeogenesis:its importance in human glucose homeostasis[J].Diabetes Care,2001,24(2):382-391.
[13]MEYER C,WOERLE HJ,DOSTOU JM,et al.Abnormal renal, hepatic,and muscle glucose metabolism following glucose ingestion in type 2 diabetes[J].Am J Physiol Endocrinol Metab, 2004,287(6):E1049-E1056.
[14]DEFRONZO RA,DAVIDSON JA,DEL PRATO S.The role of the kidneys in glucose homeostasis:a new path towards normalizing glycaemia[J].Diabetes Obes Metab,2012,14(1):5-14.
[15]PILLOT B,SOTY M,GAUTIER-STEIN A,et al.Protein feeding promotes redistribution of endogenous glucose production to the kidney and potentiates its suppression by insulin[J].Endocrinology,2009,150(2):616-624.
[16]KOSHY AA,BOBE AM,BRADY MJ.Potential mechanisms by which bariatric surgery improves systemic metabolism[J].Transl Res,2013,161(2):63-72.
(张蕾 编辑)
Effect of Roux-en-Y gastric bypass surgery on renal insulin receptor expression in type 2 diabetes mellitus rats and its significance*
Yi WEN1,Qiao QI2,Li FENG1,Shao-hua ZHANG1,Zhen-yu CHEN1,Li-jun TANG1
(1.Department of General Surgery,General Hospital of Chengdu Military Command,Chengdu, Sichuan 610083,P.R.China;2.Outpatient Department,95879 Troops of the PLA, Chengdu,Sichuan 610083,P.R.China)
【Objective】To investigate the effect of Roux-en-Y gastric bypass surgery on renal expression of insulin receptor(InR)in type 2 diabetes mellitus rats and explore its possible hypoglycemic mechanism.【Methods】Diabetes mellitus animal model was induced by intraperitoneal injection of Streptozotocin(STZ,35 mg/kg)and a high-fat diet.Diabetic rats were randomly divided into three groups:diabetes model group(DM
gastric bypass surgery;diabetes mellitus;kidney;insulin resistance;gluconeogenesis
R656.6;R587.1
A
1005-8982(2015)27-0001-07
2015-03-26
全军临床高新技术重大项目(No:2010gxjs040)
汤礼军,E-mail:whjtlj1251@163.com,Tel:13258198900
group,n=8),sham Roux-en-Y gastric bypass group(SRYGB group,n=8)and Roux-en-Y gastric bypass group(RYGB group,n=14).And 8 normal SD rats were used as the normal control group(NC group).Plasma TG,TC,FFA,Bun and Cr were measured before and in the 4th week after operation in each group.Fasting insulin was measured,oral glucose tolerance test(OGTT)was taken,and the area under the curve of blood glucose concentration-time and insulin sensitivity were calculated before and in the 1st,2nd and 4th week after operation.The relative expressions of the key enzymes of renal gluconeogenesis i.e.G-6-P and phosphoenolpyruvate carboxykinase(PEPCK)mRNA were detected using real-time fluorescence quantitative polymerase chain reaction(RT-PCR)and the expressions of renal InR-α and InR-β proteins were detected using Western blot in the 4th week after operation in each group.【Results】In the 4th week after surgery compared with the DM group and the SRYGB group,the levels of blood lipid and serum Bun were reduced in the RYGB group(P<0.05),the fasting blood glucose and 2-h glucose after OGTT were significantly decreased(P<0.05),the area under the curve of blood glucose concentration-time was reduced(P<0.05),the insulin sensitivity was increased(P<0.05),the relative expressions of G-6-P and PEPCK mRNA were decreased(P<0.05)and the expression of InR-α protein was increased to some degree(P<0.05).【Conclusions】Roux-en-Y gastric bypass surgery can significantly reduce blood glucose in diabetic rats,increase insulin sensitivity,improve renal insulin resistance and weaken renal gluconeogenesis.Its mechanism may be related to the increase of InR-α protein expression and the decrease of G-6-P and PEPCK mRNA levels in renal tissue.

