布地奈德对哮喘小鼠气道上皮细胞闭锁蛋白表达的影响*
游曼清,邓俊,梁宇佳,熊瑛,熊彬,王宋平
(1.四川省乐山市人民医院呼吸内科,四川 乐山 614000;2.泸州医学院附属医院呼吸一科,四川 泸州 646000)
·论著·
布地奈德对哮喘小鼠气道上皮细胞闭锁蛋白表达的影响*
游曼清1,邓俊2,梁宇佳2,熊瑛2,熊彬2,王宋平2
(1.四川省乐山市人民医院呼吸内科,四川 乐山 614000;2.泸州医学院附属医院呼吸一科,四川 泸州 646000)
目的观察哮喘小鼠气道上皮细胞闭锁蛋白的表达及布地奈德对其表达的影响。方法将24只雌性BALB/c小鼠随机分为哮喘模型组、布地奈德组及对照组,每组8只。对照组用生理盐水,哮喘模型组和布地奈德组用卵清蛋白腹腔注射致敏及雾化吸入激发建立哮喘模型,布地奈德组每次激发前1 h吸入布地奈德混悬液1 mg,连续14 d。对照组和哮喘模型组用等量生理盐水代替布地奈德,吸入方法和时间同布地奈德组。小鼠末次激发24 h后,计数支气管肺泡灌洗液(BALF)中的嗜酸性粒细胞(EOS),HE和PAS染色观察支气管及周围肺组织的病理改变、杯状细胞增生和黏液分泌;电镜观察气道上皮的超微结构;免疫组织化学和荧光定量PCR检测气道上皮occludin的表达。结果与对照组比较,哮喘模型组小鼠BALF中EOS计数、气道上皮杯状细胞数及病理学评分明显增高;支气管肺组织occludin蛋白表达明显减弱,差异均有统计学意义(P<0.01)。与哮喘模型组比较,布地奈德组EOS和杯状细胞计数及病理学评分明显降低,occludin蛋白表达增强,差异均有统计学意义(P<0.01)。哮喘模型组气道上皮细胞间的连接结构不完整,细胞间隙增宽,而布地奈德组上述表现较哮喘组减轻。结论布地奈德能上调哮喘小鼠气道上皮occludin的表达、促进受损气道上皮的修复,可能是吸入型糖皮质激素治疗哮喘的机制之一。
布地奈德;哮喘;气道上皮细胞;紧密连接;闭锁蛋白
支气管哮喘(简称哮喘)是一种气道慢性炎症性疾病,其发病机制复杂,至今尚未完全阐明。近年来随着对哮喘研究的逐渐深入,人们认识到气道上皮细胞及其屏障功能受损可能在哮喘发病机制中起着重要作用[1-2]。气道上皮细胞之间的连接由紧密连接、黏附连接和缝隙连接共同组成,是气道上皮屏障的主要组成部分,其中较为重要的是紧密连接[3]。闭锁蛋白(occludin)是首先被发现的紧密连接相关蛋白,在细胞间紧密连接的形成中起着重要作用,但气道上皮occludin的表达变化与哮喘发病的关系尚缺乏深入研究[4]。雾化吸入糖皮质激素是目前治疗哮喘最有效的方法之一,而布地奈德是临床上普遍应用的吸入型激素。本研究旨在观察occludin在哮喘小鼠气道上皮的表达及吸入布地奈德对其表达的影响,探讨occludin在哮喘发病中的作用及吸入型糖皮质激素治疗哮喘的机制。
1 材料与方法
1.1材料
卵清蛋白(ovalbumin,OVA)、氢氧化铝干粉(Sigma公司),兔抗鼠occludin多克隆抗体(博奥森公司),HRP山羊抗兔二抗(康成生物公司),RNA提取试剂盒(Tiangen Biotech公司),引物合成(上海生物工程有限公司),DAB显色试剂盒(R&D公司),2×Taq PCR Master Mix试剂盒,Rea Master Mix(SYBR GreenⅠ)荧光定量试剂盒(Tiangen公司),SP试剂盒(武汉博士德生物工程有限公司)。
1.2方法
1.2.1动物分组及哮喘模型的制备将24只雌性BALB/c小鼠用随机数字表法分成哮喘组、布地奈德组及对照组,每组8只。哮喘组:0、7及14 d腹腔注射OVA+氢氧化铝的生理盐水混悬溶液0.2 ml(含OVA 20μg,氢氧化铝2 mg)致敏,第21天起给予1%OVA雾化激发30 min,1次/d,连续14 d。每次激发前1 h雾化吸入生理盐水2 ml。布地奈德组:致敏及激发同哮喘组,但每次激发前1 h雾化吸入布地奈德混悬液1 mg(2 ml)。对照组:用相同的方法以生理盐水代替OVA进行致敏和激发。
1.2.2支气管肺泡灌洗液(BALF)嗜酸性粒细胞计数小鼠末次激发24 h后腹腔注射1%戊巴比妥钠0.2 ml麻醉,剖开胸腔,结扎右侧主支气管,以1 ml生理盐水灌洗左肺,每只小鼠重复灌洗3次,收集灌洗液离心,取细胞悬液涂片、染色,在光学显微镜下计数嗜酸性粒细胞(eosinophies,EOS)。
1.2.3支气管肺组织HE与PAS染色取右上肺组织于4%多聚甲醛溶液固定,常规脱水、透明、浸蜡、包埋、切片,厚度5μm。HE染色光镜下观察支气管及其周围组织的病理改变,PAS染色观察气道黏膜上皮层杯状细胞增生和黏液分泌情况。气道上皮杯状细胞增生评分标准参照文献[5],在400倍光镜下每只小鼠随机选择10个气道,计数PAS染色阳性的杯状细胞积分(无杯状细胞为0分,<25%为1分,25%~50%为2分,50%~75%为3分,≥75%为4分),所有杯状细胞积分取平均值。
1.2.4电镜观察气道上皮超微结构取右肺中叶切成1 mm×1 mm×1 mm大小置于装有25%戊二醛的EP管中固定,磷酸缓冲液漂洗,1%锇酸固定,蒸馏水漂洗,脱水,1∶1的包埋液+丙酮常温渗透,100%包埋液渗透,包埋,沉降,聚合,切片,厚度60 nm,行镜检。
1.2.5免疫组织化学方法检测occludin的表达取右下肺组织用4%多聚甲醛溶液固定,制备3μm石
蜡切片,采用链霉菌抗生物素蛋白-过氧化物酶连结法(SP)行免疫组织化学染色,操作步骤按试剂盒说明书进行,兔抗小鼠occludin多克隆抗体以1∶400稀释。阳性染色为气道上皮细胞表面和细胞间的包膜上黄色或棕黄色染色,说明有occludin表达,同时设置阴性对照。图像用Motic Fluo 1.0软件分析,在相同放大倍数(×400)下,每张切片随机选6个气道视野,测定其光密度(optical density,OD)值。1.2.6实时荧光定量PCR检测肺组织occludin mRNA表达取右下肺组织,每份样品取约50 mg,充分研磨,加入1ml Trizol提取总RNA并合成cDNA,再PCR扩增。Occludin引物序列5'-AAGAGTACAT GGCTGCTGCT-3'为上游引物,5'-TTTGCCTCTGGA GAGAATTG-3'为下游引物,此对引物扩增出230 bp片段。以β-actin为内参照,上游引物为5'-AATGG GTCAGAAGGACTCCT-3',下游引物为5'-ACGGTTG GCCTTAGGGTTCAG-3',此对引物扩增出250 bp片段。反应条件(95℃2 min,95℃5 s,55.7℃20 s,72℃15 s,共40个循环,在循环第2步采集荧光)。反应结束后记录Ct值(基本循环数),算出ΔCt(基本循环与内参循环数差值)和ΔΔCt(最低样本ΔCt值-其他各样本ΔCt值),计算目的基因mRNA的相对表达量RQ值(occludin mRNA/β-actin mRNA即RQ值=2-ΔΔCt)。
1.3统计学方法
采用SPSS 11.5统计软件进行数据处理,计量资料用均数±标准差(±s)表示,每组样本均数经过方差齐性检验后,单因素方差分析用于组间比较,SNK检验用于组间两两之间的比较,P<0.05为差异有统计学意义。
2 结果
2.1BALF中EOS计数
与对照组EOS计数(0.750±0.707)比较,哮喘组EOS计数(20.875±1.808)显著增高,差异有统计学意义(P<0.01);布地奈德组EOS计数(10.625± 1.302)明显低于哮喘组,但仍高于对照组,差异均有统计学意义(P<0.01)。
2.2支气管肺组织HE染色结果
哮喘组小鼠气道上皮脱落不完整,气道黏膜层有大量炎症细胞浸润,黏液腺增生,黏膜下水肿,黏膜下层增宽,气道壁及气道平滑肌增厚,管腔狭窄,部分气道管腔内可见黏液栓;布地奈德组病理改变较哮喘组减轻;对照组未见上述病理改变。见图1。

图1 各组小鼠肺组织病理形态学变化(HE×200)
2.3PAS染色结果
哮喘组小鼠气道上皮PAS染色阳性的杯状细胞胞浆染成紫红色,细胞核为蓝色,可见大量杯状细胞增生,管腔内见大量染成紫红色的黏液;布地奈德组杯状细胞增生减少,管腔内见少量黏液;对照组未见明显杯状细胞增生和黏液分泌。与对照组杯状细胞积分(0.250±0.463)比较,哮喘组气道上皮PAS染色阳性的杯状细胞积分(3.375±0.744)明显增多,差异有统计学意义(P<0.01);布地奈德组杯状细胞积分(1.625±0.518)明显低于哮喘组,但仍高于对照组,差异均有统计学意义(P<0.01)。见图2。
2.4电镜观察气道上皮的超微结构
对照组小鼠气道上皮纤毛完整,无脱落,微绒毛较多,结构清晰,上皮细胞间的连接结构完整,细胞紧密排列,基底膜完整;哮喘组气道上皮纤毛明显脱落、变稀、变短,微绒毛减少,细胞顶端呈泡状膨大,
上皮细胞间的连接结构有松裂或缺失,细胞间隙增宽,基底膜不连续;布地奈德组上述表现较哮喘组减轻。见图3。
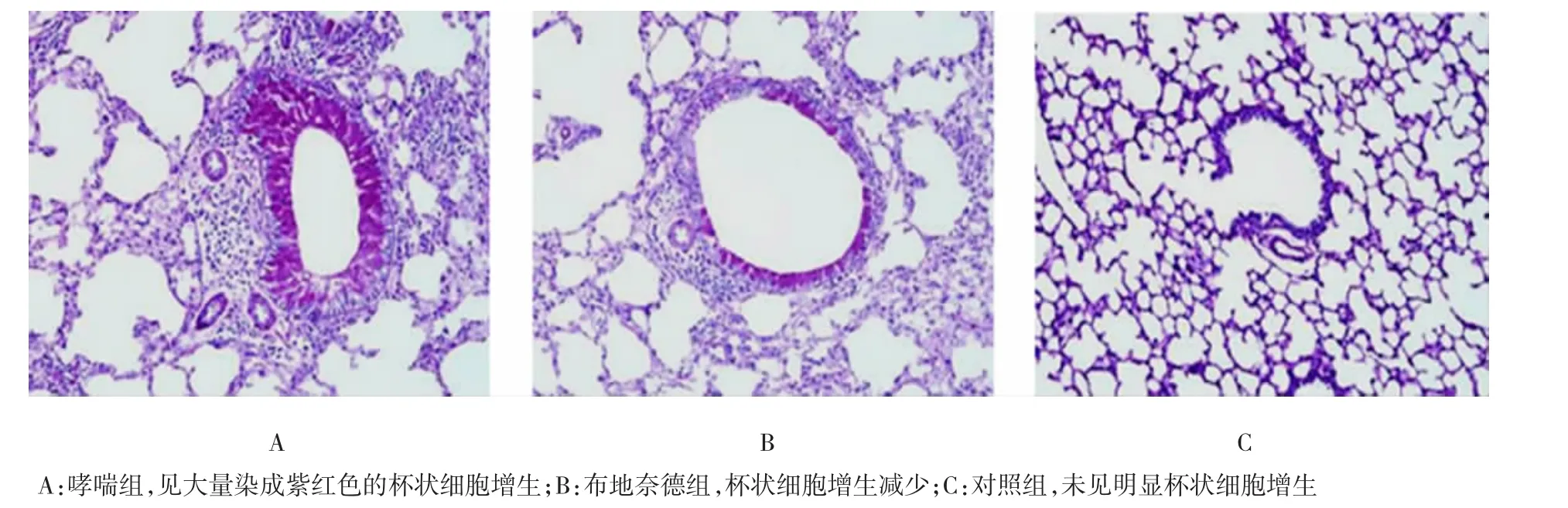
图2 各组小鼠肺组织PAS染色(PAS×200)
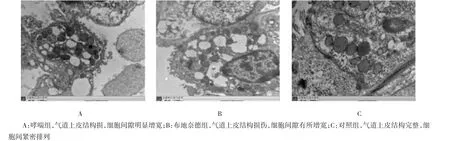
图3 各组小鼠气道上皮的超微结构(×12 000)
2.5免疫组织化学检测气道上皮occludin的表达
对照组小鼠气道上皮occludin主要在气道上皮细胞表面和细胞间的包膜上呈线性表达,阳性染色为黄色或棕黄色染色。布地奈德组小鼠气道上皮occludin表达较对照组明显减弱,但仍比哮喘组表达显著,见图4。哮喘组occludin的OD值(0.126± 0.032)低于对照组(0.652±0.313)及布地奈德组(0.337±0.028),差异均有统计学意义(P<0.01);与对照组比较,布地奈德组的OD值仍减小,差异有统计学意义(P<0.01)。
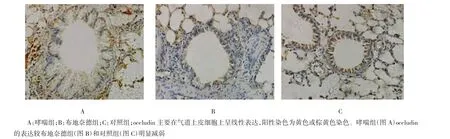
图4 各组小鼠气道occludin的表达(SP法×400)
2.6肺组织occludin mRNA的表达
目的基因的融解曲线为单峰曲线,融解温度均一,峰的形状较尖锐(见图5),表明无非特异性产物
及引物二聚体生成,引物特异性良好,退火温适中。各样品occludin mRNA的相对表达量(RQ值)见图6,3组小鼠occludin mRNA的RQ值分别为(7.200± 4.959)、(3.127±2.030)和(4.772±1.848),组间比较差异无统计学意义(F=1.960,P>0.05)。
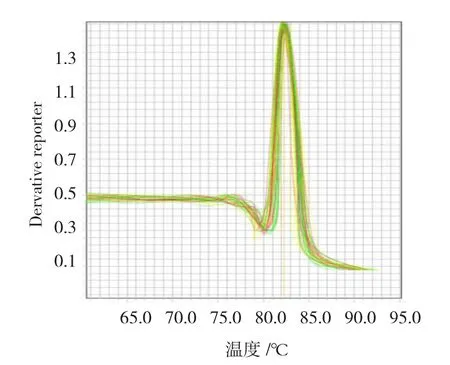
图5 目的基因的溶解曲线图
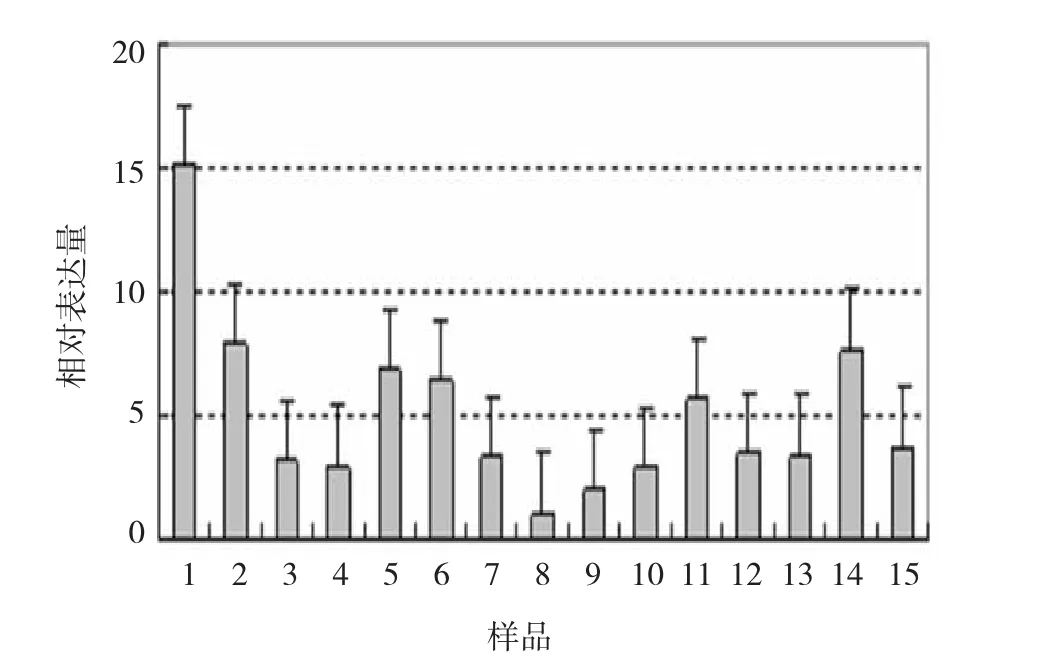
图6 各样品occludin mRNA的RQ值
3 讨论
气道上皮屏障是支气管肺组织抵御外界环境有害刺激的第一道屏障,由气道上皮表面液和上皮细胞及上皮细胞间的连接构成,紧密连接作为细胞间连接的主要形式,位于气道上皮细胞的顶端和细胞间的侧膜上,是维持气道上皮屏障功能正常的关键结构[6]。Occludin是第一个被发现的紧密连接相关蛋白,是紧密连结结构的主要功能调节蛋白,通过封闭细胞间隙,调节细胞旁渗透性[4]。气道上皮细胞通过细胞间的连接结构阻挡环境中的变应原、粉尘、病毒等入侵,而这层结构的缺陷可导致各种环境激发因子和炎症细胞更快速地通过气道上皮屏障[7]。本实验不仅观察到哮喘小鼠气道上皮有大量炎症细胞浸润,黏液腺增生,气道壁及气道平滑肌增厚,管腔狭窄等病理改变,而且通过电镜观察还发现哮喘小鼠气道上皮细胞间的连接结构有松裂、缺失,细胞间隙增宽,基底膜不连续的现象。DE等[8]研究也发现,哮喘患者的支气管活检组织中气道上皮紧密连接相关蛋白α连环素、ZO-1和E-钙黏蛋白的表达较非哮喘患者明显降低,气道上皮间的紧密连接结构有缺失,哮喘患者气道上皮屏障的缺失导致环境激发因子更加容易入侵和嗜酸性粒细胞在气道上皮的浸润。本实验不仅发现哮喘小鼠气道上皮紧密连接结构遭受破坏,还观察到哮喘组小鼠气道上皮细胞occludin蛋白表达较正常对照组明显减弱,但occludin mRNA表达在3组小鼠之间的差异无统计学意义。XIAO等[9]在哮喘患者气道上皮细胞occludin表达的研究中也得到同样的结果。这也许是occludin在哮喘小鼠或哮喘患者气道上皮表达的减少与蛋白的翻译有关,而与蛋白的转录无关。本研究结果提示,气道上皮屏障结构的破坏与occludin表达的降低可能是哮喘发病的病理基础之一。
布地奈德是目前临床上普遍用于治疗哮喘的吸入型糖皮质激素,能减轻气道炎症,有效治疗哮喘[10]。既往的研究表明,吸入糖皮质激素主要通过抑制EOS等炎症细胞在气道的募集和活性,抑制炎症介质的生成和释放,增强气道平滑肌细胞β2肾上腺素受体的反应性等机制发挥抗炎作用[11-12]。本研究结果也显示,雾化吸入布地奈德能抑制哮喘小鼠气道上皮EOS浸润、抑制杯状细胞增生和黏液腺分泌,减轻气道黏膜充血水肿等炎症反应。但糖皮质激素对哮喘气道上皮细胞间的连接结构及occludin的表达有何影响,至今尚不清楚。SEKIYAMA等[13]的研究观察地塞米松对体外培养的人气道上皮细胞屏障功能的影响,结果发现地塞米松能促进气道上皮细胞间紧密连接的形成,降低上皮细胞的通透性,改善气道上皮的屏障功能。本实验显示,雾化吸入布地奈德后,气道上皮细胞occludin的表达较哮喘组增加,差异有统计学意义(P<0.01)。电镜下观察到布地奈德组小鼠气道上皮细胞间紧密连接结构的破坏也较哮喘组减轻。提示布地奈德能上调哮喘小鼠气道上皮occludin的表达,促进气道上皮细胞间连接结构的修复,这也许是布地奈德治疗哮喘的另一药理机制。
综上所述,本研究结果表明,哮喘小鼠气道上皮屏障结构的不完整和occludin表达的降低,可能是哮喘发病和病情进展的机制之一,而布地奈德能上调气道上皮occludin的表达和促进受损气道上皮的修
复,该研究结果为临床上雾化吸入布地奈德治疗哮喘提供了新的理论依据。
[1]GEOR AS SN,REZAEE F.Epithelial barrier function:at the front line of asthma immunology and allergic airway inflammation [J].J Allergy Clin Immunol,2014,134(3):509-520.
[2]HEIJINK IH,NAWIJN MC,HACKETT TL.Airway epithelial barrier function regulates the pathogenesis of allergic asthma[J]. Clin Exp Allergy,2014,44(5):620-630.
[3]REZAEE F,GEORAS SN.Breaking barriers.New insights into airway epithelial barrier function in health and disease[J].Am J Respir Cell Mol Biol,2014,50(5):857-869.
[4]CUMMINS PM.Occludin:one protein,many forms[J].Mol Cell Biol,2012,32(2):242-250.
[5]KHAKZAD MR,MIRSADRAEE M,MOHAMMADPOUR A,et al.Effect of verapamil on bronchial goblet cells of asthma:an experimental study on sensitized animals[J].Pulm Pharmacol Ther, 2012,25(2):163-168.
[6]游曼清,王宋平.气道上皮屏障在哮喘防御机制中的研究进展[J].国际呼吸杂志,2013,33(17):1338-1342.
[7]PROUD D,LEIGH R.Epithelial cells and airway diseases[J]. Immunol Rev,2011,242(1):186-204.
[8]DE BW,SHARMA HS,BAELEMANS SM,et al.Altered expression of epithelial junctional proteins in atopic asthma:possible role in inflammation[J].Can J Physiol Pharmacol,2008,86(3): 105-112.
[9]XIAO C,PUDDICOMBE SM,FIELD S,et al.Defective epithelial barrier function in asthma[J].J Allergy Clin Immunol,2011, 128(3):549-556.
[10]CHIAN CF,TSAI CL,WU CP,et al.Five-day course of budesonide inhalation suspension is as effective as oral prednisolone in the treatment of mild to severe acute asthma exacerbations in adults[J].Pulm Pharmacol Ther,2011,24(2):256-260.
[11]SZEFLER SJ,CARLSSON LG,URYNIAK T,et al.Budesonide inhalation suspension versus montelukast in children aged 2 to 4 years with mild persistent asthma[J].J Allergy Clin Immunol Pract,2013,1(1):58-64.
[12]BEASLEYR,WEATHERALLM,SHIRTCLIFFEP,etal. Combination corticosteroid/β-agonist inhaler as reliever therapy: a solution for intermittent and mild asthma[J]J Allergy Clin Immunol,2014,133(1):39-41.
[13]SEKIYAMA A,GON Y,TERAKADO M,et al.Glucocorticoids enhance airway epithelial barrier integrity[J].Int Immunopharmacol,2012,12(2):350-357.
(张蕾 编辑)
Effect of Budesonide on expression of occludin in airway epithelium of asthmatic mice*
Man-qing YOU1,Jun DENG2,Yu-jia LIANG2,Ying XIONG2, Bin XIONG2,Song-ping WANG2
(1.Department of Respiratory Diseases,the People's Hospital of Leshan,Leshan,Sichuan 614000,P.R.China;2.Department of Respiratory Diseases,the Affiliated Hospital, Luzhou Medical College,Luzhou,Sichuan 646000,P.R.China)
【Objective】To observe the expression of occludin in airway epithelium of asthmatic mice and effect of Budesonide on its expression.【Methods】Totally 24 female BALB/c mice were randomly divided into asthma group,Budesonide group and control group with 8 mice in each group.Asthmatic mouse model was established by intraperitoneal injection and atomized inhalation of ovalbumin.Mice in the Budesonide group were treated with aerosolized Budesonide 1 mg each time 1 h before ovalbumin provocation for 14 consecutive days.Eosinophils(EOS)in BALF were counted.HE and PAS staining was used to observe the pathological
Budesonide;asthma;airway epithelium;tight junction;occludin
R562.25;R-332
A
1005-8982(2015)27-0008-06
2014-12-03
四川省卫生厅科研项目(No:110341)
王宋平,E-mail:wang4816@sina.com;Tel:0830-3165321
changes,goblet cell proliferation and mucus secretion in bronchial and lung tissues.The ultrastructure of airway epithelium was observed by electron microscope.The expression of occludin in airway epithelium was measured with immunohistochemical method and real-time PCR.【Results】Compared with the normal control group,the asthma group showed significant increases of EOS,goblet cells and mucus secretion,and a decrease of occludin protein expression in bronchial and lung tissues(P<0.01).However,the Budesonide group showed fewer EOS and goblet cells,less mucus secretion and higher expression of occludin protein in bronchial and lung tissues as compared with the asthma group(P<0.01).Electron microscope showed incomplete intercellular junction between airway epithelial cells in the asthma group,but Budesonide alleviated the above changes.【Conclusions】Budesonide could up-regulate the expression of occludin in airway epithelium of asthmatic mice,promote repair of damaged airway epithelial barrier,which might be a new mechanism of inhaled corticosteroids for treating asthma.

