脑缺血损伤后细胞外信号调节蛋白激酶1/2信号通路及胡黄连苷Ⅱ的干预作用
周广正,官亚东,张华,吕伟,付德利,翟丽
(青岛大学医学院中西医结合中心,山东 青岛 266021)
·论著·
脑缺血损伤后细胞外信号调节蛋白激酶1/2信号通路及胡黄连苷Ⅱ的干预作用
周广正,官亚东,张华,吕伟,付德利,翟丽
(青岛大学医学院中西医结合中心,山东 青岛 266021)
目的探讨胡黄连苷Ⅱ对脑缺血损伤后细胞外信号调节蛋白激酶1/2(ERK1/2)信号转导通路的影响。方法成年健康雄性Wistar大鼠90只,随机选择15只为对照组,其余75只应用线栓法建立大鼠脑缺血模型,经腹腔注射胡黄连苷Ⅱ20 mg/kg干预治疗为胡黄连苷组。将成功的60只动物模型随机分为模型组、治疗组、脂多糖(LPS)组及U0126组,每组15只。用改良神经功能缺损评分(mNSS)评价动物神经行为功能,原位末端标记法(TUNEL)检测细胞凋亡,Western blot检测ERK1/2表达水平。结果大鼠脑缺血损伤后出现神经行为功能障碍,皮质区神经细胞凋亡数量和pERK1/2蛋白表达较对照组明显增多(P<0.05)。胡黄连苷组和U0126组大鼠皮质区凋亡细胞与pERK1/2表达较模型组明显降低(P<0.05),LPS组大鼠凋亡细胞与pERK1/2表达水平较高,但后期pERK1/2表达水平有所下降,动物神经行为功能恢复。结论胡黄连苷Ⅱ可能通过降低ERK1/2磷酸化水平,抑制神经细胞凋亡。
胡黄连苷Ⅱ;脑缺血;凋亡;细胞外信号调节蛋白激酶1/2;大鼠
细胞外信号调节蛋白激酶1/2(extracellular signal-regulated kinase,ERK1/2)信号通路是丝裂原活化蛋白激酶通路的组成之一,介导细胞增殖、分化和凋亡等[1]。研究证实,脑缺血损伤可诱导神经细胞凋亡,ERK1/2通路的激活能够促进细胞的增殖、分化与修复,减轻神经细胞损伤[2]。研究证明,ERK1/2通路在脑缺血损伤中能够促进炎症反应及介导神经细胞凋亡[3]。ERK1/2通路抑制剂U0126可抑制脑缺血大鼠ERK1/2通路的激活,保护血脑屏障损伤,缓解脑水肿[4]。本课题组研究证明,胡黄连苷Ⅱ在脑缺血损伤的多个环节中发挥作用,具有抗氧化、抗炎、减轻脑水肿、抑制神经细胞凋亡、促进神经营养因子表达等神经保护作用[5-7]。本实验拟明确ERK1/2在脑缺血损伤后细胞凋亡中的作用,以及胡黄连Ⅱ对ERK1/2表达的影响。
1 材料与方法
1.1动物模型
成年健康雄性Wistar大鼠90只,体重220~250 g,无特定病原体级,青岛市药品检验所实验动物中心提供[SCXK(鲁)20100010]。随机选择15只为对照组,其余75只应用线栓法[8]经左侧颈外-颈内动脉插线建立大脑中动脉阻塞模型。动物术前禁食12 h,腹腔注射10%水合氯醛3 ml/kg麻醉动物,仰卧位固定、无菌操作。将术后2 h死亡的15只大鼠剔除,改良神经功能缺损评分(modified neurological severity score,mNSS)7~12分为模型成功的标志[9]。将成功的60只动物模型随机分为模型组、治疗组、脂多糖组及U0126组,每组15只。对照组动物除不插线进入颅内外,其余操作同实验组。
1.2干预措施
1.2.1胡黄连苷组将胡黄连苷Ⅱ(天津奎青有限公司)用生理盐水配制成1%溶液,在缺血后2 h腹腔注射20 mg/kg。
1.2.2脂多糖将炎症诱导剂脂多糖(lipopolysaccharide,LPS)(北京索莱宝科技有限公司)用生理盐水溶液配制成1%溶液,在缺血后2 h腹腔注射LPS 20 mg/kg和胡黄连苷Ⅱ20 mg/kg[10-12]。
1.2.3U0126组将ERK1/2通路抑制剂U0126-EtOH(美国Selleck公司)用10%二甲基亚砜配制成1%溶液,在缺血后2h腹腔注射U0126-EtOH 20mg/kg和胡黄连苷Ⅱ20 mg/kg[10-12]。
1.2.4模型组和对照组同步腹腔注射等体积的生理盐水。
1.3评价指标
1.3.1行为测试各组治疗前(造模后2 h)和治疗后(给药后24 h)应用mNSS评分评定动物神经行为功能,最高18分,评分越高说明动物神经行为功能损伤越重,反之则较轻微。
1.3.2原位末端标记法(terminal deoxynucleotidyl transferase dUTP nick end labeling,TUNEL)染色治疗后每组随机选取5只动物,10%水合氯醛腹腔注射麻醉,经心脏灌注生理盐水200 ml,完整取脑,切取缺血部位脑组织100 mg提取总蛋白。其余脑组织置4%多聚甲醛后固定2 h,蒸馏水浸泡4 h。常规脱水、透明、包埋,连续冠状切片5μm,贴片。石蜡切片常规脱蜡水化,按TUNEL凋亡检测试剂盒(KGA7025-50assays,北京凯基生物公司)说明书进行操作,3、3'-二氨基联苯胺(3,3'-diaminobenzidine,DAB)显色,苏木素复染。光镜下胞核有棕色颗粒者为凋亡细胞。阴性对照样本不加末端脱氧核苷转移酶,不出现阳性着色。400倍显微镜下,每张切片随机观察皮质区4个不重叠视野,细胞计数,取其均值。以凋亡细胞指数(凋亡细胞指数=凋亡细胞数/细胞总数)表示损伤程度。
1.3.3Western blot检测取缺血部位脑组织100mg,加细胞裂解液(上海碧云天生物技术研究所)1 ml,4℃冰浴中研磨,置于4℃摇床30~60 min充分裂解,4℃、12 000 r/min离心15 min,去沉淀组织留上清液,二辛可宁酸(bicin chonininc acid,BCA)法测定蛋白浓度。取蛋白样品20μg,应用烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,半干法转膜,含吐温-20℃的三羟甲基氨基甲烷氯化钠缓冲液(tris-buffered saline containing tween-20,TBST)室温封闭1 h,兔抗鼠磷酸化细胞外信号调节蛋白激酶1/2(phosphorylationextracellularsignal-regulatedkinase,pERK 1/2)单克隆抗体(1∶2 000)一抗4℃孵育过夜,TBST洗膜10 min×3次,用HRP标记的羊抗兔二抗(1∶10 000)(美国Abcam公司)室温孵育1 h,TBST洗膜10 min×3次。Vilber Fusion FX7化学发光多色荧光成像系统(法国Vilber公司)曝光显影,Quantity one软件分析各条带灰度值。计算目的蛋白相对值,目的蛋白相对值=pERK1/2灰度值/ERK1/2灰度值。
1.4统计学方法
采用SPSS 17.0统计软件进行数据分析,多组间比较用析因分析及最小显著差数法,以P<0.05为差
异有统计学意义。
2 结果
2.1神经行为功能
对照组动物活动正常,造模动物表现不同程度的神经行为功能障碍。治疗组和U0126组的mNSS评分较治疗前显著下降(t=5.668和4.081,P<0.05)。模型组和LPS组治疗前后的mNSS评分比较,差异无统计学意义(t=1.819和0.276,P>0.05)。治疗后,治疗组mNSS评分较模型组和LPS组显著下降(t=5.143和6.276,P<0.01);U0126组mNSS评分较模型组和LPS组亦显著下降(t=2.368和2.812,P<0.05)。模型组与LPS组,治疗组与U0126组比较,差异无统计学意义(t=2.004和1.143,P>0.05)。
2.2细胞凋亡
TUNEL染色显示,各组大鼠神经细胞有不同程度的凋亡,胡黄连苷组和U0126组表达显著低于模型组(t=3.124和5.231,P>0.05)。对照组大鼠皮质区神经细胞凋亡数量较少;模型组大鼠皮质区凋亡细胞明显增多。胡黄连苷组大鼠皮质区出现少量凋亡细胞,各时间比较差异无统计学意义(t=1.043、 0.932和1.817,P>0.05)。LPS组大鼠凋亡细胞比治疗前略有下降(t=2.967,P<0.01),但凋亡细胞仍然较多。U0126组大鼠皮质区出现少量凋亡细胞,其程度最接近对照组,两者比较差异无统计学意义(t= 0.936,P>0.05)。见图1。
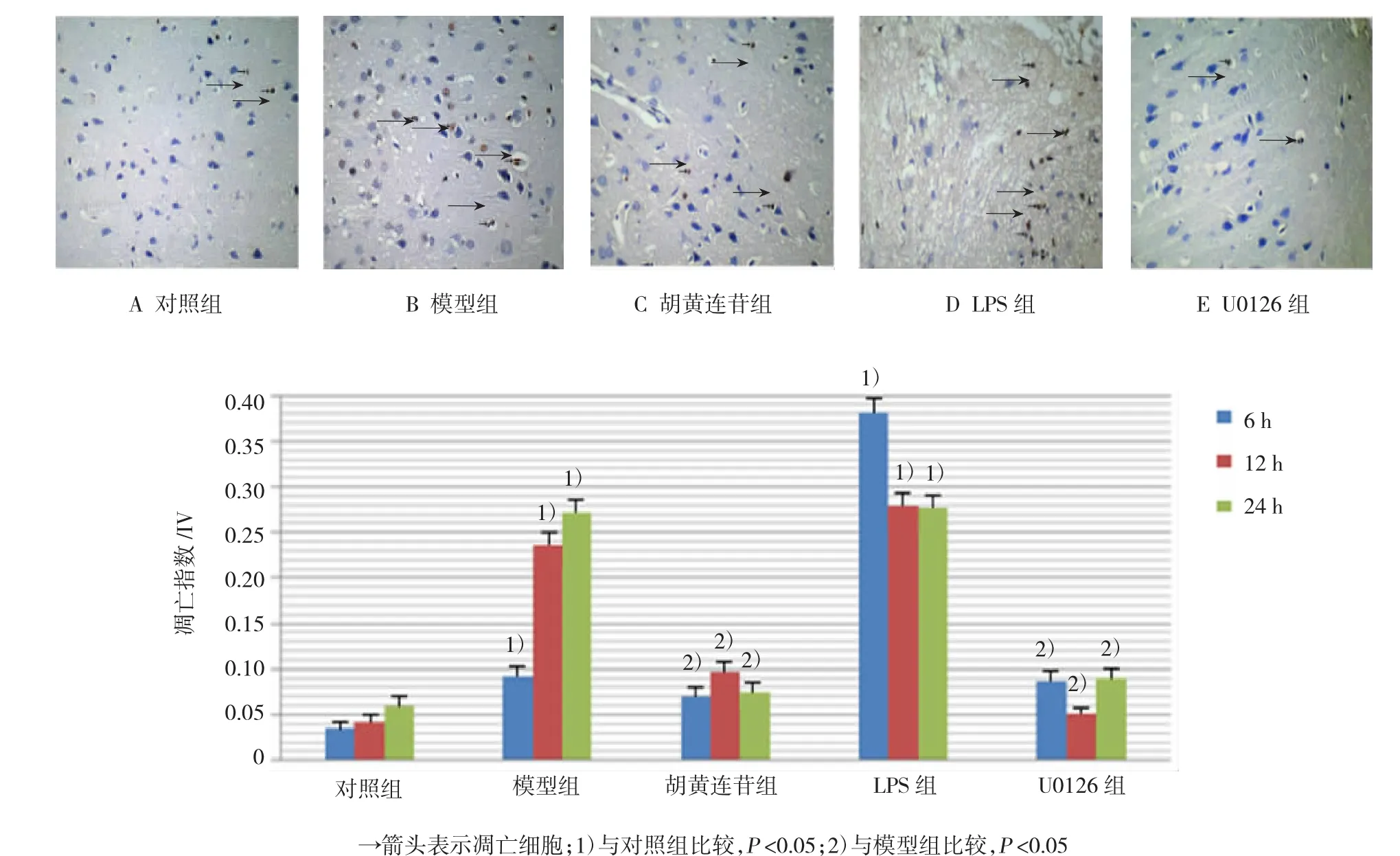
图1 大鼠皮质区细胞凋亡(TUNEL×400)
2.3Western blot检测
胡黄连苷组和U0126组神经细胞pERK1/2蛋白表达显著低于模型组(P=3.025和2.436,P<0.05)。对照组pERK1/2蛋白表达较治疗前略高(t=2.012,P>0.05)。治疗后,模型组pERK1/2蛋白表达显著高于其他各组(t=3.162、5.103、4.925和6.124,P<0.01)。胡黄连苷组pERK1/2较治疗前略有提高(t=1.893,P>0.05),但与模型组比较显著降低(t=4.171,P<0.01)。治疗后,LPS组pERK1/2表达仍高于胡黄连苷组和U0126组(t=5.362和4.324,P<0.01);U0126组pERK1/2水平较低。模型组与LPS组各时间pERK1/2表达较高,模型组显著高于其他组(t=3.76、3.893、4.176和6.132,P<0.01);LPS组pERK1/2表达也显著高于其他组(t=4.126、3.675、4.539和7.316,P<0.01)。见图2。
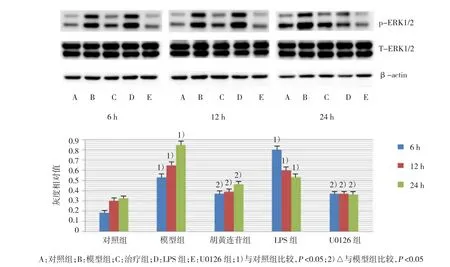
图2 Western blot检测ERK1/2蛋白表达
3 讨论
脑中风后缺血区血流量急剧减少,神经细胞受损,表现为坏死或者凋亡。实验证实ERK1/2通路可以介导细胞凋亡[13]。SREEKANTH等[14]研究表明,登革热病毒可激活小鼠肝细胞内的ERK1/2,并且有大量细胞凋亡坏死,使用FR180204(一种ERK1/2选择性抑制剂)后,含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)表达显著降低,凋亡细胞减少,肝细胞损伤明显减轻。NAMURA等[15]实验证实,U0126能够降低前脑缺血或者局灶性缺血模型沙鼠的脑梗死面积,保护神经系统,并且对缺氧环境中的原代皮质神经元细胞也表现出一定的保护作用。有报道证实,ERK1/2的激活可以直接导致神经细胞的肿胀、坏死,而该过程独立于Caspase家族的激活[16]。胡黄连味苦、性寒,有清热、凉血、燥湿之功效。前期研究显示,胡黄连苷Ⅱ能够清除自由基、抗氧化[7],下调基质金属蛋白酶-9的表达,抑制Toll样受体4-核转录因子κB信号转导通路,缓解脑水肿、改善大脑的神经功能[5],同时下调Caspase-3表达,抑制脑缺血再灌注损伤诱导的细胞凋亡[6]。本实验结果表明,脑缺血损伤后,皮质缺血区神经元ERK1/2激活,可以诱导细胞凋亡。治疗组和抑制剂组治疗后,缺血区神经元ERK1/2激活显著减少,细胞凋亡数量减少,从而促进神经元细胞的恢复。而激动剂组使用胡黄连苷Ⅱ后,ERK1/2激活显著减少,神经元细胞有所恢复,但因其早期损伤较重,恢复较差。进一步提示脑缺血损伤后,ERK1/2通路的激活能够介导神经细胞凋亡,导致神经元细胞死亡。胡黄连苷Ⅱ可能通过降低大鼠脑缺血损伤后ERK1/2的表达,抑制神经细胞凋亡而保护神经系统。
[1]KOVALSKA M,KOVALSKA L,PAVLIKOVA M,et al.Intracellular signaling MAPK pathway after cerebral ischemia reperfusion injury[J].Neurochem Res,2012,37(7):1568-1577.
[2]SHIODA N,HAN F,FUKUNAGA K.Role of AKT and ERK signaling in the neurogenesis following brain ischemia[J].Inter Review Neurobiol,2009,85(1):375-387.
[3]SUBRAMANIAM S,ZIRRGIEBEL U,HALBACH OVBU,et al. ERKactivationpromotesneuronaldegenerationpredominantly through plasma membrane damage and independently of caspase-3[J].J Cell Biol,2004,165(3):357-369.
[4]DENG XH,ZHONG Y,GU LZ,et al.MiR-21 involve in ERK-mediated upregulation of MMP9 in the rathippocampus following cerebral ischemia[J].Brain Research Bulletin,2013,94(1): 56-62.
[5]GUO YL,XU XL,LI Q,et al.Anti-inflammation effects of picroside 2 in cerebral ischemic injury rats[J].Behavioral and Brain Functions,2010,6(43):43.
[6]LI Q,LI Z,XU XY,et al.Neuroprotective properties of picrosideⅡin rat model of focal cerebral ischemia[J].Int J Mol Sci, 2010,11(11):4580-4590.
[7]LI X,XU XY,LI Z,et al.PicrosideⅡdown-regulates matrix metalloproteinase-9 expression following cerebral ischemia/reperfu sion injury in rats[J].Neural Regen Res,2010;5(18):1403-1407. [8]LONGA EZ,WEINSTEIN PR,CARLSON S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[9]CHEN J,SANBERG PR,LI Y,et al.Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J].Stroke,2001,32(11):2682-2688.
[10]ZHAO L,GUO YL,JI XJ,et al.The neuroprotective effect of picrosideⅡvia regulating the expression of myelin basic protein after cerebral ischemia injury in rats[J].BMC Neurosci, 2014,15:25.
[11]PEI HT,SU X,ZHAO L,et al.Primary study for the therapeutic dose and time window of picrosideⅡin treating cerebral ischemic injury in rats[J].Int J Mol Sci,2012,13(3): 2551-2562.
[12]WANG TT,ZHAO L,GUO YL,et al.PicrosideⅡinhibits neuronal apoptosis and improves the morphology and structure of brain tissue following cerebral ischemic injury in rats[J].Plos One,2015,10(4):1240-1249.
[13]BHAT NR,ZHANG P.Hydrogen peroxide activa-tion of multiple mitogen-activated protein kinases in an oligodendrocyte cell line:role of extracellular signal-regulated kinase in hydrogen peroxide-induced cell death[J].J Neurochem,1999,72(1):112-119.
[14]SREEKANTH GP,CHUNCHARUNEE A,SIRIMONTAPORN A, et al.Role of ERK1/2 signaling in dengue virus-induced liver injury[J].Virus Research,2014,188(8):15-26.
[15]NAMURA S,LIHARA K,TAKAMI S,et al.Intravenous administration of MEK inhibitor U0126 affords brain protection against forebrain ischemia and focal cerebral ischemia[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98(20):11569-11574.
[16]LOBNER D,LIOT G.Role of MAPK/ERK1/2 in neurotrophin-4 potentiation of necrotic neuronal death[J].Neurochem Res,2004, 29(12):2303-2309.
(张蕾 编辑)
Effect of PicrosideⅡon ERK1/2 signal transduction pathway in rats with cerebral ischemic injury
Guang-zheng ZHOU,Ya-dong GUAN,Hua ZHANG,Wei LYU,De-li FU,Li ZHAI
(Institute of Integrative Medicine,Medical College,Qingdao University, Qingdao,Shandong 266021,P.R.China)
【Objective】To explore the effect of PicrosideⅡon ERK1/2 signal transduction pathway after cerebral ischemia injury in rats.【Methods】The focal cerebral ischemic model was established by inserting a monofilament thread into middle cerebral artery for occlusion in 90 Wistar rats.The rats in the treatment group were treated by intraperitoneal injection of PicrosideⅡ(20 mg/kg).The neurobehavioral function was evaluated by Modified Neurological Severity Score points test(mNSS).The apoptotic cells were counted by terminal deoxynucleotidyl transferase dUTP nick end labeling assay.The expression of pERK1/2 was determined by Western blot.【Results】After cerebral ischemia,the rats had neurological behavioral malfunction. As time progressed after cerebral ischemia,the apoptotic cells and the expression of pERK1/2 significantly increased compared to those in the control group(P<0.05).The apoptotic cells and the expression of pERK1/2 in the treatment and U0126 groups were much lower than those in the model group(P<0.05).In the LPS 6 h subgroup the apoptotic cells and the expression of pERK1/2 were the highest,and slightly recovered during the later period.【Conclusion】PicrosideⅡmight reduce cell apoptosis by inhibiting the activation of ERK1/ 2 in cerebral ischemic injury.
PicrosideⅡ;cerebral ischemia;apoptosis;ERK1/2;rat
R743.31;R285
A
1005-8982(2015)27-0022-05
2015-04-15
周广正,青岛大学在职硕士学位研究生,现工作单位为山东省菏泽市成武县人民医院

