内质网应激介导的糖尿病大鼠胃平滑肌凋亡及大黄素干预作用*
陈霞,梅欣明,徐瑲,赵宏贤
(1.泸州医学院附属医院消化内科,四川 泸州 646000;2.四川医科大学组织胚胎教研室,四川 泸州 646000)
·论著·
内质网应激介导的糖尿病大鼠胃平滑肌凋亡及大黄素干预作用*
陈霞1,梅欣明2,徐瑲2,赵宏贤2
(1.泸州医学院附属医院消化内科,四川 泸州 646000;2.四川医科大学组织胚胎教研室,四川 泸州 646000)
目的探讨糖尿病大鼠胃平滑肌细胞凋亡机制及大黄素干预机制。方法SD大鼠随机分为对照组、糖尿病组及大黄素组。造模10周时检测胃排空;脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)检测胃平滑肌细胞凋亡;免疫组织化学检测胃平滑肌细胞葡萄糖调节蛋白78(GRP78)、Caspase-12蛋白表达。结果①与对照组比较,糖尿病组大鼠胃内色素残留率显著增高(P<0.05);与糖尿病组比较,大黄素组胃内色素残留率显著下降(P<0.05)。②糖尿病组大鼠较对照组的胃平滑肌细胞凋亡、GRP78及Caspase-12蛋白表达显著增高(P<0.05);与糖尿病组比较,大黄素组大鼠胃平滑肌细胞凋亡、GRP78及Caspase-12蛋白表达显著降低。结论内质网应激(ERS)途径可能介导糖尿病大鼠胃平滑肌细胞凋亡。大黄素可能通过减少ERS介导的胃平滑肌细胞凋亡,改善糖尿病大鼠胃排空功能。
大黄素;糖尿病胃轻瘫;胃平滑肌;凋亡;内质网应激
糖尿病胃轻瘫(diabetic gastroparesis,DGP)是在糖尿病病程中出现的以胃排空延迟为主要特点的症候群,临床表现为早饱、腹胀、恶心、呕吐等症状。有资料显示,50%~76%的糖尿病患者存在胃排空异常[1]。近年研究发现,DGP大鼠胃平滑肌凋亡增加[2]。内质网应激(endoplasmic reticulum stress response,ERS)作为十分重要的第3条细胞凋亡途径,参与多种疾病的发生和发展。但是ERS是否介导糖尿病大鼠胃平滑肌细胞凋亡,尚未见相关报道。大黄素是中药大黄主要活性成份,现代研究证实大黄素能够明显调节胃肠道平滑肌运动[3-7],但具体机制有待深入研究。本实验建立糖尿病大鼠模型,检测ERS是否参与糖尿病胃平滑肌细胞凋亡,以及大黄素对其干预作用,为DGP临床治疗提供实验依据。
1 材料与方法
1.1材料
清洁级雄性SD大鼠30只,6~8周,体重约200 g,由泸州医学院动物科提供,许可证号:川实动管质第17号。
1.2仪器与试剂
J02005型722分光光度计(厦门分析仪器厂),One Touch Horion血糖仪(深圳强生医疗器材有限公司),链脲佐菌素(美国Sigma公司),大黄素(纯度为98%,上海晶纯有限公司),脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal deoxynucleotidyl transferase dUTP nick end labeling,TUNEL)试剂盒(瑞典Roche Diagnostics公司),葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)、Caspase-12多克隆抗体(美国Bioword公司)。
1.3方法
1.3.1糖尿病造模SD大鼠,适应性喂养1周。血糖正常大鼠30只,其中随机选取10只健康SD鼠作为对照组,其余大鼠链脲佐菌素(streptozotosin,STZ)65 mg/kg腹腔注射以复制糖尿病模型;对照组给予等量柠檬酸缓冲液。3 d后,禁食不禁水6 h,采尾血测空腹血糖,以血糖持续1周≥16.7 mmol/L为造模成功。糖尿病大鼠随机分为糖尿病组和大黄素组,每组10只。造模2周时,对照组与糖尿病组以磷酸缓冲盐溶液(phosphate buffer saline,PBS)5 ml/kg灌胃,大黄素组用8 g/L大黄素混悬液灌胃,5 ml/kg,1次/d,连续8周。①一般指标:检测进食量、饮水量、尿量等,每周测体重1次。②血糖测定:STZ注射后第1、4、8和10周采尾血测空腹血糖。
1.3.2胃排空检测第10周,各组大鼠禁食不禁水24 h后,将1 mg/ml美蓝溶液0.4 ml经口胃管灌入,30 min后处死大鼠,取全胃。将胃内残留物用4 ml生理盐水冲洗并收集冲洗液,低速离心机3 500 r/min离心15 min,取上清液,用722分光光度计在640 nm波长检测吸光度值(optical density,OD)。大鼠胃排空用胃内色素的残留率表示,胃内色素残留率=测定管OD值/标准管OD值×100%。
1.3.3TUNEL法检测胃平滑肌细胞凋亡按TUNEL试剂盒说明书步骤进行染色。切片放入3%双氧水H2O2溶液中,室温10 min。PBS洗涤样片,将TdT及Biotin-dUTP混合液加至样片,50μl/片,阴性对照只加Biotin-dUTP,50μl/片,加盖玻片,37℃湿盒中孵育标记60 min。以封闭液按照1∶50配置HRP为工作液,50μl加于样品片,37℃盒中孵育标记60 min,二氨基联苯胺(diaminobenzidine,DAB)显色剂显色,苏木素染液复染胞核。TUNEL法阳性结果判断:细胞核棕黄(褐)色。每组取10个标本,每个标本1张切片,数码显微镜照相,Image-proplus 5.0软件计算各组细胞凋亡率。
1.3.4免疫组织化学检测GRP78、Caspase12蛋白表达胃平滑肌组织经10%中性福尔马林液固定,常规石蜡包埋,5μm连续切片,二甲苯脱蜡至水。3% H2O2室温孵育10 min,蒸馏水冲洗3 min×3次,微波抗原修复20min。正常羊血清封闭,室温孵育15min,加1∶100一抗体4℃过夜,PBS洗片5 min×3次,滴加生物素标记二抗,37℃,20min,PBS洗片5 min× 3次,加链霉亲和素-生物素复合物(strept avidinbiotin complex,SABC)液,37℃,20 min,PBS洗片5 min×3次,DAB显色,自来水冲洗,脱水、透明、封片。显微镜下观察、照相。以PBS代替一抗作阴性对照组。GRP78与Caspase12阳性结果判断:细胞质着色,染成棕黄(褐)色。每组取10个标本,每个标本连续切片2张,数码显微镜照相,Image-proplus 5.0图
像分析软件分析蛋白阳性表达细胞。
1.4统计学方法
采用SPSS 14.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1一般情况
对照组大鼠一般情况良好。糖尿病组和大黄素组大鼠造模后第3天开始出现多饮、多食、多尿;成模10周时,两组大鼠精神萎靡、反应迟钝、皮毛疏松无光泽、背部毛发部分脱落、少数极度衰竭,体重显著低于对照组(P<0.05)。见表1。
表1 10周时各组大鼠体重与血糖浓度比较(n=10±s)

表1 10周时各组大鼠体重与血糖浓度比较(n=10±s)
注:1)与对照组比较,P<0.05;2)与糖尿病组比较,P<0.05
组别体重/g血糖浓度/(mmol/L)对照组465.00±19.005.38±1.20糖尿病组172.50±29.561)28.63±4.501)大黄素组178.30±17.741)21.51±9.451)2)F值541.45738.477
2.2血糖浓度测定
造模3 d后,模型组和大黄素组空腹血糖始终维持>16.7 mmol/L。成模10周时,与对照组比较,模型组和大黄素组大鼠血糖显著增加(P<0.05);与模型组比较,大黄素组大鼠血糖显著降低(P<0.05),但未降至正常水平。见表1。
2.3胃内色素残留率测定
糖尿病大鼠胃内美蓝残留率显著高于对照组(F=85.366,P<0.05)。与糖尿病组比较,大黄素组胃内美蓝残留率显著降低(F=85.366,P<0.05)。见表2。
表2 各组胃内色素残留率与胃平滑肌细胞凋亡率比较(n=10,%±s)

表2 各组胃内色素残留率与胃平滑肌细胞凋亡率比较(n=10,%±s)
注:1)与对照组比较,P<0.05;2)与糖尿病组比较,P<0.05
组别色素残留率细胞凋亡率对照组38.68±1.772.54±1.30糖尿病组51.81±2.601)11.65±3.301)大黄素组42.89±2.461)2)6.50±1.971)2)F值85.36657.043
2.4胃平滑肌细胞凋亡率
糖尿病大鼠胃平滑肌细胞凋亡率显著高于对照组(F=57.043,P<0.05)。与糖尿病组比较,大黄素组胃平滑肌细胞凋亡率显著降低(F=57.043,P<0.05)。见图1和表2。

图1 各组胃平滑肌细胞凋亡(TUNEL×400)
2.5胃平滑肌细胞GRP78、Caspase12蛋白表达
与对照组比较,糖尿病大鼠胃平滑肌细胞GRP78 [(6.51±2.12)vs(20.21±3.56)]、Caspase12[(6.48± 2.11)vs(18.91±4.61)]蛋白阳性表达细胞显著增多(F=47.809、35.910,P=0.000)。与糖尿病组比较,大黄素干预大鼠胃平滑肌细胞GRP78[(20.21±3.56)vs(12.04±3.55)]、Caspase12[(18.91±4.61)vs(12.92± 2.55)]蛋白阳性表达细胞显著减少(F=47.809、35.910,P=0.000)。见图2、3。

图2 各组胃平滑肌细胞GRP78蛋白阳性表达(SABC×200)
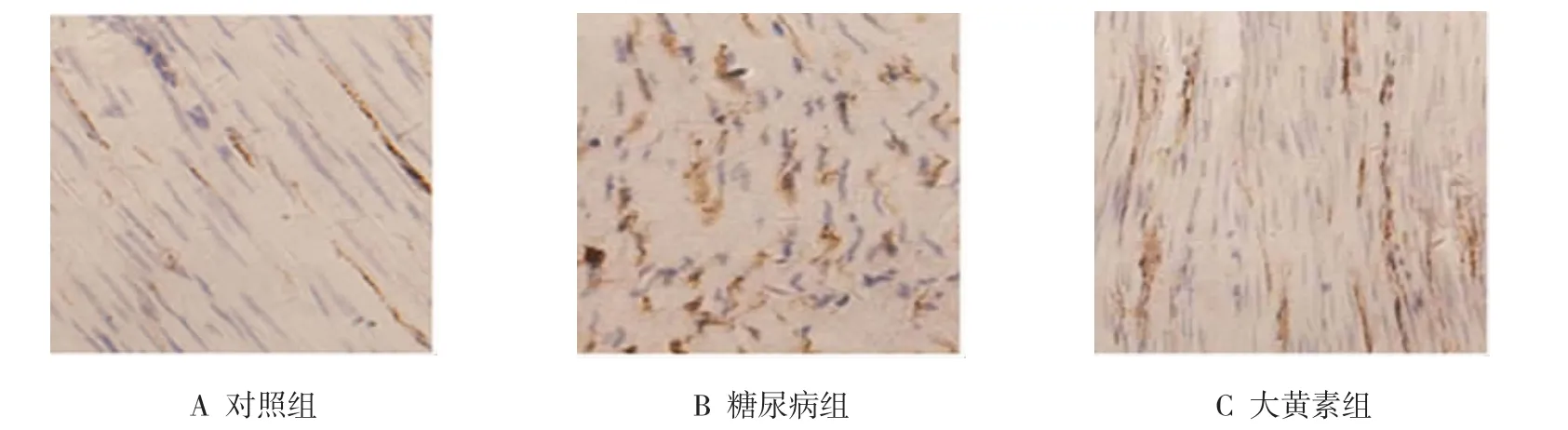
图3 各组胃平滑肌细胞Caspase12蛋白阳性表达(SABC×200)
3 讨论
胃轻瘫除导致上消化道症状外,还影响糖尿病患者的血糖控制。本实验在造模10周的检测结果显示,与对照组比较,模型组大鼠胃内色素残留率增加,表明胃排空能力明显减弱。DGP的发病机制尚未明确。近来大量研究发现,糖尿病可导致不同部位的细胞凋亡,胃肠平滑肌也不例外。本研究中TUNEL法检测结果表明,糖尿病大鼠胃平滑肌细胞凋亡增多,与相关研究结果一致[2]。
近年来研究结果证明,内质网在把控细胞命运中发挥重要作用。感染因素、环境因素、不利的代谢条件等都可以干扰内质网的功能,破坏内质网稳态,达到一定程度便会产生ERS。GRP78是ERS的一种标志蛋白,GRP78的表达常提示ERS的存在,其在维持内质网蛋白质合成、正确折叠及细胞钙稳态方面起重要作用[8]。本实验结果显示,GRP78蛋白在糖尿病大鼠胃平滑肌细胞中表达明显增高,提示糖尿病大鼠胃平滑肌细胞存在ERS。
本实验进一步探讨糖尿病大鼠胃平滑肌细胞凋亡与ERS的相关性。在ERS介导的凋亡途径中,Caspase-12起至关重要作用。Caspase-12以酶原形式存在于内质网膜胞浆侧,是特异性ERS诱导细胞凋亡的重要调节子,在ERS时可特异性激活,非ERS介导的凋亡无Caspase-12活化[9]。本研究结果显示,糖尿病大鼠胃平滑肌细胞Caspase-12蛋白表达增强,Caspase-12相关的凋亡往往与ERS途径有关。提示ERS途径在糖尿病大鼠胃平滑肌细胞凋亡中起一定作用。糖尿病大鼠体内存在多种可诱发ERS的因素,如氧化应激和脂质代谢障碍。笔者推测,糖尿病患者由于多种不利因素导致ERS,促进细胞凋亡重要调节因子——Caspase-12的表达,诱导细胞凋亡,引起胃排空功能减低。
除此之外,本研究显示,应用大黄素的大鼠胃排空能力明显提高。大量动物实验证实大黄素能够明显调节胃肠道平滑肌运动。研究发现,大黄素可通过离子通道、起搏细胞、神经递质、胃肠激素与炎症反应的环节调节胃肠道平滑肌的收缩与舒张。但未见从平滑肌细胞凋亡角度,探讨大黄素对胃肠运动影响的相关报道。本实验研究发现,大黄素干预组大鼠胃平滑肌细胞凋亡及Caspase-12蛋白表达较糖尿病组降低,提示大黄素有可能通过调节ERS途径,减少胃平滑肌细胞凋亡,改善糖尿病大鼠胃平滑肌的生理功能,从而改善胃排空能力。
[1]CHOUNG RS,LOCKE GR,SCHLECK CD,et al.Risk of gastroparesis in subjects with type 1 and 2 diabetes in the general population[J].Am J Gastroenterol,2012,107(1):82-88.
[2]CHEN X,FU XS,LI CP,et al.ER stress and ER stress-induced apoptosis are activated in gastric SMCs in diabetic rats[J]. World J Gastroenterol,2014,20(25):8260-8267.
[3]谭晓虹,李炜,王志宝,等.正交实验法优选虎杖中大黄素的提取工艺研究[J].时珍国医国药,2012,23(7):1703-1704.
[4]PENG C,WANG L,WANG YH,et a1.The toxicity of aconitine, emodin on ICC cell and the antagonist efect of the compatibility [J].Eur J Drug Metab Pharmacokinet,2009,34(3):213-220.
[5]胡畔,杨晶,高柳,等.大黄素对大鼠离体空肠平滑肌收缩的影响[J].中国应用生理学杂志,2014,30(1):93-96.
[6]CHEN D,XIONG Y,WANG L,et al.Characteristics of emodin on modulating the contractility of jejunal smooth muscle[J].Can J Physiol Pharmacol,2012,90(4):455-462
[7]ZHENG YF,LIU CF,LAI WF,et al.The laxative effect of emodin is attributable to increased aquaporin 3 expression in the colon of mice and HT-29 cells[J].Fitoterapia,2014,96:25-32.
[8]SU YC,WU JL,HONG JR.Betanodavirus upregulates chaperone GRP78 via ER stress:roles of GRP78 in viral replication and host mitochondria-mediated cell death[J].Apoptosis,2011,16(3): 272-287.
[9]ZHAO HX,FU XS,ZHOU XY,et al.Endoplasmic reticulum stress may not be involved in intestinal epithelial cell apoptosis in experimental acute pancreatitis[J].Dig Dis Sci,2015,60(6): 1690-1698.
(张蕾 编辑)
Endoplasmic reticulum stress induced apoptosis in gastric smooth muscle cells in diabetic rats and effects of Emodin intervention*
Xia CHEN1,Xin-ming MEI2,Qiang XU2,Hong-xian ZHAO2
(1.Department of Gastroenterology,the Affiliated Hospital,Luzhou Medical College,Luzhou, Sichuan 646000,P.R.China;2.Department of Histology and Embryology,Sichuan Medical University,Luzhou,Sichuan 646000,P.R.China)
【Objective】To investigate the mechanism of apoptosis of gastric smooth muscle cells(SMCs) in diabetic rats,and the mechanism involving the effect of Emodin on SMCs in diabetic rats.【Methods】SD rats were randomly divided into control group,diabetic group and Emodin group.Gastric emptying was determined in the 10th week.Apoptosis of gastric SMCs was detected by TUNEL method.Expressions of glucoseregulated protein 78(GRP78)and Caspase-12 protein were detected by immunohistochemistry.【Results】①The rate of gastric residual pigment was significantly increased in the diabetic group than in the control rats (P<0.05).Compared with the diabetic group,the rate of gastric residual pigment was significantly decreased in the Emodin group(P<0.05).②The cell apoptosis and the expressions of GRP78 and Caspase-12 protein in gastric smooth muscle cells were obviously increased in the diabetic group than in the control group(P<0.05).Compared with the diabetic group,the cell apoptosis and the expressions of GRP78 and Caspase-12 protein in gastric smooth muscle cells were declined obviously in the Emodin group(P<0.05).【Conclusions】Emodin can improve the gastric emptying,which may be involved with the reduction of apoptosis of gastric
Emodin;gastroparesis;gastric smooth muscle;apoptosis;endoplasmic reticulum stress
R587.1;R-332
A
1005-8982(2015)27-0018-04
2015-02-17
四川省泸州市科技局重点项目[No:2009-S-15(5/7)];四川省卫生厅资助项目(No:100242)
赵宏贤,E-mail:zilong5276@sohu.com
SMCs in diabetic rats induced by endoplasmic reticulum(ER)stress pathway.

