抗噬菌体甲型副伤寒沙门菌突变菌的构建及其生物学特性
毛普加,冯梦蝶,洪 愉,毛小萍,许泽仰,赵继华,杨洪文,宋武战,黄 芬,井申荣,曾韦锟
(1.昆明理工大学医学院病原微生物学实验室,云南 昆明 650500;2.昆明学院医学院临床检验教研室,云南 昆明 650214;3.成都军区昆明总医院核医学科,云南 昆明 650032;4.湖北省孝感市中心医院泌尿外科,湖北 孝感 432000)
甲型副伤寒沙门菌(副甲菌)以粪口途径传播,是甲型副伤寒的病原菌。人群对副甲菌普遍易感,尤以儿童和青壮年发病率最高。每年全球伤寒患者约2200万例,其中由副甲菌引起的约500万例[1]。噬菌体是生物圈中最多的微生物,其数量约是细菌的10倍[2],作为细菌的杀手,噬菌体对微生物生态环境和宿主细菌进化有重要影响。在自然界中,噬菌体和宿主通过噬菌体侵染和噬菌体抗性机制使两者达到宿主-噬菌体动态平衡,而宿主菌证实通过这种噬菌体侵染的压力获得一些特殊的生物学特性。在很多发酵行业,需要培养大量细菌,所以在不同的阶段都面临着噬菌体污染的问题,导致发酵周期延长、产量降低甚至全部浪费,造成重大的经济损失。研究抗噬菌体的机制,通过抗噬菌体筛选出优良的工程菌和获得特殊性状的宿主菌[3],在工业生产和科学研究中越显重要。在宿主菌抗噬菌体突变后,会获得一些其他的未知特性,而这些特性对于工业生产和研究等具有重大意义,例如利用抗噬菌体制备减毒疫苗[4-5]等。目前,抗噬菌体的研究处于起步阶段,并且主要用于工业生产,对于生物制药、科学研究等方面涉及甚少,所以抗噬菌体的研究具有广泛的前景。本课题组前期[6]从医院污水筛选出烈性副甲噬菌体PSPA1,并用转座突变、不对称PCR和测序等方法筛选出抗噬菌体突变菌,测序发现转座子插入位点包括甲基转移酶、硫代硫酸盐还原酶电子前体和乙酰乳酸合酶同工酶Ⅲ大亚基。本研究中通过基因敲除的方法分别定点敲除上述基因,并进一步验证这些基因与副甲耐受噬菌体的相关性,同时对敲除突变菌的生物学特性进行检测,为探索噬菌体和宿主相互作用、噬菌体的生命活动和筛选特殊生物学特性的突变菌奠定基础。
1 材料与方法
1.1 菌株和主要试剂 副甲菌CMCC50973为本实验室保存;噬菌体PSPA1为本实验室保存,由医院污水中分离获得;pYG4[7]:自杀性卡那霉素(K+50mg·L-1)抗性质粒(图1),在副甲菌中表现自杀性,也是一种蔗糖敏感性质粒,在含有蔗糖培养基中无法复制;LB培养基:酵母粉5g,胰蛋白胨10g,NaCl 10g,定容至1L(固体加2%琼脂);DL2000DNA marker购自大连宝生物工程(Takara)公司;氯霉素、卡那霉素(K+)、链霉素、氨苄青霉素(A+)、红霉素、四环素、萘啶酮酸和PCR试剂均购自上海生工有限公司;实验所用的引物均由上海捷瑞生物技术有限公司合成。
1.2 同源重组质粒的构建 同源重组质粒的片段构建见图2。根据GenBank参考序列(FM2000053.1)设计引物,下划线部分为BglⅡ酶切位点(表1),分别在1号和4号引物中引入BglⅡ酶切位点和保护性碱基,先用1、2号引物及3、4号引物扩增,之后通过融合PCR构建融合臂。BglⅡ酶切pYG4质粒后去磷酸化,与同样经BglⅡ酶切的融合PCR产物连接,构建pYG4-2、pYG4-3和pYG4-5重组质粒,并进行测序鉴定。

图1 pYG4质粒图谱Fig.1 Map of pYG4plasmid
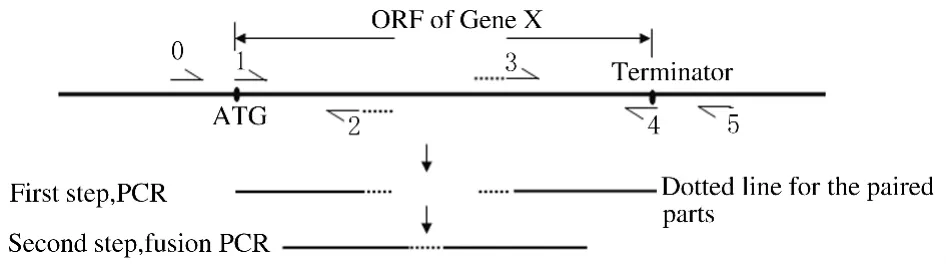
图2 同源臂的构建图Fig.2 Construction diagram of homologous arm
1.3 同源重组突变菌的制备及鉴定 副甲菌电转感受态制备:在100mL LB培养基中接种新鲜的野生型副甲菌(1%),37℃摇床培养约4h至A≈0.6;分装至50mL离心管中,3000g离心10min,弃上清;沉淀用无菌水洗涤,3000g离心10min,弃上清,重复3次;沉淀用4mL 10%甘油重悬,按100μL每管分装,-80℃保存。将构建好的pYG4-2、pYG4-3和pYG4-5重组质粒以电压2000V、脉冲25μF和电阻200Ω电转条件电转到副甲菌感受态中,涂布于卡那霉素平板中,37℃培养20h;接种单菌于含有20%蔗糖LB培养基中,长出的单菌即为待鉴定重组突变菌。将突变菌进行图2中所示的0、5号外侧引物PCR验证。3株突变菌和野生型副甲菌在平板中划线,待干后于线上滴加噬菌体原液(pfu=1.2×109),37℃培养过夜。

表1 引物序列Tab.1 Sequences of primers
1.4 突变菌抗生素敏感性的测定 将96孔板用75%酒精浸泡20min,放入超净台中晾干,再用紫外照射20min灭菌。选择氨苄青霉素(0、12.5、 25.0、 50.0、 75.0、 100.0和150.0mg·L-1)、卡那霉素(0、10、15、20、25、30、40和50mg·L-1)、氯霉素(0、1.25、2.50、5.00、10.00、20.00、50.00mg·L-1)、链霉素(0、10、20、40、50、100和200mg·L-1)、红霉素(0、20、50、100、150和200mg·L-1)、四 环 素(0、1、2、5、10和20mg·L-1)和萘啶酮酸(0、2、5、10、20和30mg·L-1)7种不同类型的抗生素;用LB培养基将不同的抗生素稀释至不同浓度并加入灭菌的96孔板中,每组3个复孔,按1%接种,在潮湿环境中培养24h,以野生型副甲菌作为对照,通过测量突变菌在不同抗生素浓度下595nm处的吸光度(A595)值判断其抗生素的敏感性[8]。
1.5 突变菌温度和pH值敏感性的测定 将LB培养基调pH值1~12,按1%接种于灭菌的96孔板中,潮湿环境下37℃培养24h,测量A595值;取3株突变菌和野生型副甲菌各50μL分别于40、50、60、70和80℃中处理1h,接种至灭菌的96孔板中,每组3个复孔,潮湿环境下37℃培养24h。以野生型副甲菌作为对照,测量突变菌经不同温度和pH处理后的A595值,判断突变菌对温度和pH的敏感性。
1.6 突变菌盐离子耐受范围的测定 将LB培养基分别用NaCl、KCl和MgCl2·7H2O调节相应的盐离子浓度,浓度分别为0%、2%、5%、10%、15%、20%、25%和30%。然后按1%接种灭菌的96孔板中,每组3个复孔,潮湿环境下37℃培养24h,以原始副甲菌作为对照,测量不同盐离子浓度下突变菌的A595值判断突变菌对盐离子的耐受范围。
1.7 突变菌生长曲线的测定 取3株新鲜的突变菌和野生型副甲菌按1%接种至5mL培养基中,放入37℃摇床培养,此时记为0min,第一次间隔1h取样,其余每隔30min取样,测量A595值,直到7h为止,重复3次[9]。
2 结 果
2.1 同源重组及突变菌的鉴定 以副甲菌基因组为模板,设计引物,扩增部分目的基因,PCR进行融合(图3),经琼脂糖电泳鉴定片段长度均约为1000bp,和预期大小一致(图4);融合PCR片段插入pYG4载体,测序鉴定正确。抗噬菌体验证见图5,3株敲除突变菌均表现为噬菌体抗性。
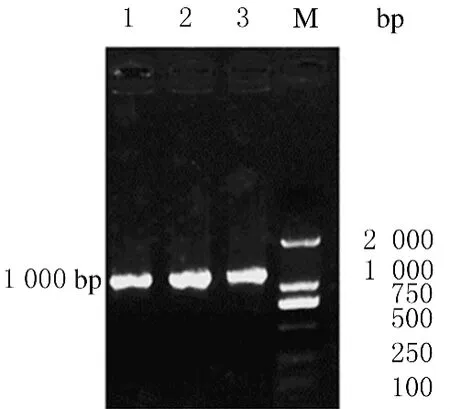
图3 目的片段融合PCR电泳图Fig.3 Electrophoregram of fusion PCR of target fragments
2.2 突变菌抗生素的敏感性 选择氨苄青霉素、卡那霉素、氯霉素、链霉素、红霉素、四环素和萘啶酮酸7种不同抗生素用于突变菌抗生素敏感性实验,2、3、5号菌株产生卡那霉素抗性;2号菌株产生氨苄青霉素抗性;3株突变菌比野生型副甲对链霉素更为敏感性,2号菌株尤为突出;所有菌株对其他抗生素的敏感性无明显差异。见图6。
2.3 突变菌对温度和pH值敏感性 将3株突变菌和野生型副甲菌于不同pH值的培养基中培养和经不同温度处理1h后再培养,观察其生长状况。3株突变菌对pH值敏感性无明显变化,最适生长pH值约为6;5号突变菌表现出明显的耐热性,高于60℃后5号突变菌的A595值保持稳定。见图7。
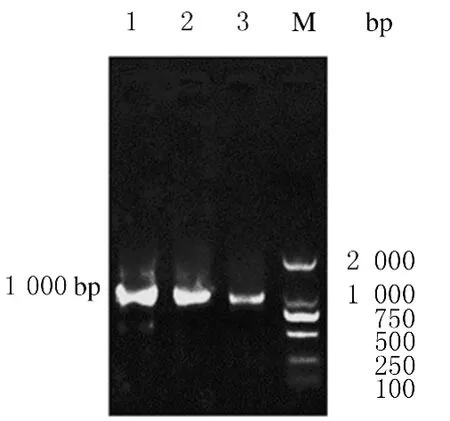
图4 突变菌鉴定电泳图Fig.4 Electrophoregram of identification of mutants

图5 突变菌抗噬菌体验证图Fig.5 Verification of mutants resistant to phage
2.4 盐离子耐受 将3株突变菌和野生型副甲菌接种至含有不同浓度(0%、2%、5%、10%、15%、20%、25%和30%)的 NaCl、KCl和MgCl2·7H2O培养基中培养24h后,4株菌A595值均随着盐离子浓度增加而降低,且其趋势相近无明显差异。见图8。
2.5 突变菌的生长曲线 接种突变菌和野生型副甲菌,每间隔一段时间取样测量A值,3株突变菌较野生型副甲菌生长缓慢,尤其是2号突变菌,其达到稳定期的时间要比野生型副甲菌晚约3h。见图9。
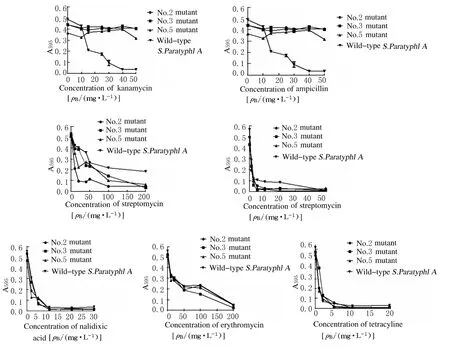
图6 突变菌对不同抗生素的敏感性分析图Fig.6 Diagram of analysis of sensitivities of mutants to different antibiotics
3 讨 论
本课题组前期采用转座质粒pSC189随机插入副甲菌基因组,通过噬菌体筛选出抗噬菌体突变菌,测序结果表明:转座子插入的位点包括甲基转移酶、硫代硫酸盐还原酶和乙酰乳酸合酶同工酶Ⅲ大亚基。为排除上述突变菌耐受噬菌体是由于自发突变[11]等其他因素造成的,需要基因敲除实验进一步验证。
宿主菌有多种抗噬菌体机制,并在自然界中能筛选出抗噬菌体的突变菌[12-13],而基因敲除是基因功能研究的一种重要人工手段,且敲除方法也较多。本研究采用王景等[7]构建的敲除质粒pYG4,该质粒是依赖π蛋白的复制子,在副甲菌等绝大多数细菌中不能复制,同时载体中含有SacB基因,在蔗糖存在条件下具有致死性。考虑到细菌染色体中广泛存在的基因重叠现象,为了避免可能对邻近基因表达的影响,在构建同源臂时,分别保留了待敲除基因转录起始位点下游和终止子上游部分碱基,保留碱基数为3的倍数,这样力求在去除目的基因的同时,避免影响上下游基因的表达。构建的敲除质粒pYG4-2、pYG4-3和pYG4-5转化副甲菌后,发生了2步同源重组:首先以2、3、5号片段作为同源臂,将整个重组质粒重组到至副甲菌基因组中,通过卡那霉素筛选出突变菌,于含20%蔗糖平板中划线,此时完全重组突变菌会丢失卡那霉素抗性且能在蔗糖平板上生长。通过突变位点外侧引物PCR可证实敲除结果。通过此方法获得的定点敲除副甲菌,经噬菌体感染实验确定突变菌具有噬菌体抗性,表明这些基因的确与噬菌体PSPA1感染宿主CMCC50973有关联。
上述3种基因在副甲菌中详细功能并不清楚,为此本研究对敲除菌进行了一些生物学特性分析。在抗性实验中,3株突变菌产生了卡那霉素抗性,鉴于pYG4质粒中含有卡那抗性基因,因此对于3株突变菌的卡那霉素抗性尚需要后续实验进一步鉴别和分析。与野生型副甲菌比较3株突变菌均对链霉素表现出敏感性;2号菌表现出氨苄青霉素抗性,5号菌表现高温度耐受性;另外3株突变菌的生长曲线较野生型副甲菌明显变缓,尤其是2号突变菌。突变菌表现出的生物学特性和抗生素的耐受性及温度敏感度,丰富了相关基因潜在功能知识,同时对于深入研究副甲菌对不同环境的环境适应、耐药机制和致病性等方面具有重要作用,但是目前对这些生物特性改变的机制尚不清楚,最有可能的是宿主菌基因的突变改变某些蛋白的表达,下一步需要进行蛋白质组学研究[14]。
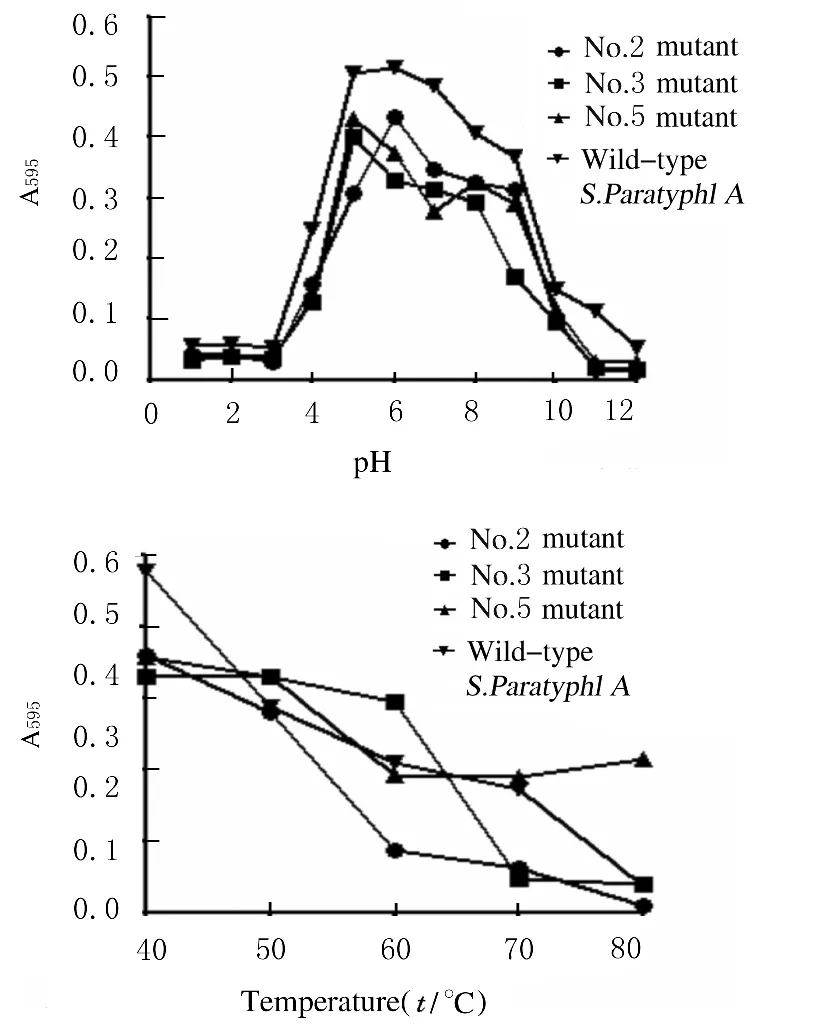
图7 突变菌对不同pH值和温度敏感性分析图Fig.7 Diagram of analysis of sensitivities of mutants to different pH values and temperature
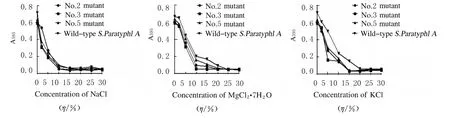
图8 突变菌对不同盐离子浓度敏感性分析图Fig.8 Diagram of analysis of sensitivities of mutants to different concentrations of salt ions

图9 突变菌生长曲线图Fig.9 Growth curves of mutants
但是这些生物学性质的改变是否与噬菌体耐受有关尚不清楚,本文作者推测这些基因的破坏可能导致副甲菌中某些物质合成障碍或者信号通路变化,影响到噬菌体侵染(吸附、增殖和释放)的相关环节[15];也有可能是改变了宿主菌自身的性状,例如加强了宿主菌聚集,增强宿主菌的群体效应,从而抵抗噬菌体侵染[16]。下一步研究可从蛋白表达和宿主菌群体效应等方面着手,更深入地探索这些突变菌抗噬菌体的机制。
[1]Majowicz SE,Musto J,Scallan E,et al.The global burden of nontyphoidal salmonella gastroenteritis[J].Clin Infect Dis,2010,50(6):882-889.
[2]Brussow H,Hendrix RW.Phage genomics:Small is beautiful[J].Cell,2002,108(1):13-16.
[3]Bartual SG,Otero JM,Garcia-Doval C,et al.Structure of the bacteriophage T4long tail fiber receptor-binding tip [J].PNAS,2010,107(47):20287-20292.
[4]O’Flaherty S,Ross RP,Coffey A.Bacteriophage and their lysins for elimination of infectious bacteria [J].Fems Microbiol Rev,2009,33(4):801-819.
[5]Hanlon GW.Bacteriophages:An appraisal of their role in the treatment of bacterial infections[J].Int J Antimicrob Ag,2007,30(2):118-128.
[6]毛普加,洪 愉,冯 金,等.甲型副伤寒沙门菌噬菌体PSPA1感染宿主相关基因分析 [J].医学分子生物学杂志,2014,11(2):38-43.
[7]王 景,穆媛媛,黎 庶,等.革兰阴性菌基因敲除载体的构建及其应用 [J].第三军医大学学报,2009,31(23):2299-2301.
[8]Beck IA,Deng W,Payant R,et al.Validation of an oligonucleotide ligation assay for quantification of human immune A eficiency virus type 1drug-resistant mutants by use of massively parallel sequencing [J].J Art,2014,52(7):2320-2327.
[9]Stephen AS,Naughton DP,Pizzey RL,et al.In vitro growth characteristics and volatile sulfur compound production of Solobacterium moorei[J].Anaerobe,2014,26(1):53-57.
[10]Hossain MJ,Rahman KS,Terhune JS,et al.An outer membrane porin protein mAulates phage susceptibility in Edwardsiella ictaluri [J].Microbiology,2012,158(1):474-487.
[11]Sorensen MCH,van Alphen LB,Harboe A,et al.Bacteriophage F336recognizes the capsular phosphoramidate modification of campylobacter jejuni NCTC11168 [J].J Bacteriol,2011,193(23):6742-6749.
[12]Simon JL,Julie ES,Sylvain M.Bacteriophage resistance mechanism [J].Microbiol,2010,8(5):317-327.
[13]Zhang Z,Huang CW,Pan WH,et al.Intriguing arms race between phages and hosts andimplications for better antiinfectives[J].Crit Rev Eukar Gene,2013,23(3):215-226.
[14]Mohammad JH,Kh SR,Jeffery ST,et al.An outer membrane porin protein modulates phagesusceptibility in Edwardsiella ictaluri[J].Microbiology,2012,158(10):474-487.
[15]Young R.Phage lysis:three steps,three choices,one outcome[J].J Microbiol,2014,53(3):243-258.
[16]Høyland-Kroghsbo NM,Mærkedahl RB,Lo Svenningsen S,et al.A Quorum-sensing-induced bacteriophage defense mechanism [J].MBIO,2013,4(1):1-8.

