人参皂苷促进小鼠成骨细胞增殖的作用及机制
姚 曼,梁淑芳,程彬彬,凌昌全*
(第二军医大学长海医院中医肿瘤科,上海200433)
糖皮质激素(Glucocorticoid, GC)广泛应用于临床, 用于治疗多种慢性炎性及自身免疫性疾病。 然而长期应用糖皮质激素,常常会引起很多副作用,其中,糖皮质激素性骨质疏松症(Glucocorticoid-induced osteoporosis, GIOP)就是其最严重的副作用之一。 有研究表明,在接受GC 治疗超过6个月的患者中, 约有30%会发生骨质疏松症[1];而长期接受GC 治疗的成年患者中约有30%~50%发生骨质疏松性骨折[2],因此,积极防治GIOP 对临床长期接受GC 治疗的患者具有重要意义。
我们前期研究发现, 人参皂苷(Ginsenoside,GSS)能够拮抗糖皮质激素诱发的大鼠骨质疏松症[3]。鉴于对骨形成的抑制是GIOP 发生的关键作用机制,因此,我们在体外初步观察了对成骨细胞增殖的影响,并探讨了其作用机制。
1 实验材料
1.1 试验药物
人参总皂苷按报道的方法由第二军医大学药学院采用乙醇回流法提取[4],纯度>95%。 用DMSO 溶解后储存于-20 ℃。
1.2 细胞株
MC3T3-E1 小鼠成骨细胞系购自中科院上海细胞所。
1.3 试剂
αMEM 培养基购自Thermo Scientific 公司,二甲基亚砜购自美国AMRESCO 公司,胎牛血清购自法国Biowest 公司,MTT、 台盼蓝购自Sigma-Aldrich,蛋白凝胶试剂盒、Western 及IP 细胞裂解液(碧云天生物技术研究所, 货号:P0013B)、SYBR GREEN Realtime PCR Master Mix (TOYOBO、Code:QPK-201)、p21 抗体(No.#2947S)、p27 抗体(No.#3686S)、Cyclin D1 抗体 (No.#2978S) 均购自美国Cell Signaling Technology 公司。
2 方法
2.1 细胞培养
小 鼠MC3T3-E1 细 胞: 用 含 有10%FBS 的αMEM 完全培养基在37 ℃、 体积分数为5%的CO2、完全饱和湿度条件下常规培养,每48 h 更换培养基,细胞生长铺满培养瓶底80%后,用0.25%胰蛋白酶联合0.02%EDTA 消化传代,实验选用第3~5代对数生长期细胞。
2.2 MTT 法检测MC3T3-E1 小鼠成骨细胞增殖水平
取对数生长期的小鼠成骨细胞MC3T3-E1,胰酶消化后制备单细胞悬液, 以1 500 cell/孔接种于96 孔培养板中,每孔100 μL。 培养24 h 后,加入含有不同终浓度GSS(3.125~50 μg/mL)的αMEM 完全培养基,空白组加入含等体积DMSO 的αMEM 完全培养基,每孔100 μL,每组设置6个复孔。分别继续培养24、48、72 h 后, 每孔加入5 mg/mL 的MTT试剂10 μL,37 ℃培养箱培养4 h,弃孔内上清,加入DMSO 溶剂,150 μL/孔, 放于37 ℃恒温摇床中震荡10 min, 使沉淀充分溶解后, 置于酶标仪492 nm 上测定波长吸光度OD 值,按以下公式计算增殖率: 增殖率=(实验组OD 值-本底组OD 值)/(对照组OD 值-本底组OD 值)×100%
2.3 荧光定量RT-PCR 法检测细胞周期相关基因表达
取对数生长期的成骨细胞MC3T3-E1 接种于12 孔板,每孔体积1 mL。 培养24 h 后加入不同浓度的GSS,继续培养24 h。使用Trizol 试剂分别提取各组细胞总RNA,经紫外分光光度仪检测各组RNA浓度和纯度后,进行逆转录。以生成的cDNA 作为模板进行扩增反应, 采用SYBR GREEN Realtime PCR Master Mix (TOYOBO) 定量检测各组细胞内p21 和p27 mRNA 的表达水平。引物序列见表1。用内参进行标准化处理,按照2-ΔΔCт法对基因表达进行相对定量分析。
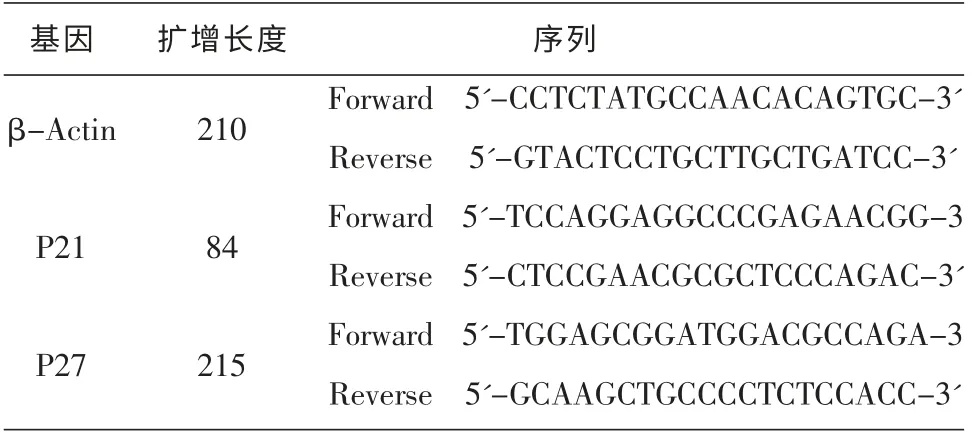
表1 引物序列
2.4 Western blotting 法检测蛋白表达
取对数生长期的成骨细胞MC3T3-E1 接种于6孔板,每孔体积2 mL。培养24 h 后加入不同浓度的GSS, 继续培养24 h 后提取总蛋白,BCA 法蛋白定量。 蛋白变性后进行聚丙烯酰胺凝胶电泳,转膜,将封闭后的PVDF 膜加入一抗(按1:1 000 稀释),4℃摇床孵育过夜依次加入辣根过氧化物酶标记的二抗(按1:2000 稀释),TBST 洗膜后,采用化学发光法进行显影, 以检测Cyclin D1 蛋白及细胞周期抑制蛋白p21 及p27 的表达水平。
2.5 统计学处理
3 结果
3.1 对MC3T3-E1 小鼠成骨细胞的影响
结果显示, 与空白对照组相比,3.125~50 μg/mL的GSS 在24、48 h 时均能够显著促进MC3T3-E1 细胞的增殖,差异具有统计学意义(P<0.01 或P<0.05),其作用具有时间依赖性和浓度依赖性。 而在GSS 作用72 h 后,仅6.25、12.5 及25 μg/mL 的GSS 组MC3T3-E1 细胞增殖率与空白对照组相比差异有统计学意义(P<0.01 或P<0.05)。 见表2。
表2 GSS 对小鼠成骨细胞MC3T3-E1 增殖率(%)的影响(±s)

表2 GSS 对小鼠成骨细胞MC3T3-E1 增殖率(%)的影响(±s)
注:与空白对照组比较*P<0.05, **P<0.01。 下表同。
组别Control GSS (50 μg/mL)GSS (25 μg/mL)GSS (12.5 μg/mL)GSS (6.25 μg/mL)GSS (3.125 μg/mL)GSS (1.57 μg/mL)24 h 100.0±1.3 109.6±2.3**105.9±2.2*105.9±4.9*106.8±1.6**105.5±1.6**98.7±0.9 48 h 100.0±0.7 115.3±3.3**117.3±4.0**114.7±7.0**112.8±2.1**110.8±1.1**103.3±1.3 72 h 100.0±5.4 103.0±4.0 107.2±2.7*112.7±6.2**105.4±2.1*108.9±7.1 101.0±4.2
3.2 GSS 对p21 和p27 mRNA 表达水平的影响
结果显示,50 和25 μg/mL 的GSS 能够显著抑制p21 和p27 的mRNA 表达,与空白对照组相比差异有统计学意义(P<0.01)。而12.5 μg/mL 的GSS 对p21 和p27 的mRNA 表达水平无明显下调, 与空白对照组相比差异无统计学意义(P>0.05)。 见表3。
表3 GSS 对p21 和p27 mRNA 表达水平的影响(n=3,±s)
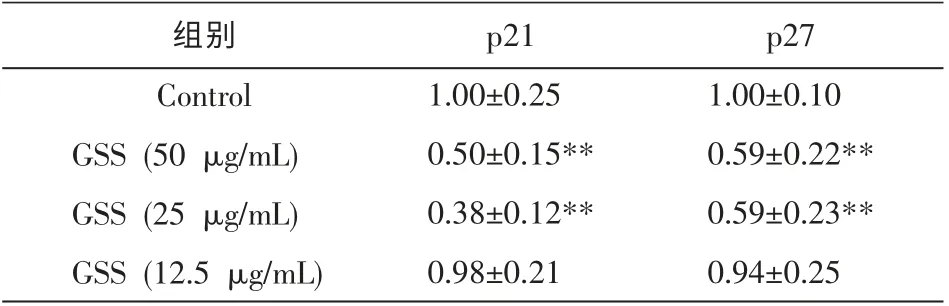
表3 GSS 对p21 和p27 mRNA 表达水平的影响(n=3,±s)
组别Control GSS (50 μg/mL)GSS (25 μg/mL)GSS (12.5 μg/mL)p21 1.00±0.25 0.50±0.15**0.38±0.12**0.98±0.21 p27 1.00±0.10 0.59±0.22**0.59±0.23**0.94±0.25
3.3 对细胞周期相关蛋白表达的影响
结果显示,50、25 μg/mL 的GSS 处理MC3T3-E1 细胞24 h 后, 细胞周期抑制蛋白p21 及p27 表达水平较空白对照组显著下降(P<0.01 或0.05),而Cyclin D1 表达显著上调(P<0.01)。但12.5 μg/mL 的GSS 对P21、P27 及Gyclin D1 蛋白表达较空白对照但比较均无统计学意义(P>0.05)。 见图1-2,表4。
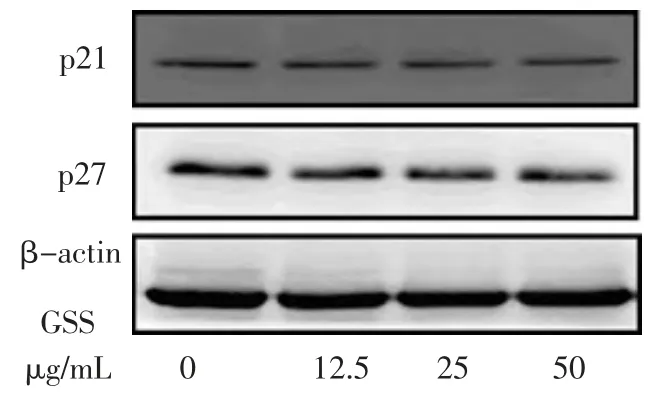
图1 不同浓度GSS 对周期抑制蛋白p21 和p27 表达的影响
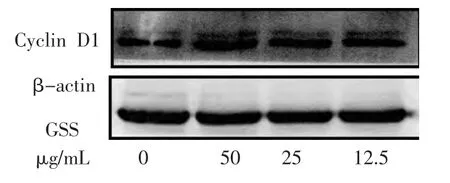
图2 不同浓度GSS 对Cyclin D1 表达的影响
表4 GSS 对p21、p27 及Cyclin D1 蛋白表达水平的影响 (n=3,±s)
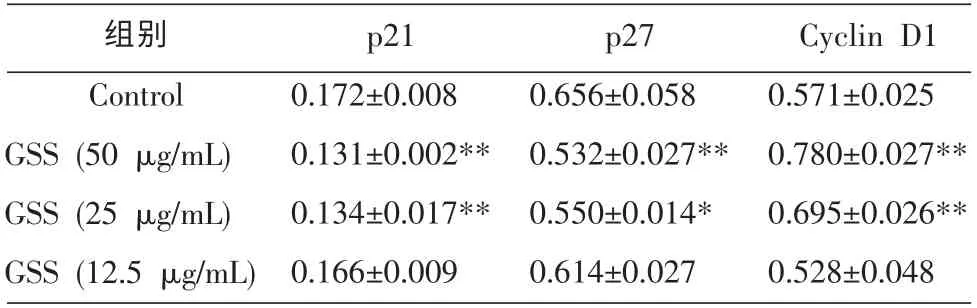
表4 GSS 对p21、p27 及Cyclin D1 蛋白表达水平的影响 (n=3,±s)
组别Control GSS (50 μg/mL)GSS (25 μg/mL)GSS (12.5 μg/mL)p21 0.172±0.008 0.131±0.002**0.134±0.017**0.166±0.009 p27 0.656±0.058 0.532±0.027**0.550±0.014*0.614±0.027 Cyclin D1 0.571±0.025 0.780±0.027**0.695±0.026**0.528±0.048
4 讨论
GC 的生理和药理作用主要是通过其受体(Glucocorticoid receptor,GR)发挥的。 GC 与GR 结合后形成GC-GR 二聚体,GC-GR 二聚体转移到核内发挥转录激活或转录抑制作用[5]。 研究显示:药理剂量的GC 使骨髓基质干细胞向成骨细胞的分化过程受损,抑制成骨细胞的增殖和分化成熟,进而导致骨形成明显减少[6]。 此外,GC 还能够通过促进成骨细胞凋亡导致骨形成减少[7]。 总之,GC 通过抑制成骨细胞增殖和分化,促进骨细胞的凋亡,减少骨形成;并促进破骨细胞分化,增加骨吸收,最终导致GIO 的发生[8]。
因此,我们首先观察了GSS 对成骨细胞增殖的作用。 结果显示,GSS 作用不同时间后,小鼠成骨细胞增殖率显著增加, 且与作用时间药物浓度在一定范围内呈正相关。 人参是祖国医学中的一味传统中药,具有“大补元气,复脉固脱,补脾益肺,生津,安神”功效。 我科前期的研究发现:GSS 能够增强地塞米松的临床疗效, 联合地塞米松可以更好地防治TACE 术后综合征[9],还能够显著提高系统性红斑狼疮的临床治疗效果,减少激素的用量[10]。在动物实验中, 我科之前的研究也发现GSS 可通过改善骨代谢,拮抗糖皮质激素性骨质疏松大鼠的骨丢失[3]。 结合我们的研究结果提示:促进成骨细胞增殖可能是GSS 发挥抗GIOP 作用的重要分子机制。
调控成骨细胞增殖的是一个复杂而又相互联系的网络,包含多种信号转导通路和细胞因子。 细胞生长依靠细胞周期的运行,受细胞核内的细胞周期调节蛋白调控。 细胞周期调控蛋白分为正向周期调控蛋白和负向周期调控蛋白,分别促进/抑制细胞周期运行。 p21 和p27 均属于细胞周期蛋白激酶抑制剂中Cip/Kip 家族成员, 发挥抑制细胞增殖的作用[11]。 在正常细胞中,p21 和p27 可以通过结合抑制Cyclin-CDKs 复合体的活性, 导致细胞周期阻滞在G1/S 期,从而抑制细胞增殖。 我们的研究发现,50、及25 μg/mL 的GSS 处理MC3T3-E1 细胞24 h 后,细胞周期抑制蛋白p21 及p27 表达水平较空白对照组显著下降;而12.5 μg/mL 的GSS 处理MC3T3-E1细胞24 h 后,p21 及p27 蛋白及mRNA 表达水平较空白对照无明显改变, 提示GSS 低浓度时可能对RNA 表达水平无明显影响,但可能能够在翻译水平上影响p21 及p27 的表达,或促进p21 及p27 的降解。 Cyclin D1 是细胞周期的正调控因子,其通过使Rb 蛋白磷酸化,促使细胞由G1 期进入S 期,引起细胞增殖[12]。 我们的结果表明,GSS 能够显著上调Cyclin D1 表达水平, 进而促进细胞G1 期进入S期,进而促进细胞增殖。
本研究的结果显示,GSS 能够通过上调Cyclin D1 表达,抑制p21 和p27 表达,进而促进小鼠成骨细胞增殖,提示促进成骨细胞增殖可能是GSS 发挥抗GIOP 作用的分子机制之一。
[1]Bultink IE, Baden M, Lems WF. Glucocorticoid-induced osteoporosis: an update on current pharmacotherapy and future directions [J]. Expert Opin Pharmacother, 2013, 14(2): 185-197.
[2]Canalis E, Mazziotti G, Giustina A, et al. Glucocorticoid-induced osteoporosis: pathophysiology and therapy [J]. Osteoporos Int, 2007, 18(10): 1 319-1 328.
[3]吕祥, 杜娟, 程彬彬, 等. 人参皂苷抗糖皮质激素诱发骨质疏松的效应及机制研究[J]. 世界中医药, 2012, 7(2): 166-168.
[4]张玲, 单卫华, 梁瑞雪, 等. 人参提取工艺研究[J]. 时珍国医国药, 2000, 11(9): 777-779.
[5]Nicolaides N C, Galata Z, Kino T, et al. The human glucocorticoid receptor: molecular basis of biologic function [J]. Steroids, 2010,75(1): 1-12.
[6]Schacke H, Docke WD, Asadullah K. Mechanisms involved in the side effects of glucocorticoids [J]. Pharmacol Ther, 2002, 96(1): 23-43.
[7]Liu W, Fan Z, Han Y, et al. Activation of NF-kappaB signaling pathway in HSV-1-induced mouse facial palsy: Possible relation to therapeutic effect of glucocorticoids [J]. Neuroscience,2015, 289: 251-261.
[8]Chmielnicka M, Wozniacka A, Torzecka JD. The influence of corticosteroid treatment on the OPG/RANK/RANKL pathway and osteocalcin in patients with pemphigus [J]. Postepy Dermatol Alergol, 2014, 31(5): 281-288.
[9]封颖璐, 凌昌全, 陈喆, 等. 人参皂苷联合地塞米松防治经动脉化疗栓塞术后肝肾功能损伤的前瞻性研究[J]. 中华肿瘤杂志,2006, 28(11): 844-847.
[10]尤艳利, 封颖璐, 蔡青, 等. 人参皂苷联合强的松治疗系统性红斑狼疮的前瞻性随机双盲对照试验[J]. 中西医结合学报,2010, 8(8): 762-766.
[11]Orlando S, Gallastegui E, Besson A, et al. p27Kip1 and p21Cip1 collaborate in the regulation of transcription by recruiting cyclin-Cdk complexes on the promoters of target genes [J]. Nucleic Acids Res, 2015,43(14):6 860-6 873.
[12]Zheng X, Wang Y, Liu B, et al. Bmi-1-shRNA inhibits the proliferation of lung adenocarcinoma cells by blocking the G1/S phase through decreasing cyclin D1 and increasing p21/p27 levels [J]. Nucleic Acid Ther, 2014, 24(3): 210-216.

