脱细胞半月板细胞外基质对半月板细胞的影响
郭维民,刘舒云,高钺,黄靖香,彭江,汪爱媛,王玉,卢世璧,郭全义
脱细胞半月板细胞外基质对半月板细胞的影响
郭维民,刘舒云,高钺,黄靖香,彭江,汪爱媛,王玉,卢世璧,郭全义
目的 探讨脱细胞半月板细胞外基质(dMECM)对传代半月板细胞增殖、细胞活性以及细胞表型的影响。
方法 用 CCK-8 法检测 dMECM 对半月板细胞增殖的影响;将 P3代的内侧半月板纤维软骨细胞种植在 dMECM修饰盖玻片上,以未修饰盖玻片为对照,体外培养 7、14 d后进行细胞活性检测,糖胺多糖、胶原分泌含量测定并用RT-PCR 检测半月板细胞特异性基因 mRNA 表达变化。
结果 CCK-8 结果证实,与对照组比较,生长在 dMECM修饰盖玻片上的 P3代兔半月板纤维软骨细胞具有更好的细胞增殖特性(P < 0.05);细胞死/活染色结果证实 dMECM组可维持更好的细胞活性;糖胺多糖和胶原定量检测结果证实 dMECM 组在第 7、14 天时,比对照组分泌更多的糖胺多糖和胶原(P < 0.05)。RT-PCR 的检测结果证实体外培养7、14 d 时,dMECM 组 II 型胶原 mRNA 表达显著上调(P < 0.05)。
结论 dMECM 可以很好地促进半月板纤维软骨细胞的增殖、分化以及细胞活性的维持,可能是未来半月板组织工程领域非常有前景的支架材料之一。
细胞外基质; 关节半月板; 组织工程; 生物相容性材料; 脱细胞; 纤维软骨细胞
半月板损伤是膝关节的常见损伤之一。因半月板内侧区域无神经、血管,若发生损伤,往往难以自愈,倾向于永久性的创伤后退变[1]。半月板组织工程技术给半月板损伤治疗带来了新的希望[2]。一般而言,半月板组织工程主要由种子细胞、支架、生物学或生物力学刺激三部分构成[3]。在半月板支架材料领域,采用脱细胞技术制备的细胞外基质(extracellular matrix,ECM)生物材料,因其可以有效去除移植免疫源性物质,保留 ECM 成分及其生物活性物质而受到了广泛关注[4]。ECM 支架材料类似于天然半月板的细胞外基质成分,与其他传统材料相比,具有为种子细胞提供生长、分化的天然微环境的优越性,有利于更好地构建组织工程半月板。前期我们实验室尝试通过纯物理的方法(湿法粉碎、差速离心)制备新型的脱细胞半月板细胞外基质(decellularized meniscal extracellular matrix,dMECM)材料。实验结果证实,dMECM 可以很好地保留半月板天然的细胞外基质成分,去除细胞核物质,仿生细胞生长的微环境[5]。为进一步探索dMECM 作为半月板组织工程支架材料的可行性,本实验将考察传代半月板纤维软骨细胞在 dMECM上的细胞活性、细胞表型、胶原含量以及特异性基因 mRNA 表达变化。
1 材料与方法
1.1 材料
1.1.1 主要试剂 DMEM 培养基、0.2% 的 II 型胶原酶、0.25% 胰蛋白酶、死/活细胞染色试剂盒均购自美国 Sigma 公司;胎牛血清(FBS)购自美国Gibco 公司;“三抗”(青霉素、链霉素、两性霉素)和 DEPC 水购自上海碧云天公司生物技术研究所;CCK-8 检测试剂盒购自日本 Dojindo 公司;细胞 GAG 含量 DMMB 法检测试剂盒购自美国GenMed Scientifics Inc 公司;羟脯氨酸测试试剂盒购自南京建成科技公司;氯仿、异丙醇购自北京化学试剂有限公司;TRIzol 购自美国 Life Technologies公司;ReverTra Ace® qPCR RT Master Mix、SYBR Green 购自日本 Toyobo 公司;兔半月板细胞特异性引物购自北京 Parkson 公司。
1.1.2 仪器 Allegra X-22R 型低温高速离心机和 DU640 型紫外分光光度计购自美国 Beckman公司;85-2 型恒温磁力搅拌器购自江苏常州国华仪器公司;BB5060 型 CO2培养箱购自德国 Heraeus公司;IX 70 型荧光显微镜购自日本 Olympus 公司;Epoch Take 3 酶标仪购自美国 Bio Tek公司;RT-PCR 仪购自美国 Applied Biosystems 公司。
1.1.3 实验动物 新鲜猪关节购自北京市屠宰场,共购取 10 月猪龄的 20 个膝关节;2.5 月龄的健康新西兰白兔 8 只,雌雄不限,体重 2.5 kg,购自解放军总医院实验动物中心。所有动物实验方案均经解放军总医院伦理委员会批准。
1.2 方法
1.2.1 脱细胞半月板细胞外基质及其修饰盖玻片的制备 脱细胞半月板细胞外基质及其修饰盖玻片的制备参照文献[5],所有操作均在超净台内进行。
1.2.2 内侧半月板细胞分离培养及传代 取新西兰大白兔,分离内侧半月板细胞,消化、培养、传代方法参见文献[5],取 P3代细胞用于实验。
1.2.3 细胞增殖试验 用 CCK-8 法测定 dMECM对半月板细胞增殖特性的影响。首先包被 96 孔板,实验组每孔加入 62 μl 1 mg/ml 的 dMECM,对照组每孔加入 62 μl 无菌三蒸水,在室温下风干。所有步骤均在超净台下操作。将 200 μl P3代的兔半月板纤维软骨细胞悬液(2.5 × 103个)加入96 孔板内,置于 37 ℃、5% CO2培养箱内生长。第 1、3、6 天时,在需测量的实验组和对照组(每组 6 孔)分别加入 20 μl CCK-8 试剂,37 ℃、5% CO2培养箱内孵育 2.5 h 后用酶标仪测量 450 nm处的 OD 值。
1.2.4 死/活细胞染色 将 P3代的兔半月板纤维软骨细胞胰酶消化,Hanks 平衡液充分洗涤,制备成 3 × 104/ml 的细胞悬液,接种于含 dMECM 修饰盖玻片的六孔板内,每孔 1 ml。将六孔板置于37 ℃、5% CO2培养箱孵育 30 min,确保细胞黏附。然后每孔添加 2 ml 含 10% FBS 的 DMEM 培养液,继续 37 ℃、5% CO2培养箱培养,每周更换两次细胞培养液。
将体外培养 7、14 d 的半月板细胞/dMECM修饰盖玻片复合物取材(每组随机选取 5 个样本),无菌 PBS 溶液清洗 2 次;将复合物用浓度为 5 × 10-3mg/ml 的二乙酸荧光素(FDA)室温、黑暗条件下孵育 5 min;去除 FDA,无菌 PBS溶液清洗 2 次;使用浓度为 5 × 10-3mg/ml 的 PI 室温、黑暗条件下孵育 5 min;去除 PI,无菌 PBS 溶液清洗 2 次,荧光显微镜观察。
1.2.5 糖胺多糖的测定 用细胞刮勺将体外培养7、14 d 的半月板细胞/dMECM 修饰盖玻片复合物收集取材(每组随机选取 5 个样本)。糖胺多糖(glycosaminoglycan,GAG)的测定采用 DMMB法,所有的实验步骤依照细胞 GAG 含量 DMMB法检测试剂盒的实验说明进行检测。
1.2.6 胶原含量的测定 用细胞刮勺将体外培养7、14 d 的半月板细胞/dMECM 修饰盖玻片复合物收集取材(每组随机选取 5 个样本)。胶原含量的测定采用羟脯氨酸法,所有的实验步骤依照羟脯氨酸测试试剂盒的实验说明进行检测。
1.2.7 特异性基因 mRNA 表达变化的 RT-PCR检测 收集 P3代半月板细胞,体外培养 7、14 d的半月板细胞/dMECM 修饰盖玻片复合物(每组随机选取 5 个样本)。然后使用 TRIzol 提取 RNA,反转录获取 cDNA。构建含有 1 μl cDNA 的 20 μl RT-PCR 的反应体系,其中还包括 SYBR Green Realtime PCR Master Mix-Plus 和特异性的引物(表 1)。将 20 μl PCR 反应体系首先 95 ℃ 预变性 2 min;95 ℃ 变性 15 s,55 ℃ 退火 30 s,72 ℃延伸 30 s,共循环 40 次。
实验所需兔半月板细胞特异性引物根据 NCBI 和 PubMed 发表的基因序列设计。并选择 GAPDH作为内标。样本的 mRNA 基因表达量根据相应的GAPDH 使用 2-△△CT的方法进行标准化计算。
1.3 统计学处理

表1 RT-PCR 实验所使用的主要目的基因序列Table 1 Primer sequences of target genes used for RT-PCR
2 结果
2.1 dMECM 对半月板细胞增殖的影响
CCK-8 测试细胞增殖实验结果显示,dMECM组和对照组随着时间的推移,细胞数量都呈现不断增加的趋势(图 1)。结果表明,第 1 天 dMECM组和对照组细胞增殖没有差异(P > 0.05);第 3 天和第 6 天 dMECM 组的细胞增殖率要高于对照组,且存在统计学差异(P < 0.05)。
2.2 半月板细胞/dMECM 修饰盖玻片复合物细胞活性观察
传代的纤维软骨细胞在不同的修饰盖玻片组呈现不同的细胞活性。体外培养 7 d 时,与空白对照组(图 2A)比较,可见 dMECM 组(图 2B)存在更多的活细胞(绿色荧光点),未见明显死细胞。体外培养 14 d 时,可见空白对照组(图 2C)和 dMECM 组(图 2D)活细胞数无明显差异。
2.3 GAG 含量测定结果
DMMB 法测定细胞 GAG 含量的实验结果显示,dMECM 组和对照组随着时间的推移,细胞分泌的 GAG 含量都呈现不断增加的趋势(图 3)。培养 7、14 d 的实验结果表明 dMECM 组所分泌的 GAG 含量均要高于对照组,且存在统计学差异(P < 0.05)。
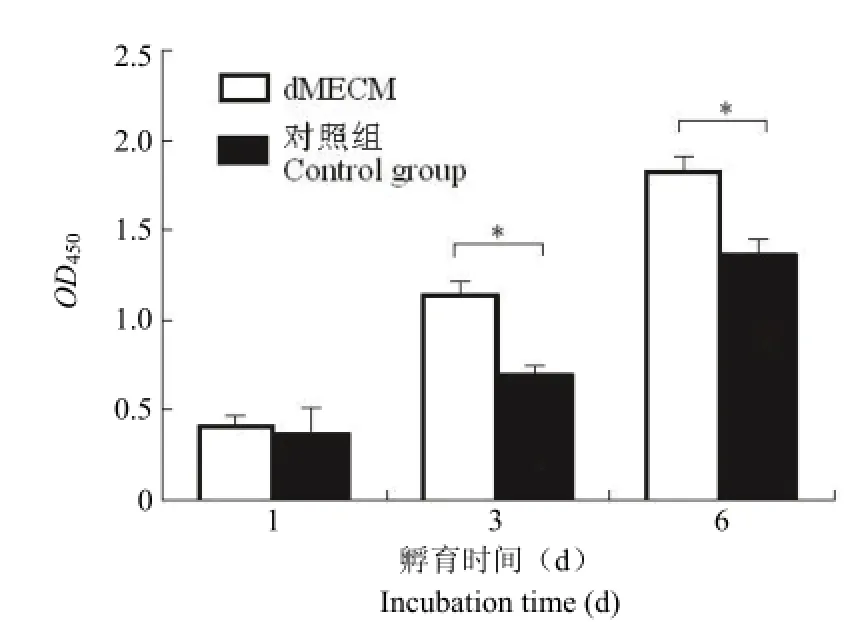
图1 dMECM 对半月板细胞增殖影响的 CCK-8 实验结果(*P < 0.05)Figure 1 The cell proliferation characteristics of dMECM was assessed using CCK-8 assay (*P < 0.05)
2.4 胶原含量测定结果
羟脯氨酸法测定细胞胶原含量的实验结果显示,dMECM 组和对照组随着时间的推移,细胞分泌的胶原含量都呈现不断增加的趋势(图 4)。7、14 d dMECM 组所分泌的胶原含量均显著高于对照组(P < 0.05)。
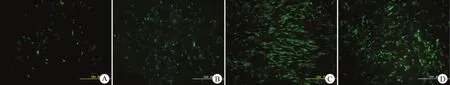
图2 半月板细胞/dMECM 修饰盖玻片复合物 7、14 d 时死/活细胞染色观察(A:对照组 7 d;B:dMECM 组 7 d;C:对照组 14 d;D:dMECM 组 14 d)Figure 2 Live/dead cell staining of the meniscal fibrochondrocytes/growth surfaces constructs culturing in vitro 7 and 14 d (A:Control group in 7 d; B: dMECM group in 7 d; C: Control group in 14 d;D: dMECM group in 14 d)
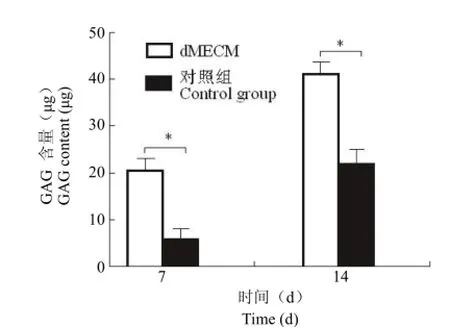
图3 GAG 含量的测定结果(*P < 0.05)Figure 3 The cell GAG content examination results (*P <0.05)
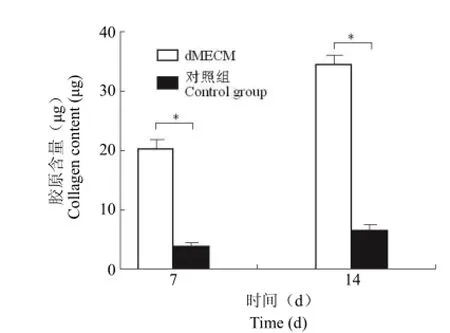
图4 胶原含量的测定结果(*P < 0.05)Figure 4 The cell collagen content examination results (*P <0.05)
2.5 特异性基因表达变化的 RT-PCR 检测
RT-PCR 检测了 dMECM 组和对照组 I、II 型胶原 mRNA 表达水平相对于 P3代半月板细胞表达水平的变化结果。结果显示在体外培养 7、14 d 后,dMECM 组和对照组 I 型胶原 mRNA的表达未见显著性差异(图 5)。体外培养 7、14 d后,dMECM 组 II 型胶原 mRNA 表达显著上调(图 6)。体外培养 7 d 时,dMECM 组 II 型胶原 mRNA 表达上调了 5.6 倍(P < 0.05)。体外培养 14 d 时,dMECM 组 II 型胶原 mRNA 表达继续上调,增加了 10.8 倍(P < 0.05)。
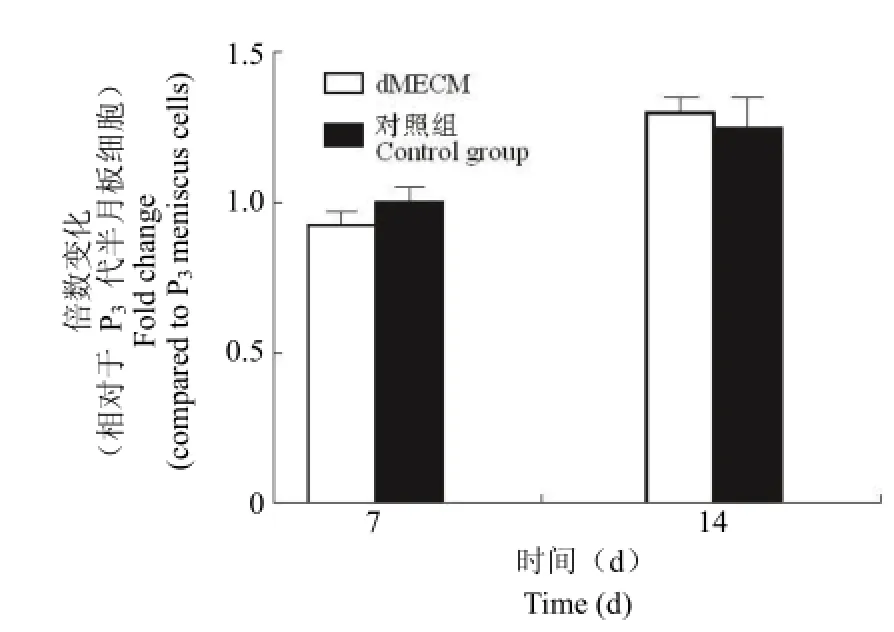
图5 I 型胶原 mRNA 表达变化的 RT-PCR 测定结果Figure 5 The type I collagen mRNA expression results
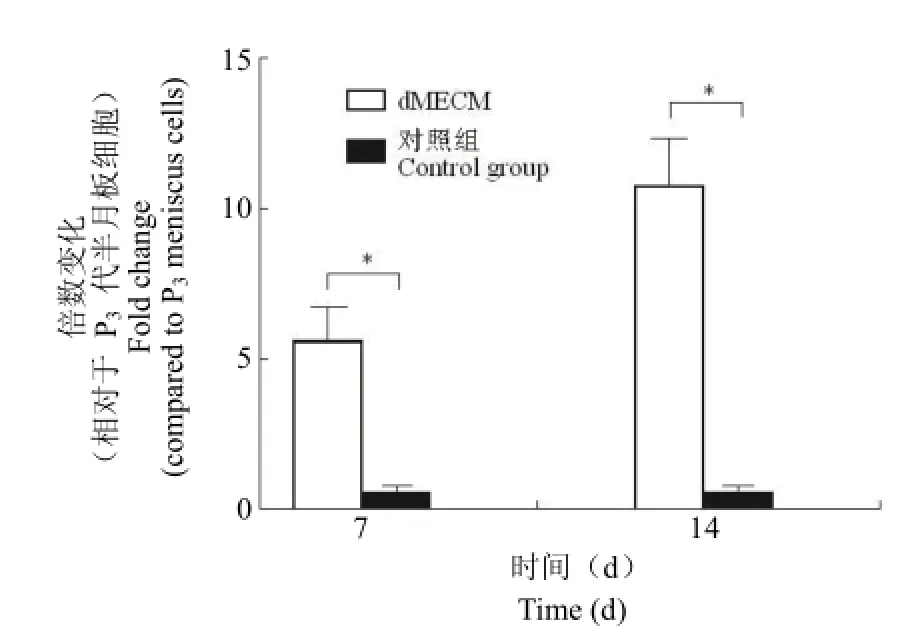
图6 II 型胶原 mRNA 表达变化的 RT-PCR 测定结果(*P < 0.05)Figure 6 The type II collagen mRNA expression results (*P <0.05)
3 讨论
半月板内侧无血供区域再生困难,组织工程技术给内侧损伤的修复带来了新的希望。为成功构建组织工程半月板,选择合适的支架材料至关重要。近年来采用脱细胞技术制备的 ECM 支架材料受到了广泛的关注。ECM 材料相比于可吸收的多聚合成材料,具有更好的细胞相容性及生物活性特征。半月板纤维软骨细胞是半月板组织工程领域中重要的种子细胞之一。但是和软骨细胞类似,半月板纤维软骨细胞在体外扩增过程中增殖较慢,且容易出现去分化的现象[6-9]。
CCK-8 结果证实,与对照组相比较,dMECM组更能促进细胞的增殖。我们考虑 dMECM 内可能含有某些潜在的有利于细胞增殖的细胞因子或多肽物质。另外,细胞活性检测也发现,dMECM 修饰盖玻片可以很好地维持细胞生长的活性,无细胞毒性作用。GAG 的定量测定结果也证实在第 7、14 天时,dMECM 组比对照组可以分泌更多的GAG 成分,说明 dMECM 可以很好地促进半月板细胞的分化,进而使细胞分泌更多的 GAG。
生长在 dMECM 组的半月板细胞可见 II 型胶原 mRNA 表达的上调,说明半月板细胞在dMECM 修饰盖玻片上发生了再分化,因为 II 型胶原是半月板 ECM 的重要组成成分,对维持半月板正常结构起了巨大的作用,而且它还和骨关节的预防密切相关[10-12]。dMECM 组的半月板细胞 II型胶原 mRNA 表达的上调支持其相应的 7、14 d胶原含量明显增加的结果。
dMECM 对传代半月板细胞有促增殖、维持其细胞活性及再分化的作用。不可否认,这与dMECM 能够很好的仿生天然半月板生长的微环境密切相关。潜在的作用机制可能与细胞-基质之间的相互作用有关,需要我们进一步探索。总之,dMECM 具有促进半月板细胞的增殖、分化以及细胞活性维持的潜能,是未来半月板组织工程领域理想的支架材料之一。
[1]Arnoczky SP, Warren RF. Microvasculature of the human meniscus. Am J Sports Med, 1982, 10(2):90-95.
[2]Wu PF, Deng L, Gu WG. The advance in meniscal injuries and repairing. Orthop J China, 2011, 19(20):1706-1709. (in Chinese)
吴鹏飞, 邓亮, 谷文光. 半月板损伤与修复研究进展. 中国矫形外科杂志, 2011, 19(20):1706-1709.
[3]Langer R, Vacanti JP. Tissue engineering. Science, 1993, 260(5110):920-926.
[4]Gilbert TW, Sellaro TL, Badylak SF. Decellularization of tissues and organs. Biomaterials, 2006, 27(19):3675-3683.
[5]Guo WM, Liu SY, Gao Y, et al. The preparation of a new type of decellularized meniscal extracellular matrix and its biocompatibility. Chin Med Biotechnol, 2015, 10(1):5-10. (in Chinese)
郭维民, 刘舒云, 高钺, 等. 新型脱细胞半月板细胞外基质的制备及其生物相容性的研究. 中国医药生物技术, 2015, 10(1):5-10.
[6]Zaucke F, Dinser R, Maurer P, et al. Cartilage oligomeric matrix protein (COMP) and collagen IX are sensitive markers for thedifferentiation state of articular primary chondrocytes. Biochem J,2001, 358 (Pt 1):17-24.
[7]Schnabel M, Marlovits S, Eckhoff G, et al. Dedifferentiationassociated changes in morphology and gene expression in primary human articular chondrocytes in cell culture. Osteoarthritis Cartilage,2002, 10(1):62-70.
[8]Tan GK, Dinnes DL, Butler LN, et al. Interactions between meniscal cells and a self assembled biomimetic surface composed of hyaluronic acid, chitosan and meniscal extracellular matrix molecules. Biomaterials, 2010, 31(23):6104-6118.
[9]Tan GK, Dinnes DL, Myers PT, et al. Effects of biomimetic surfaces and oxygen tension on redifferentiation of passaged human fibrochondrocytes in 2D and 3D cultures. Biomaterials, 2011,32(24):5600-5614.
[10]Stoop R, van der Kraan PM, Buma P, et al. Type II collagen degradation in spontaneous osteoarthritis in C57Bl/6 and BALB/c mice. Arthritis Rheum, 1999, 42(11):2381-2389.
[11]Kambic HE, McDevitt CA. Spatial organization of types I and II collagen in the canine meniscus. J Orthop Res, 2005, 23(1):142-149.
[12]Wojtys EM, Chan DB. Meniscus structure and function. Instr Course Lect, 2005, 54:323-330.
Methods The novel dMECM biomaterial was prepared using waterproof pulverization and differential centrifugation approach. CCK-8 was used to quantitatively evaluate the cell proliferation of dMECM. The rabbit inner meniscus fibrochondrocytes (P3) were seeded in the dMECM modified growth surface in order to compare with the untreated growth surface (control group). The cell activity was observed by live/dead staining after 7, 14 d culture, the GAG and collagen content werer determined according to kits,and RT-PCR analysis was used to evaluate mRNA expression level of collagens.
Results CCK-8 results demonstrated cells proliferation capacity in dMECM group was significantly more potent than that in the control group at 3, 6 d (P < 0.05). In comparison with the control group, the live/dead staining results confirmed dMECM surface maintained favorable cell activity. GAG and collagen content assessment results revealed that the fibrochondrocytes in the dMECM group secreted significantly more GAG and collagen than that in the control group at 7, 14 d (P < 0.05). RT-PCR results showed that the expression of type II collagen mRNA was significantly up-regulated than the dMECM group at 7, 14 d (P < 0.05).
Conclusion dMECM enhances the cellular proliferation, viability and redifferentiation of the rabbit passaged meniscal fibrochondrocytes, which shows that dMECM may be one of the ideal candidate biomaterial for meniscal tissue engineering applications in future.
The effect of decellularized meniscal extracellular matrix on meniscal fibrochondrocytes
GUO Wei-min, LIU Shu-yun, GAO Yue, HUANG Jing-xiang, PENG Jiang, WANG Ai-yuan, WANG Yu, LU Shi-bi, GUO Quan-yi
Objective We explore the effect of porcine decellularized meniscal extracellular matrix (dMECM) on the proliferation, cell activity and redifferentiation of the rabbit passaged meniscal fibrochondrocytes.
Extracellular matrix; Semilunar cartilages; Tissue engineering; Biocompatible materials; Decellularization;Fibrochondrocytes
GUO Quan-yi, Email: doctorguo@163.com
10.3969/cmba.j.issn.1673-713X.2015.03.005
国家自然科学基金(81472092);国家高技术发展研究计划(863 计划)(2012AA020502)
100853 北京,解放军总医院骨科研究所
郭全义,Email:doctorguo@163.com
2015-03-12
www.cmbp.net.cn 中国医药生物技术, 2015, 10(3):218-222
Author Affiliation: Institute of Orthopaedics, Chinese PLA General Hospital, Beijing 100853, China
www.cmbp.net.cn Chin Med Biotechnol, 2015, 10(3):218-222

