补肾调周法对超排卵周期颗粒细胞CYP19A1 mRNA表达的影响Δ
何 珊,常 宏,刘大艳,邓少洁,樊丹怡(.南方医科大学附属深圳市妇幼保健院药剂科,广东 深圳 58028;2.南方医科大学附属深圳市妇幼保健院生殖医学科,广东深圳 58028)
目前,全球不孕症的发病率逐年升高,体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)是目前不孕症的最主要治疗手段之一。在“肾主生殖”的中医基础理论的指导下,把补肾益精为基础的中医治疗思想引入IVF技术的各个环节中,通过控制性超排卵(controlled ovarian hyperstimulation,COH)技术获得多个优质卵子是IVF成功的关键,补肾调周法在协同COH方面起着重要作用,但具体作用机制尚不明确[1-2]。CYP19基因是芳香化酶P450(P450arom)的编码基因,P450arom使雄烯二酮转化为雌二醇(E2),可刺激自身受体及黄体生成素受体的合成,在卵泡募集的过程中起着关键作用,也是卵巢内部局部调节机制中的重要因素之一[3]。目前还未见补肾调周法通过影响CYP19A1的表达而调节卵巢微环境及卵泡发育的报道。本研究观察了补肾调周法对COH患者体内卵巢颗粒细胞CYP19A1 mRNA表达的影响,从分子生物学水平探讨中医补肾调周法对卵泡生长、发育、成熟的作用机制,并为验证此法的有效性提供科学、客观的试验依据。
1 资料与方法
1.1 资料来源
选择2014年4—6月在深圳市妇幼保健院生殖医学中心因输卵管因素不孕接受IVF-ET治疗的患者80例,按随机数字表法分为2组:治疗组(育泡组方联合COH治疗)12例,其中2例患者未按规定用药,退出研究;对照组(COH治疗)12例,有1例降调后妊娠,取消周期。本研究经医院医学伦理委员会批准,患者及家属签署知情同意书。
1.2 诊断标准
中医肾虚证不孕的辨证标准:(1)月经量少或质稀;(2)腰骶酸痛;(3)胫酸膝软或足跟痛;(4)头晕耳鸣;(5)性欲淡漠;(6)两尺脉沉迟缓[4]。以上6条具备3条即可诊断。西医诊断标准:符合输卵管性不孕的诊断标准[1]。
1.3 纳入与排除标准
纳入标准:符合西医输卵管性不孕的诊断标准;符合中医肾虚辨证标准;男方精液检查正常;年龄≤35岁;卵巢储备功能正常;子宫内膜厚度≥8 mm、首次接受 IVF-ET[5]。排除标准:患有先天性生理缺陷或畸形;子宫内膜异位症、子宫腺肌病、子宫内膜息肉等内膜病变、子宫发育不良等;多囊卵巢综合征;输卵管积水;遗传和免疫因素等所致不孕;对研究药物过敏者。
1.4 方法
1.4.1 治疗方法:治疗组10例患者给予育泡组方(主要由补肾益精类中药组成,包括紫河车、菟丝子、熟地黄、枸杞子、当归等)联合COH治疗;对照组11例患者给予COH治疗。
1.4.2 仪器与试剂:超速低温离心机(美国Beckman Coulter公司),Thermo 702型超低温冰箱(美国 Thermo公司),EPS-300型电泳仪(上海天能科技有限公司),Bio-Rad Mycycler PCR仪、凝胶成象系统(美国Bio-Rad公司);Trizol试剂(美国SIGMA公司),逆转录-聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)所需试剂购自美国Invitrogen公司,引物合成购自南京金思瑞生物技术公司。
1.4.3 COH方案:采用黄体期长方案进行COH治疗。在治疗前一周期的黄体中期给予长效促性腺激素释放激素激动剂进行降调节,当达到完全降调节时,开始给予注射重组型卵泡刺激素(recombinant FSH,rFSH)。通过B型超声检查和血E2的测定,监测卵泡发育情况,调整rFSH的剂量。当B超监测优势卵泡直径≥18 mm,或有2个卵泡直径≥17 mm时,注射人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG)5000~10000 IU,促使卵泡成熟。34~36 h后,在静脉麻醉状态、B超引导下进行穿刺取卵术,并立即在显微镜下取出卵细胞,移至含胚胎培养液的培养皿中,置37℃培养箱中培养。
1.4.4 分离颗粒细胞:将取卵后的卵泡液经2000 r/min离心10 min,去上清液。细胞沉淀物用磷酸盐缓冲液配成悬液,以1∶1(V∶V)的比例将细胞悬液缓慢加入淋巴细胞分离液上。以2000 r/min离心30 min,吸取颗粒细胞层,用红细胞裂解液洗涤、溶解红细胞。最后,经磷酸盐缓冲液洗涤去除红细胞裂解液,用Trizol试剂分离蛋白,置-80℃冰箱保存。
1.4.5 半定量RT-PCR法测定CYP19A1 mRNA的表达:应用半定量RT-PCR技术检测卵巢低反应组、正常反应组和高反应组颗粒细胞中CYP19A1 mRNA的表达,颗粒细胞总RNA的提取、mRNA逆转录成cDNA(第一链的合成)采用试剂盒,严格按照说明书操作。PCR反应体系:ddH2O 3.6 μl,2×PCR Mix 5 μl,Primerl 0.2 μl,Primer20.2 μl,cDNA 1 μl;PCR 循环参数:30个循环完成,94℃充分变性4.5 min,54℃退火40 s以及72℃延伸40 s,结束循环后再72℃充分延伸7 min;PCR产物行琼脂糖凝胶电泳,用凝胶成像系统行光密度扫描半定量,以CYP19A1与内参照甘油醛-3-磷酸脱氢酶(GAPDH)密度扫描值之比作为评价CYP19A1 mRNA的相对表达量。PCR引物序列及产物长度见表1。
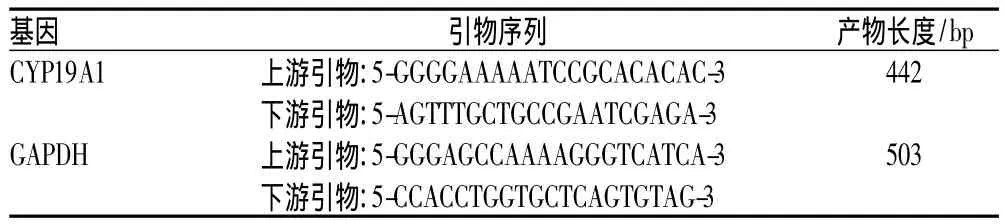
表1 PCR引物序列及产物长度Tab 1 Primer sequences and product length of PCR
1.5 统计学方法
应用SPSS 17.0统计学软件对数据进行处理,结果以均数±标准差()或率(%)表示,均数间比较采用t检验,率的比较采用χ2检验,两变量间的相关性用Spearman相关系数表示,P<0.05为差异有统计学意义。
2 结果
2.1 2组患者临床资料及IVF参数比较
2组患者年龄、不孕年限、体质重指数、基础FSH、窦卵泡数、HCG日E2水平及获卵数的差异无统计学意义(P>0.05);2组患者rFSH使用时间、rFSH总用量、E2/获卵数、MⅡ卵子数/获卵数及优质胚胎率的差异有统计学意义(P<0.05),治疗组rFSH使用时间和rFSH总用量减少,而单个卵泡雌激素水平、成熟卵子率及优质胚胎率均高于对照组,见表2。
表2 2组患者临床资料及IVF参数比较()Tab 2 Clinical data and IVF parameters in two groups()
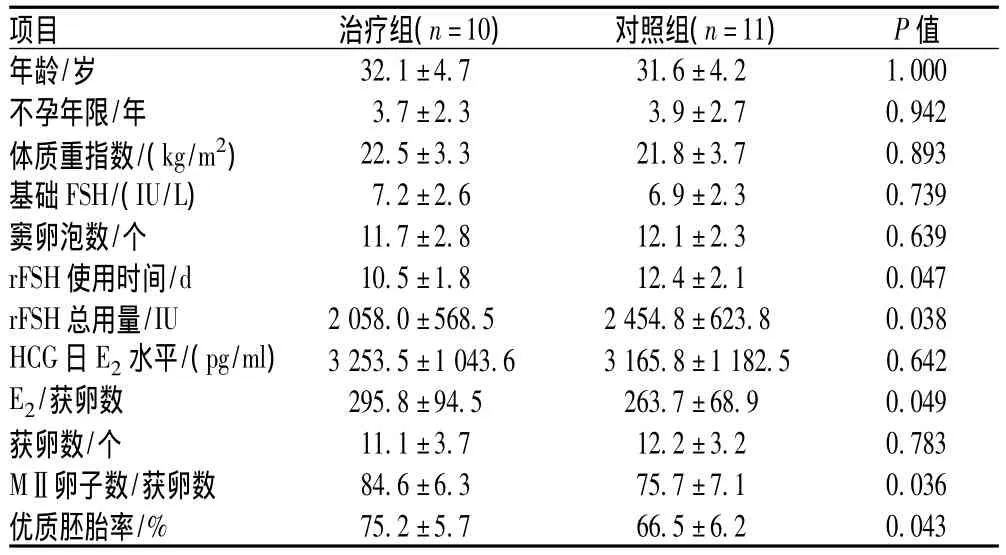
表2 2组患者临床资料及IVF参数比较()Tab 2 Clinical data and IVF parameters in two groups()
项目 治疗组(n=10) 对照组(n=11) P值32.1±4.7 31.6±4.2 1.000不孕年限/年 3.7±2.3 3.9±2.7 0.942体质重指数/(kg/m2) 22.5±3.3 21.8±3.7 0.893基础FSH/(IU/L) 7.2±2.6 6.9±2.3 0.739窦卵泡数/个 11.7±2.8 12.1±2.3 0.639 rFSH使用时间/d 10.5±1.8 12.4±2.1 0.047 rFSH总用量/IU 2058.0±568.5 2454.8±623.8 0.038 HCG日E2水平/(pg/ml) 3253.5±1043.6 3165.8±1182.5 0.642 E2/获卵数 295.8±94.5 263.7±68.9 0.049获卵数/个 11.1±3.7 12.2±3.2 0.783 MⅡ卵子数/获卵数 84.6±6.3 75.7±7.1 0.036优质胚胎率年龄/岁/% 75.2±5.7 66.5±6.2 0.043
2.2 2组患者治疗前后肾虚证候积分变化比较
COH治疗前,治疗组患者(n=10)肾虚证候积分为(10.8±2.7)分,对照组(n=11)为(10.6±2.3)分,2组差异无统计学意义(P>0.05);COH治疗后,治疗组患者肾虚症状明显改善,肾虚证候积分为(7.2±2.1)分,而对照组患者肾虚证候积分反而较治疗前升高,为(11.5±2.9)分,2组差异有统计学意义(P<0.05)。
2.3 2组患者卵巢颗粒细胞CYP19A1 mRNA相对表达量的比较
2组患者卵巢颗粒细胞提取RNA经实时荧光定量PCR扩增,PCR产物经过电泳,在503 bP显示GAPDH内参条带,在442 bP显示CYP19A1条带,见图1。治疗组患者卵巢颗粒细胞CYP19A1 mRNA相对表达量为0.41±0.06,明显高于对照组的0.22±0.04,差异有统计学意义(P<0.05)。
2.4 CYP19A1 mRNA相对表达量与IVF参数相关性分析
CYP19A1 mRNA相对表达量与MⅡ卵子数/获卵数及E2/获卵数呈正相关(相关系数分别为r=0.431,r=0.336,P<0.05),与rFSH总用量、rFSH使用时间及获卵数无相关性,见表3。

表3 CYP19A1 mRNA相对表达量与IVF参数相关性分析Tab 3 Correlation between expression of CYP19A1 mRNA and IVF parameters
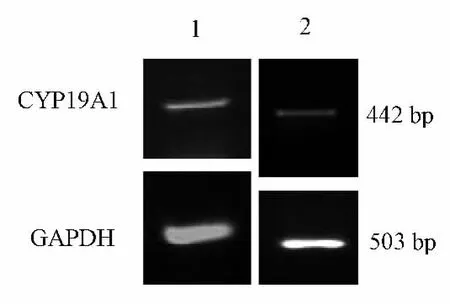
图1 RT-PCR检测2组细胞中CYP19A1 mRNA的表达情况Fig 1 mRNA expression of CYP19A1 of the two groups as detected by RT-PCR
3 讨论
肾藏先天之精,得后天水谷精气之养,化生生殖之精,藏于肾中,为肾主生殖之根本和基础。随着先、后天精气互资互充,肾中精气渐盛,产生天癸。在女子,卵泡“二七天癸至,任脉通,太冲脉盛,月事以时下,故有子”。肾中先天之精是产生生殖之精的物质基础,卵母细胞的生成、发育、成熟均以肾所藏精气为物质基础,肾中精气不足是卵泡发育障碍的基本病机。超排卵的过程中,短时间内卵泡急速发育,天癸大量泌至,耗损肾之阴阳,造成肾中精、气、血的相对不足,形成肾虚为本的证候群[4]。补肾调周法遵循中医“天人合一”思想,补肾为主,结合行气活血补血,从宏观上总体协调机体的内分泌环境,提高排卵细胞质量[5]。何嘉林教授认为,补肾调周有助于改善卵巢的储备功能,提高促排卵周期卵巢的敏感性,增加获卵数,改善卵子质量,提高种植率和妊娠率[6]。马景兰等[7]将滋肾填精、行气活血的“助孕丸”配合COH方案应用于IVF中,发现“助孕丸”组患者卵细胞成熟度、移植前卵泡评分、获卵数、形成胚胎数均优于对照组,说明“助孕丸”能提高卵子和胚胎质量,有利于提高妊娠率。连方等[8]应用补肾益天癸的二至天癸方干预促排卵周期的小鼠,发现对照组小鼠卵子受精能力和早期胚胎分裂能力低于中药组,且异常卵裂球所占比例较大,提示二至天癸方能减少促排卵药对卵子发育、受精能力及卵裂能力的影响。本研究以补肾调周法为治疗大法,根据IVF-ET的COH方案配以育泡组方(主要由补肾益精类中药组成,包括紫河车、菟丝子、熟地黄、枸杞子、当归等)。结果显示,治疗组患者肾虚症状明显改善,对照组患者肾虚症状无明显改善,反而增高;治疗组患者rFSH使用时间和rFSH总用量减少,而单个卵泡雌激素水平、成熟卵子率及优质胚胎率均高于对照组,与上述学者的研究结论一致,表明补肾调周系列方可改善促排卵周期卵母细胞的质量,减少促性腺激素的用量和用药时间。
从卵母细胞的募集到卵母细胞的成熟,颗粒细胞都起着重要的作用。颗粒细胞表面有丰富的受体并能分泌多种具有生物活性的激素,能特殊地表达P450arom[9]。卵母细胞本身不表达促性腺激素的受体,FSH受体仅存在于卵巢的颗粒细胞。颗粒细胞之间以及颗粒细胞和卵母细胞之间通过广泛的缝隙连接形成一个功能上的整体,它介导促性腺激素对卵母细胞的调节,同时通过自分泌或旁分泌作用,维持有利于卵母细胞成熟的微环境[10]。卵泡发育早期,颗粒细胞表面的FSH受体活性较强,FSH作用于颗粒细胞上的FSH受体,随卵泡发育,颗粒细胞对FSH敏感性逐渐增加。在超排卵的过程中,卵泡FSH与颗粒细胞膜受体结合后激活 CYP19基因,刺激P450arom转录,活化P450arom系统,雄激素透过基膜弥散转运至颗粒细胞,而后在活化的颗粒细胞P450arom催化作用下转变为雌激素。P450arom是CYPl9基因的产物,也是E2生物合成中的关键酶和限速酶,其表达及其功能调节会使E2生成量发生显著变化,其中CYP19A1基因位于染色体15q21.2区位,与血清雌激素水平息息相关[11]。本研究结果显示,治疗组患者CYP19A1 mRNA相对表达量高于对照组,CYP19A1 mRNA相对表达量与MⅡ卵子数/获卵数及E2/获卵数呈正相关,表明补肾益精类中药可以提高CYP19A1 mRNA的表达,改善颗粒细胞分泌功能,从而更有利于提高卵母细胞的质量、改善胚胎的质量。
综上所述,在IVF-ET治疗周期中应用补肾益精类中药,可明显改善患者肾虚症状,减少rFSH用量,提高成熟卵子率及优质胚胎率。补肾益精类中药是临床常用的有效药物,可提高颗粒细胞CYP19A1 mRNA的表达,改善颗粒细胞分泌功能,这可能是其改善IVF结局的机制之一。
[1]RuddyKJ,PartridgeAH.Fertility(male and female)andmenopause[J].J Clin Oncol,2012,30(30):3705-3711.
[2]黄艳芳,朱荩雯.补肾调周法治疗不孕症疗效观察[J].陕西中医,2014,35(11):1446-1447.
[3]Czajka-Oraniec I,Simpson ER.Aromatase research and its clinical significance[J].Endokrynol Pol,2010,61(1):126-134.
[4]常秀峰,高星,张敏,等.补肾调经方在体外受精-胚胎移植助孕中的应用[J]。中华中医药杂志,2011,26(5):1123-1125.
[5]江胜芳,张昌军,黄晓卉,等.补肾调周系列方改善体外受精-胚胎移植失败患者卵巢反应性的临床观察[J].湖北中医学院学报,2010,12(3):54-55.
[6]金方.何嘉林谈在辅助生殖技术中中医药的应用[J].北京中医,2004,23(6):329-330.
[7]马景兰,马建新,王旭初,等.促孕丸在“试管婴儿”中的应用[J].中国中西医结合杂志,2005,25(6):547-548.
[8]连方,孙振高,穆琳,等.二至天癸颗粒提高卵细胞质量与小鼠卵巢内IGF-lR mRNA表达量关系的研究[J].中国中西医结合杂志,2006,26(5):431-434.
[9]Sun J,Jin C,Wu H,et al.Effects of electro-acupuncture on ovarian P450arom,P450c17α and mRNA expression induced by letrozole in PCOS rats[J].PLoS One,2013,8(11):e79382.
[10]SommersbergB,Bulling A,SalzerU,etal.Gap junction communication and connexin 43 gene expression in a rat granulosa cell line:regulation by follicle-stimulating hormone[J].Biol Reprod,2000,63(6):1661-1668.
[11]Ehrlich S,Williams PL,Hauser R,et al.Urinary bisphenol A concentrations and cytochrome P45019 A1(Cyp19)gene expression in ovarian granulosa cells:an in vivo human study[J].Reprod Toxicol,2013,42:18-23.

