姜黄素对乳腺癌MCF-7细胞的抗肿瘤作用及其分子机制
邓 姗,杨兴斌,王 宁,刘亚菲(陕西师范大学食品工程与营养科学学院,陕西西安710119)
姜黄素对乳腺癌MCF-7细胞的抗肿瘤作用及其分子机制
邓姗,杨兴斌*,王宁,刘亚菲
(陕西师范大学食品工程与营养科学学院,陕西西安710119)
在本实验中,通过MTT法和LDH法检测姜黄素对MCF-7细胞抗肿瘤和毒性作用,通过流式细胞仪的分析揭示了姜黄素对细胞周期、细胞凋亡、线粒体膜电位(△ψm)的影响,利用caspase试剂盒来检验caspase的活性以及用western blot法检测凋亡蛋白Bax、Bcl-2、PARP、细胞色素c的表达。结果显示姜黄素对MCF-7细胞有抗肿瘤以及毒性作用;姜黄素能使MCF-7阻滞在G0/G1期,可以诱导细胞凋亡。在姜黄素作用下细胞的线粒体膜电位(△ψm)增加,caspase-3、caspase-9、Bax、PARP蛋白表达上调,同时细胞色素c从线粒体释放到细胞液中,而Bcl-2的表达减少。这些结果表示姜黄素可以通过使MCF-7细胞的周期阻滞在G0/G1期和通过线粒体途径诱导的凋亡两方面来引起对乳腺癌MCF-7细胞的抗肿瘤作用。
姜黄素,抗肿瘤作用,细胞周期,细胞凋亡,线粒体
姜黄素是一种从姜科植物姜黄中提取的多酚色素,具有强烈的抗氧化、抗突变和抗癌特性[1-2]。近年的研究发现,姜黄素可预防化学性和放射性物质诱导的实验动物的食道癌、胃癌等多种肿瘤的形成,并可抑制多种体外建株肿瘤细胞的生长[3-4]。但是有关对MCF-7细胞的作用研究较少,特别是分子机制方面研究很少[1-3]。本实验主要通过MTT法、LDH法,观察姜黄素对MCF-7细胞生长、细胞周期、细胞凋亡的作用,并首次通过western blot的方法对细胞凋亡的机制进行了研究。
1 材料与方法
1.1材料与仪器
乳腺癌MCF-7细胞、正常乳腺细胞H184B5F5/ M10北京协和医院;姜黄素武汉试剂公司,95%;小牛血清、RPMI-1640基本培养基、LDH测定试剂盒、BCA蛋白质浓度测定试剂盒、caspase-3试剂盒、caspase-9试剂盒美国gibco公司产品;二甲基亚砜(DMSO)、五氟尿嘧啶(5-Fu)、胰蛋白酶、3-(4,5-二甲基噻挫-2)-2,5-二苯基四氮挫溴盐(MTT)、4’6-二脒基-2-苯基吲哚(DAPI)、十二烷基硫酸钠(SDS)、核糖核酸酶(RNase)、碘化丙啶(PI)、罗丹名123(RH123)、聚偏二氟乙烯膜(PVDF膜) 美国Sigma公司;Bax、Bcl-2、PARP、细胞色素c的一抗以及相应的二抗美国艾美捷有限公司;磷酸盐缓冲液(PBS)自配;抗体稀释液(PBST)、EDTA、NaHCO3及其他试剂均为分析纯。
SCO型CO2恒温培养箱、ESCO型超净工作台新加坡艺思高科技有限公司;MR23i高速低温离心机法国Jouan公司;酶标仪、TU-1810型紫外分光光度计北京普析通用公司;IX51型倒置显微镜日本Olympus公司。
1.2实验方法
1.2.1细胞培养乳腺癌MCF-7细胞采用含10%小牛血清的RMPI-1640细胞培养基,常规培养于37℃、5%CO2饱和湿度培养箱内,待其贴壁生长至70%~80%时,用0.05%胰蛋白酶消化传代[1]。
1.2.2姜黄素对MCF-7细胞增殖的抑制作用采用MTT方法,分别取乳腺癌MCF-7和正常乳腺细胞H184B5F5/M10对数生长细胞接种于96孔板上,在5% CO2,37℃条件下培养24 h,待细胞贴壁后,分别用不同浓度的姜黄素作用于细胞,每组设6个复孔,以含相同浓度DMSO的培养液为对照,分别于培养12、24、48 h后每孔加入MTT溶液(5 mg/mL)20 μL,继续孵育4 h,终止培养,小心吸去孔内培养上清液,每孔加入150 μL SDS,振荡10 min,使结晶物充分溶解。在酶联免疫检测仪上测定各孔570 nm波长光吸收值并记录结果,每组实验重复3次。
癌细胞存活率(%)=1-[(1-试验组平均吸光度A值/对照组平均吸光值A值)×100][5]
1.2.3姜黄素对MCF-7细胞的毒性作用乳腺癌MCF-7细胞和正常乳腺细胞H184B5F5/M10用不同浓度姜黄素作用后,用LDH实验[5]测定细胞毒性,分光光度计在450 nm波长检测。通过检测细胞培养上清中LDH的活性,确定姜黄素对细胞的毒性[5]。
1.2.4流式细胞仪测定细胞周期分别取乳腺癌MCF-7对数生长细胞接种于6孔板上,在5%CO2,37℃条件下培养24 h,待细胞贴壁后,分别用0、50、100 μmol/L姜黄素作用于细胞,细胞被收集后,用70%乙醇-20℃下固定过夜,过夜后加入1 mL PBS和10 μL RNase室温下培养30 min,再加入10 μL PI培养30 min,最后用流失细胞仪对处理好的细胞进行周期测定[6]。
1.2.5细胞的凋亡情况的测定取对数期MCF-7细胞接种于6孔板上,在5%CO2,37℃条件下培养24 h,待细胞贴壁后,分别用0、50、100 μmol/L姜黄素作用于细胞,培养24 h后,利用胰蛋白酶对细胞进行消化,然后离心,根据Annexin V-FITC细胞凋亡检测试剂盒上的说明进行实验操作,利用流式细胞仪检测细胞的凋亡情况[7]。
1.2.6线粒体膜电位(△ψm)的测定利用染色剂Rh123对处理后的细胞进行染色,然后通过流式细胞仪进行测定。将分别用0、25、50、100 μmol/L姜黄素处理的细胞加入1 mmol/L Rh123,然后在37℃条件下培养30 min,处理好的细胞利用流式细胞仪来测定细胞的线粒体膜电位(△ψm)[8]。
1.2.7caspase-3和caspase-9活性的确定通过caspase试剂盒对caspase-3和caspase-9的活性进行测定,分别将0、25、50、100 μmol/L的姜黄素处理过的细胞在冰上用裂解液裂解15 min,进行13000 r/min 30 min离心,取上清液,然后在96孔板中于每20~40 μg蛋白中加入90 μL相应的探针和10 μL相应的催化酶,37℃下培养2 h,最后通过酶蛋白仪测定样品的吸光值来确定caspase-3和caspase-9的活性[9]。
1.2.8Western Blot检测细胞蛋白表达利用western blot方法检测相关目的蛋白的表达情况。取对数期MCF-7细胞,制成3×105个/mL单细胞悬液,接种于细胞培养瓶中,在37℃、5%CO2培养箱中培养24 h后,给予0、50、100 μmol/L的姜黄素处理,继续孵育24 h后,收集细胞。将以上处理好的细胞进行蛋白收集,然后按照BCA试剂盒的方法对蛋白进行定量分析,定量好的蛋白进行12%SDS-PAGE,上样蛋白量25 μg/孔;浓缩电压80 V,30 min,分离电压100 V,1.5 h。将电泳后的凝胶上的蛋白转移至PVDF膜上,用5%脱脂牛奶在室温下封闭2 h,在杂交袋中与相对应的一抗(一抗工作浓度均为1∶1000)4℃孵育过夜。一抗孵育结束后用PBST洗膜3次,每次10 min。与相应来源的二抗在杂交袋中室温孵育1 h。孵育结束后用PBST洗膜三次,每次10 min。之后用ECL发光液在暗室曝光并压片[9]。
1.3数据分析与处理
实验数据以mean±SD表示,所有数据均为三次重复实验的平均值,使用Excel软件以及SPSS 16.0统计分析软件对数据进行分析处理。
2 结果与分析
2.1姜黄素对MCF-7存活率的影响
图1所示为姜黄素作用于人乳腺癌MCF-7细胞12、24、48 h后细胞存活率变化情况。该图表示姜黄素抑制MCF-7细胞的增长,并且一直呈现浓度剂量效应和时间剂量效应。姜黄素浓度12.5、25、50、100 μmol/L作用MCF-7细胞24 h后,对MCF-7细胞有明显的抑制作用;但是相同浓度的姜黄素对正常乳腺上皮细胞H184B5F5/M10,并没有观察到与MCF-7相同的抑制作用(图2)。MTT的结果显示姜黄素对乳腺癌MCF-7细胞有明显的抗肿瘤作用。
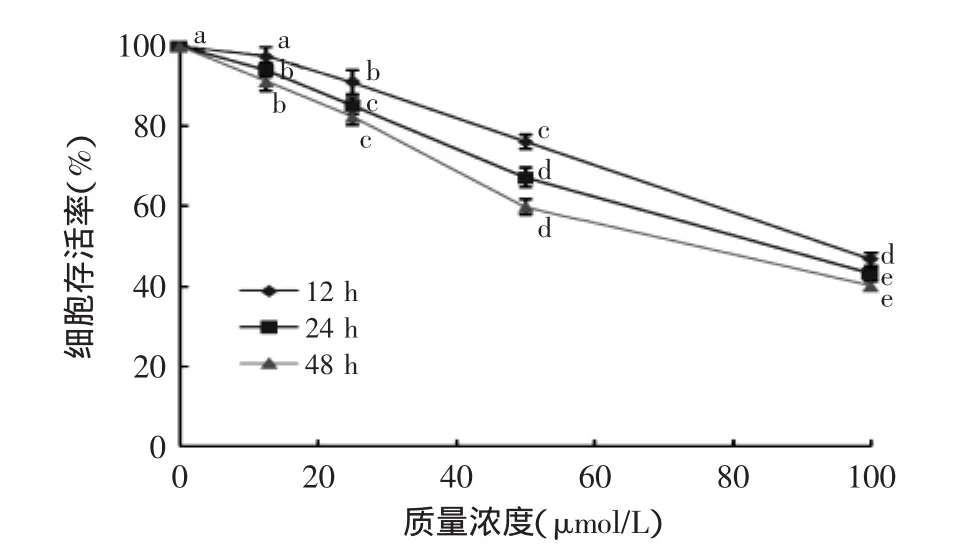
图1 不同浓度姜黄素对MCF-7细胞存活率的影响Fig.1 Effect of concentrations of CUR on the MCF-7 cells proliferation
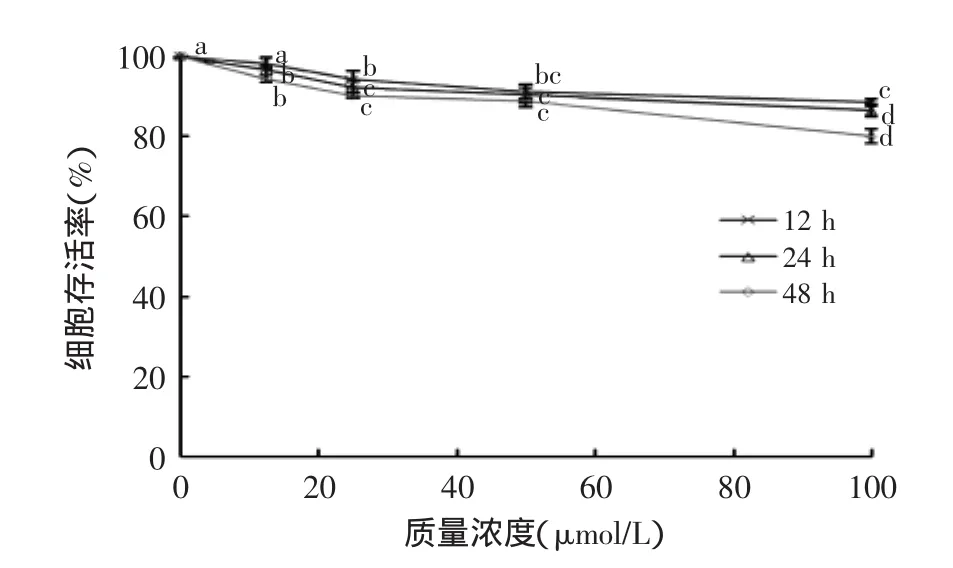
图2 不同浓度姜黄素对H184B5F5/M10细胞存活率的影响Fig.2 Effect of concentrations of CUR on the H184B5F5/M10 cells proliferation
2.2姜黄素对MCF-7细胞毒性的影响
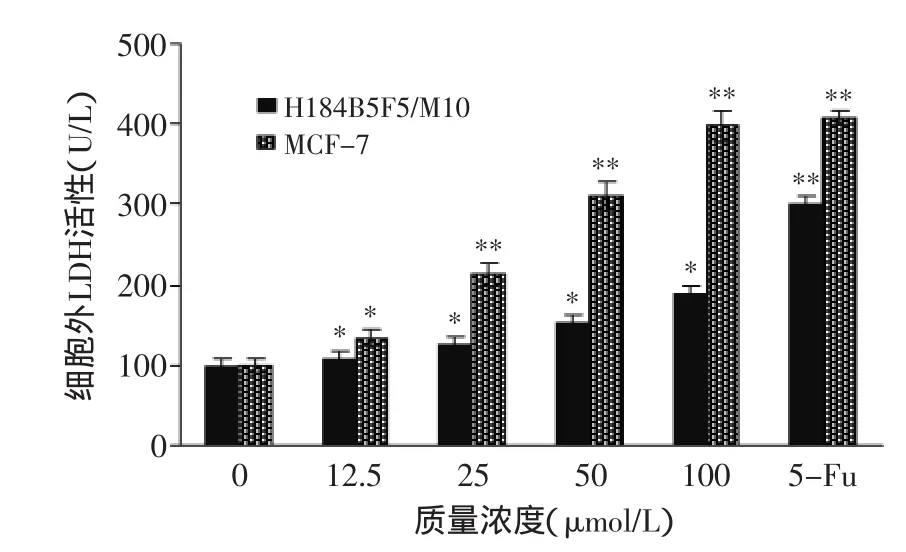
图3 不同浓度姜黄素对MCF-7和H184B5F5细胞LDH的影响Fig.3 Effect of concentrations of CUR on the MCF-7 cells and H184B5F5 LDH activities
如图3所示,在12.5、25、50、100 μmol/L姜黄素作用下,随着姜黄素组分浓度的增大,胞外LDH的活性越强,即样品对肿瘤细胞的毒性作用越强,结果显示姜黄素的细胞毒性作用依旧随其浓度的上升而上升。同时由图3可知100 μmol/L姜黄素作用MCF-7细胞的效果和50 μmol/L 5-Fu作用癌细胞的效果相似,但是和MTT一样,当用姜黄素对正常细胞H184B5F5/ M10作用时,则没有类似的效果,结果显示,姜黄素对人乳腺癌细胞MCF-7有较强的细胞毒效应,且有量效依赖关系。
2.3姜黄素对MCF-7细胞细胞周期的影响
为了阐明姜黄素对MCF-7细胞的生长抑制作用是否与细胞周期阻滞有关,分析了姜黄素对细胞周期的影响。如图4,细胞周期实验结果显示,姜黄素对MCF-7细胞周期有一定的阻滞作用。当姜黄素以浓度0、50、100 μmol/L作用MCF-7细胞,G0/G1期的细胞由42.9%上升到58.3%、65.8%。同时在S期的细胞由控制组的50.4%下降到41.6%、4.2%,而G2/M相对于其他两组的变化不明显。因此,该细胞周期实验表明,姜黄素对MCF-7周期有阻滞作用,将细胞周期阻滞在G0/G1期。
2.4Annexin V-FITC/PI双染法定量检测细胞凋亡结果
细胞凋亡是一个主动的程序性死亡过程,被多细胞生物用来去除不需要的、异常的或具有潜在危害性的细胞,是维持体内细胞数量动态平衡的基本措施。为了对姜黄素引起MCF-7细胞凋亡进行定量分析,采用Annexin V-FITC/PI双染法分析细胞经姜黄素处理后的凋亡情况。如图5所示Annexin V/PI凋亡双染法对姜黄素引起MCF-7细胞凋亡的定性定量结果。从图5中可看出,经0、50、100 μmol/L姜黄素处理24 h的MCF-7细胞出现了3.9%、27.6%、54.1%的凋亡。在50、100 μmol/L姜黄素处理细胞24 h,在出现早期凋亡的同时,伴随有3.7%、11.3%的晚期凋亡。与阳性对照组(5-Fu)相比有明显的效果。综合LDH实验结果,可以认为姜黄素在诱导MCF-7细胞凋亡的同时,伴随有少量的细胞坏死。因为坏死细胞数占很少数,故不做深入研究。
2.5线粒体膜电位(△ψm)的检测结果
大量研究显示,在各种因素诱导细胞凋亡的过程中,均出现线粒体功能的紊乱,尤其是线粒体跨膜电位(△ψm)的破坏。为了探究姜黄素引起的MCF-7细胞凋亡是否与线粒体有关,本实验用RH123检测线粒体膜电位。RH123是一种可以穿透细胞膜的阳离子荧光染料,可以作为线粒体跨膜电位的指示剂。正常情况下,RH123依赖线粒体跨膜电位进入线粒体基质,当细胞凋亡时,线粒体膜电位崩塌,RH123被重新释放出线粒体基质,且因为可以穿透细胞膜,会重新释放出细胞,导致荧光强度下降。图6为流式细胞仪结合RH123检测经不同浓度姜黄素处理后MCF-7细胞线粒体膜电位结果。M1所示为低电位水平,如图6所示,0、25、50、100 μmol/L姜黄素处理MCF-7细胞24 h后,线粒体膜低电位由原来的4.1%上升至9.9%、17.4%和49.6%。结果表明,姜黄素诱导的MCF-7细胞凋亡过程中,出现了线粒体膜电位下降的现象。
2.6线粒体相关蛋白的表达情况
线粒体膜电位的检测结果显示,姜黄素引起了MCF-7细胞线粒体膜电位的崩塌,暗示线粒体参与了姜黄素诱导的MCF-7细胞凋亡过程,即线粒体凋亡途径。Bax和Bcl-2是被认为在线粒体路径凋亡过程中重要的蛋白,继而导致线粒体释放细胞色素c,形成凋亡小体而启动caspase-9活化。最后,死亡执行因子caspase被活化,通过蛋白酶水解而使细胞崩溃。图7表明通过caspase试剂盒对caspase-3和caspase-9的活性进行检测时,caspase-3和caspase-9都相应地被活化。而图8Western blot结果表明:促凋亡蛋白Bax在50、100 μmol/L姜黄素作用24 h后,表达显著升高;抑制凋亡蛋白Bcl-2在同样的条件下,表达下降(Bax/bcl-2的比值明显变化);同时在线粒体中的细胞色素c降低,而相应的在细胞质中细胞色素c增加也被观察到;PRRP蛋白在姜黄素作用24 h后,表达增强。这些蛋白表达变化表明,姜黄素诱导MCF-7细胞凋亡和线粒体途径有关。
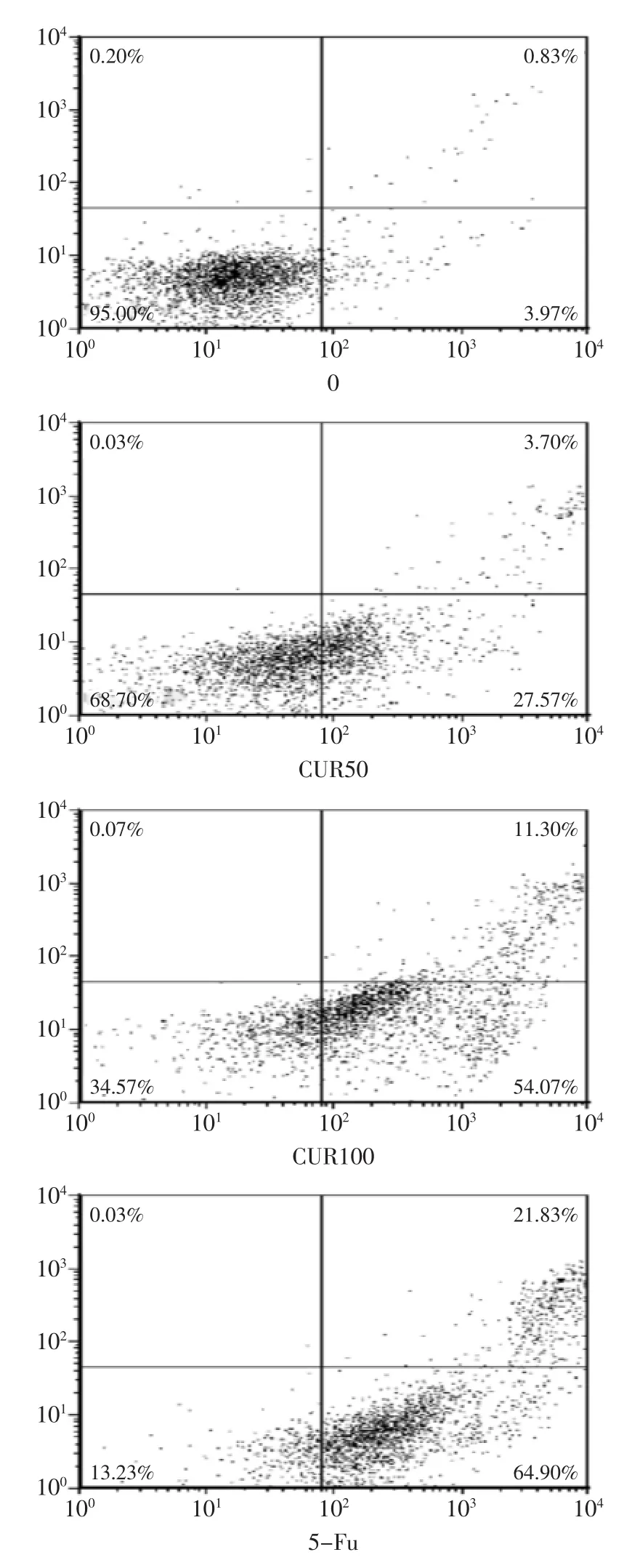
图5 不同浓度姜黄素对MCF-7细胞凋亡的影响Fig.5 Effect of concentrations of CUR on MCF-7 cell apoptosis

图6 不同浓度姜黄素对MCF-7细胞内线粒体膜电位(△ψm)的影响Fig.6 Effect of concentrations of CUR on mitochondrial membrane potential(△ψm)in MCF-7 cells
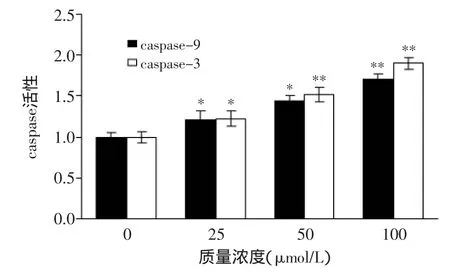
图7 不同浓度姜黄素对MCF-7细胞中caspase蛋白表达的影响Fig.7 Effect of concentrations of CUR on the expression of caspase proteins in MCF-7 cells
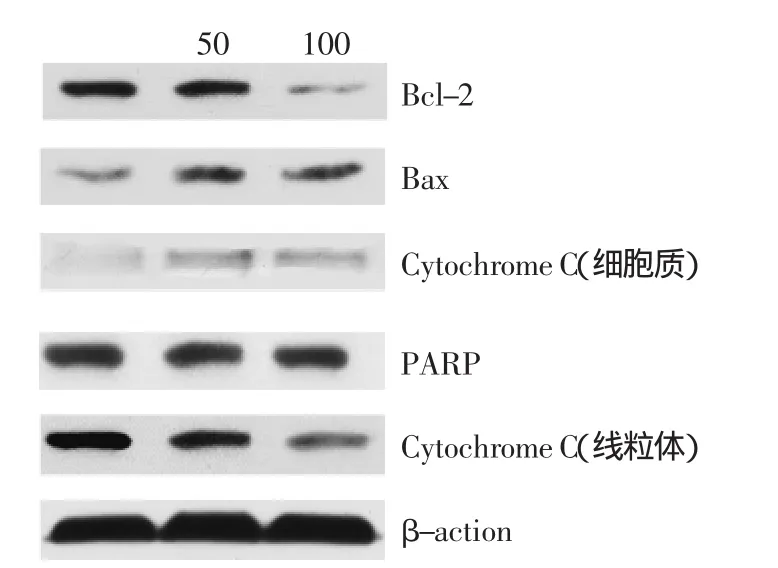
图8 不同浓度姜黄素对MCF-7细胞中细胞凋亡相关蛋白表达的影响Fig.8 Effect of concentrations of CUR on the expression of apoptosis-related proteins in MCF-7 cells
3 讨论
姜黄为姜黄属植物,其根茎入药,是一种药食两用的食物。实验证明,姜黄素具有确切的抗肿瘤活性,其抗癌谱较广、不良反应小,是一种具有广泛应用前景的抗肿瘤新药。本实验观察到姜黄素对人乳腺癌细胞株MCF-7具有明显的增殖抑制作用,并呈时间、剂量依赖关系(图1)。这与文献报道[10]姜黄素可抑制人乳腺癌细胞增殖的结果一致。用不同浓度的姜黄素处理MCF-7细胞,相对于控制组的细胞出现了明显的早凋和晚凋的情况,由此可见姜黄素可引起MCF-7细胞的凋亡(图5)。另一方面,就姜黄素对细胞周期的影响来看,姜黄素对MCF-7细胞的作用主要在G0/G1期阻滞,使细胞无法进入下一增殖周期(图4),这与之前的研究结果是一致的[2]。由本实验可以明确看到在0、50、100 μmol/L姜黄素处理细胞时,G0/G1期细胞逐渐增加,而S期细胞逐渐减少,同时G2/M期细胞没有明显的变化。因此,姜黄素通过影响细胞周期分布而影响细胞的代谢和功能,导致细胞重新分化,达到抑制细胞增殖的目的。这可能是其抗肿瘤机制的另一方面。
本实验研究了姜黄素影响细胞凋亡的机制,最主要是从线粒体方面来研究细胞的凋亡。线粒体被认为与细胞凋亡的发生有重要的关系,研究线粒体的损伤与癌症治疗有着重要的关系。在细胞凋亡的内部通路中,主要是以线粒体为核心成分,然后去激活肿瘤细胞凋亡以及DNA损伤等。同时,任何异常细胞信号都有可能引起促凋亡蛋白(Bax)活化[11],继而导致线粒体释放细胞色素c,形成凋亡小体而启动caspase-9活化,从而导致caspase-3的活化,通过蛋白酶水解而使细胞崩溃,最终引起细胞的凋亡[12]。该凋亡通路可被各种抗凋亡蛋白,如Bcl-2等凋亡抑制因子所调控[13]。当前,关于抗凋亡蛋白Bcl-2以及促凋亡蛋白Bax的研究报道已有很多,尤其是Bax/Bcl-2比例的改变更能说明二者在细胞凋亡中的作用[14]。线粒体的功能障碍可能是细胞发生凋亡的信号,线粒体膜电位的减少以及细胞色素c由线粒体释放到细胞液中,被认为线粒体发生功能障碍最重要的指标[15]。正如图6显示,本实验利用RH123染色法对细胞的线粒体膜电位进行检测。在对用0、25、50、100 μmol/L姜黄素处理的细胞进行膜电位检测时,可以明显发现姜黄素能够诱导线粒体膜电位的破坏。利用caspase试剂盒对caspase进行测定,由图7可知直接参与线粒体凋亡途径的caspase,在25 μmol/L姜黄素作用24 h后即被活化了,由图7可知伴随其水解产物caspase-9含量升高;caspse-3也出现了和caspse-9同样的活化情况。由图8 Western blot实验结果表明:促凋亡蛋白Bax在0、50、100 μmol/L姜黄素作用24 h后,表达显著升高;同时在姜黄素作用24 h后,抑制凋亡蛋白Bcl-2表达下降(Bax/Bcl-2的比值明显变化);同时也发现了细胞色素c由线粒体释放到细胞液中。这些蛋白表达变化表明,姜黄素诱导MCF-7细胞凋亡和线粒体途径有关。
本研究证实了姜黄素对人乳腺癌MCF-7细胞增殖的抑制作用,其增殖抑制效应呈剂量及时间依赖关系,以及姜黄素对细胞周期以及细胞凋亡的影响,并探讨了影响细胞凋亡的线粒体的分子机制。实验结果使姜黄素作为有效以及天然的药物成为一种可能。
4 结论
不同浓度的姜黄素对乳腺癌MCF-7细胞有抗肿瘤以及毒性的作用,其作用呈现浓度剂量效应。细胞周期实验证明了姜黄素能够将MCF-7细胞阻滞在G0/G1期,同时通过对线粒体膜电位(△ψm)和线粒体相关凋亡蛋白表达检测的结果表示:姜黄素能够通过线粒体路径促进MCF-7细胞的凋亡。
[1]赵心宇,盂秀香,贾莉,等.姜黄素抗肿瘤机制[J].实用药物与临床,2006,9(1):51-52.
[2]孙永,方泰惠,周静,等.姜黄素对乳腺癌MCF-7、MDAMB-231细胞增殖、侵袭的影响极其机制探讨[J].山东医药,2011,51(14):66-67.
[3]杨海霞.姜黄素对卵巢癌细胞凋亡的影响[J].山东医药,2012,52(46):37-39.
[4]Duvoix A,Blasius R,Delhalle S,et al.Chemopreventive and therapeutic effects of curcumin[J].Cancer Letters,2005,223(2):181-190.
[5]Li T,Zhu J,Guo L,et al.Differential effects of polyphenolsenriched extracts from hawthorn fruit peels and fleshes on cell cycle and apoptosis in human MCF-7 breast carcinoma cells[J]. Food chemistry,2013,141(2):1008-1018.
[6]He N W,Zhao Y,Guo L,et al.Antioxidant,antiproliferative,and pro-apoptotic activities of a saponin extract derived from the roots of Panax notoginseng[J].Journal of medicinal food,2012,15(4):350-359.
[7]Xu R,Zhang Y,Ye X,et al.Inhibition effects and induction of apoptosis of flavonoids on the prostate cancer cell line PC-3 in vitro[J].Food Chemistry,2013,138(1):48-53.
[8]Chidambara K N,Jayaprakasha G K,Kumar V,et al.Citrus limonin and its glucoside inhibit colon adenocarcinoma cell proliferation through apoptosis[J].Journal of Agricultural and[9]Y in M C,Lin C C,Wu H C,et al.Apoptotic effects of protocatechuic acid in human breast,lung,liver,cervix,and prostate cancercells:potentialmechanismsofaction[J].Journalof Agricultural and Food Chemistry,2009,57:6468-6473.
Food Chemistry,2011,59:2314-2323.
[10]韦达,唐金海,潘立群.姜黄素诱导乳腺癌MCF-7细胞凋亡[J].江苏医药,2008,34(4):348-350.
[11]Marzo I,Brenner C,Zamzami N,et al.Bax and adenine nucleotide translocator cooperate in the mitochondrial control of apoptosis[J].Science,1998,281(5385):2027-2031.
[12]Fulda S,Galluzzi L,Kroemer G.Targeting mitochondria for cancer therapy[J].Nature reviews Drug discovery,2010,9(6):447-464.
[13]Denicourt C,Dowdy S F.Medicine.Targeting apoptotic pathways in cancer cells[J].Science,2004,305(5689):1411-1413.
[14]Babu P P,Yoshida Y,Su M,et al.Immunohistochemical expression of Bcl-2,Bax and cytochrome c following focal cerebral ischemia and effect of hypothermia in rat[J].Neuroscience Letters,2000,291:196-200.
[15]Bell E L,Klimova T,Chandel N S.Targeting the mitochondria for cancer therapy:regulation of hypoxia-inducible factor by mitochondria[J].Antioxidants&redox signaling,2008,10(3):635-640.
Inhibitory effect and molecular mechanisms of curcumin against human breast cancer MCF-7 Cells
DENG Shan,YANG Xing-bin*,WANG Ning,LIU Ya-fei
(Colleage of Food Engineering and Nutritional Science,Shanxi Normal Unversity,Xi’an 710119,China)
In this study,cytotoxic effect and antiproliferative activity was detected by LDH assay and MTT assay. The effect of curcumin on cell cycle,apoptosis,mitochondrial membrane potential(△ψm)was analysed by flow cytometry.The caspase-3 and caspase-9 activities were assessed by caspase assay kit according to the manufacturer’s instruction.The expression patterns of pro-apoptotic and anti-apoptotic Bcl-2 family proteins,cytochrome c,and PARP in curcumin treated MCF-7 cells were investigated by western blot.The results showed that curcumin had a markedly antiproliferative and cytotoxic activity against the MCF-7 cells in a dose-dependent manner.It was indicated that curcumin could result in G0/G1 phase and apoptosis of MCF-7 cells.Curcumin increased△ψm,caspase-3,caspase-9,Bax,PARP expression,decreased Bcl-2 expression,and cytochrome c was found to be released from mitochondria to the cytosol.These results showed that curcumin exhibit anti-proliferation of human breast cancer MCF-7 cells via cell cycle arrest at the G0/G1 phase and apoptosis induced by mitochondrial pathway.
curcumin;antitumor effect;cell cycle;apoptosis;mitochondria
TS201.1
A
1002-0306(2015)18-0362-06
10.13386/j.issn1002-0306.2015.18.065
2014-10-27
邓姗(1989-),女,硕士研究生,研究方向:食品营养学,E-mail:976524323@qq.com。
杨兴斌(1969-),男,教授,主要从事食品科学与营养研究方面的研究,E-mail:xbyang@snnu.edu.cn。
国家自然科学基金项目C31171678。

